Визуализация молекул в JMol
В данном отчёте визуализирована структура бычьего трипсина в комплексе с его ингибитором (PDB ID: 6YIW), 1H-изоиндол-3-амином (показан в качестве лиганда). Кнопка "Start script" запускает работу скрипта, кнопка "Resume" осуществляет переход к следующему изображению.
Визуализация структуры трипсина
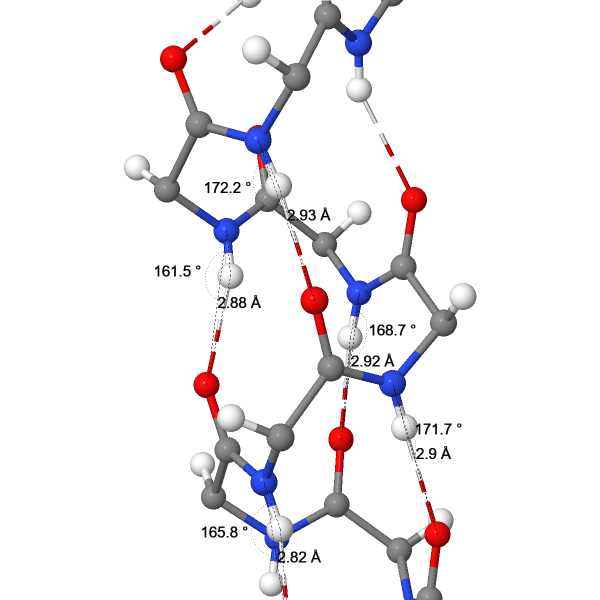
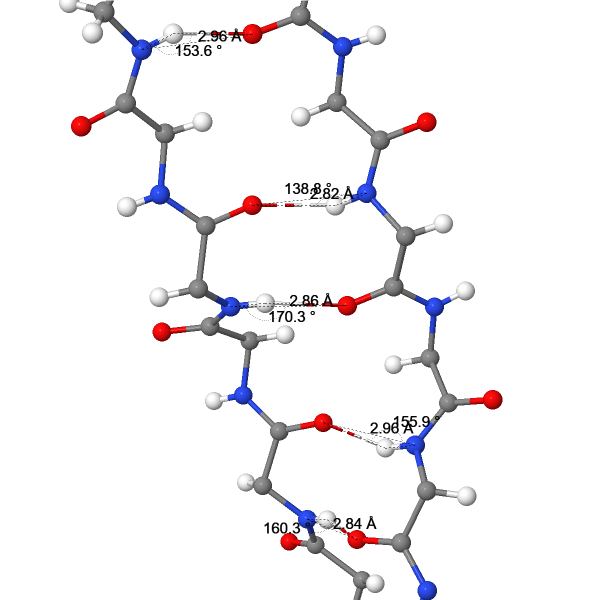
Параметры водородных связей между остовными атомами во вторичной структуре
| Параметры водородных связей между остовными атомами во вторичной структуре | |||
|---|---|---|---|
| № | Имена атомов | Длина связи (Å) | Угол N-H-O (°) |
| Альфа-спирали | |||
| 1 | O(234TYR) - N(238ILE) | 2.82 | 165.8 |
| 2 | O(235VAL) - N(239LYS) | 2.90 | 171.7 |
| 3 | O(236SER) - N(240GLN) | 2.92 | 169.5 |
| 4 | O(237TRP) - N(241THR) | 2.88 | 161.5 |
| 5 | O(238ILE) - N(242ILE) | 2.93 | 172.2 |
| Среднее значение | 2.89 | 168.14 | |
| Ожидаемое среднее значение(1) | 2.99±0.14 | 155±11 | |
| Бета-тяжи | |||
| 6 | O(160ALA) - N(136CYS) | 2.84 | 160.3 |
| 7 | O(136CYS) - N(160ALA) | 2.96 | 155.9 |
| 8 | O(158LEU) - N(138ILE) | 2.86 | 170.3 |
| 9 | O(138ILE) - N(158LEU) | 2.82 | 138.8 |
| 10 | O(156LYS) - N(140GLY) | 2.96 | 153.6 |
| Среднее значение | 2.89 | 155.78 | |
| Ожидаемое среднее значение(1) | 2.91±0.14 | 160±10 | |
Вывод
Полученные в данной работе длины водородных связей альфа-спирали и бета-листа соответствуют своим средним значениям для этих структур (указаны в таблице) (1). Углы H-N-O превышают свои средние значения в альфа-спиралях, в бета-листах соответствуют им. Отклонение от среднего углов H-N-O в альфа-спирали можно объяснить тем, что рассматриваемая альфа-спираль является C-концевой, из-за отрицательного заряда на её концевой карбокси-группе полярность диполя на альфа-спирали усиливается, возможно из-за этого углы H-N-O становятся больше.
Список литературы
- Baker, E. N., & Hubbard, R. E. Hydrogen bonding in globular proteins. Progress in Biophysics and Molecular BiologyProg Biophys Mol Biol . 1984; 44(2):97-179. doi: 10.1016/0079-6107(84)90007-5.