Обзор архейного транскрипционного фактора TrmB
Введение
TrmB (Табл. 1) – репрессор, у подавляющий экспрессию генов, ответственных за транспорт и метаболизм мальтозы и трегалозы. При связывании этих дисахаридов TrmB репрессирует mal оперон, отвечающий за их метаболизм в нём закодирован соответствующий ABC-транспортер и пермеазы, сам TrmB и другие белки. Репрессия осуществляется прикреплением TrmB к ТАТА боксу оперона [1]. Таким образом, с помощью TrmB осуществляется отрицательная обратная регуляция этого оперона. Исследуемый репрессор выделен из археи Thermococcus litoralis (Рис. 1). Она относится к порядку Thermococcales, представители которого составляют основу морских гипертермофильных сообществ. Как и другие представители порядка, T. litoralis облигатно анаэробна, в качестве источника углерода использует сахара и восстанавливает элементарную серу до H2S. T. litoralis интересна высоким для порядка GC-составом (56%), а также одной из наиболее термостабильных в порядке ДНК-полимераз, для изучения которой, вероятно, секвенировали геном T. litoralis [2], [3], [4].
Анализ информации о TrmB
| Раздел UniProtKB | Swiss-Prot |
| Рекомендуемое UniProt название | HTH-type sugar sensing transcriptional regulator TrmB |
| UniProt ID | TRMBR_THELN |
| UniProt AC | Q7LYW4 |
| EMBL AC | AF307053; CP006670 |
| PDB ID | 2F5T |
| Длина, аминокислотные остатки | 338 |
| Молекулярная масса, Да | 38839 |
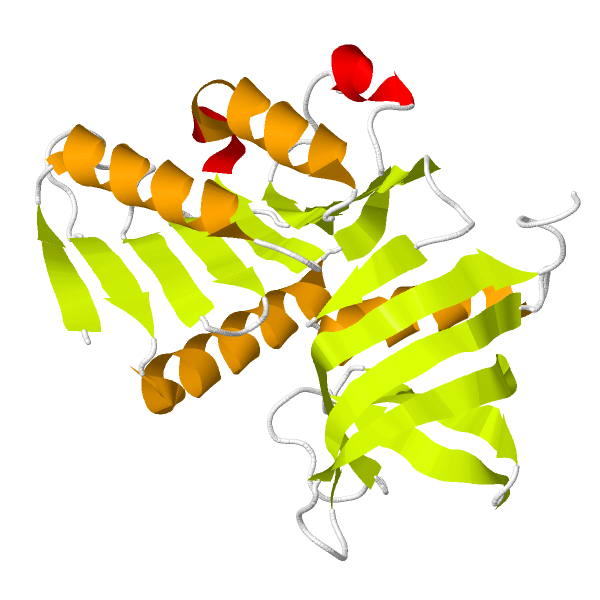
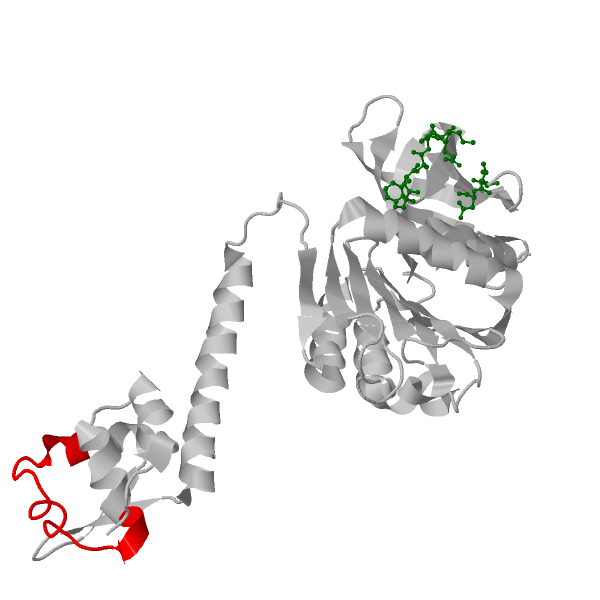
У TrmB T. litoralis известна структура только для сахаросвязывающего домена. Для определения структуры ДНК-связывающего был проведён поиск записей о TrmB других видов в UniprotKB (Табл. 3). Было обнаружено, что в порядке Thermococcales есть достоверная информация о TrmB ещё одного вида: Pyrococcus furiosus. TrmB у T. litoralis и P. furiosus практически идентичны, что объясняется горизонтальным переносом генов между этими видами. Однако TrmB P. furiosus также репрессирует оперон, отвечающий за транспорт и метаболизм мальтодекстринов. Для данного белка известна полная структура (Рис. 3). С ДНК TrmB связывается HTH-мотивом [5].
О распространённости TrmB среди архей сложно судить, так как проверка существования предсказанных белков идёт достаточно медленно. Так, по истории записи о TrmB T. litoralis видно, что существование белка было подтверждено через три года после появления записи о нём в UniProtKB, а в Swiss-Prot она была занесена только через 10 лет, хотя это время (2004-2014) включало период наиболее быстрого роста количества рецензированных записей о белках [6].
Структура белка была внесена в UniProt-файл лишь через 7 лет после её появления в pdb. Видимо, эти данные не записываются при автоматическом аннотировании, так как они начали появляться в записи UniProt (в полях FT) вместе с комментариями в полях CC, которые составляются вручную рецензентами. В полях CC обычно указывается важная информация о белке, которую нельзя записать в строгом формате, как в других полях. Однако к ней тоже есть несколько формальных требований: каждый смысловой блок начинается с новой строки и имеет структуру:
CC -!- ОБОБЩАЮЩАЯ ФРАЗА: Информация.
В таком формате записано, например, что TrmB существует в форме гомодимера, а также перечислены его домены (ДНК-связывающий и сахаросвязывающий). Помимо данных о белке в полях CC может быть записана техническая информация, например, данные об авторском праве на запись. Они отделяются от остального текста строками из дефисов.
Степень распространённости белка можно отчасти оценить по размеру содержащих их кластеров. Во всех кластерах Uniref репрезентативной последовательностью является TrmB P. furiosus, так как в записи UniProt о нём приведено больше информации, чем о TrmB T. litoralis. Сидом TrmB T. litoralis тоже не является, так как во всех кластерах есть последовательности, большие по длине. Все 35 последовательностей из наибольшего кластера принадлежат представителям порядка Thermococcales. Это означает, что белки под названием TrmB в других порядках архей не являются гомологичными исследуемому. Но для некоторых из них указана та же функция. Поэтому, вероятно, регуляция mal оперона настолько важна для архей, что осуществляющие её белки возникали в ходе эволюции независимо. Также это косвенно следует из того, что записей о белках с названием TrmB у архей больше, чем записей о белках с HTH-мотивом (хотя скорее всего записей про HTH меньше из-за недостаточной аннотированности записей из TrEMBL, и не для каждого TrmB в записи указан его HTH: в Swiss-Prot наблюдается обратное соотношение).
| База данных | ID кластера | Размер кластера |
|---|---|---|
| UniRef100 | UniRef90_Q9HGZ9 | 4 |
| UniRef90 | UniRef50_Q9HGZ9 | 4 |
| UniRef50 | UniRef100_Q9HGZ9 | 35 |
| № | Текст запроса | Количество результатов | Описание результата |
|---|---|---|---|
| 1 | name:trmb organism:"thermococcus litoralis" | 8 | Записи с названием TrmB T. litoralis |
| 2 | name:trmb organism:"thermococcus litoralis strain atcc 51850 dsm 5473 jcm 8560 ns-c" | 4 | Записи с названием TrmB штамма T. litoralis, которому принадлежит исходная запись (Табл. 1) |
| 3 | name:trmb organism:"thermococcus litoralis" (existence:"Evidence at protein level [1]" OR existence:"Evidence at transcript level [2]") | 1 | Записи в Uniprot с названием TrmB T. litoralis, в которых существование белка было подтверждено последовательностью белка или транскрипта (далее обозначается, как "достоверные записи") |
| 4 | name:trmb taxonomy:"Thermococcales [2258]" (existence:"Evidence at protein level [1]" OR existence:"Evidence at transcript level [2]") | 2 | Достоверные записи в Uniprot с названием TrmB в порядке Thermococcales |
| 5 | name:trmb taxonomy:archaea (existence:"Evidence at protein level [1]" OR existence:"Evidence at transcript level [2]") | 4 | Достоверные записи в Uniprot с названием TrmB всех архей |
| 6 | name:trmb taxonomy:archaea | 7844 | Все записи в Uniprot с названием TrmB всех архей |
| 7 | organism:"thermococcus litoralis" (existence:"Evidence at protein level [1]" OR existence:"Evidence at transcript level [2]") annotation:(type:function maltose) | 7 | Достоверные записи о белках T. litoralis, участвующих в метаболизме мальтозы |
| 8 | organism:"thermococcus litoralis" (existence:"Evidence at protein level [1]" OR existence:"Evidence at transcript level [2]") annotation:(type:dna_bind "h-t-h motif") | 1 | Достоверные записи о белках T. litoralis с HTH-мотивом |
| 9 | (existence:"Evidence at protein level [1]" OR existence:"Evidence at transcript level [2]") annotation:(type:dna_bind "h-t-h motif") taxonomy:"Archaea [2157]" | 27 | Достоверные записи о белках всех архей с HTH-мотивом |
| 10 | annotation:(type:dna_bind "h-t-h motif") taxonomy:"Archaea [2157]" | 2910 | Все записи о белках всех архей с HTH-мотивом |
| 11 | annotation:(type:transmem) AND organism:"Thermococcus litoralis (strain ATCC 51850 / DSM 5473 / JCM 8560 / NS-C) [523849]" AND proteome:up000015502 | 519 | Записи о трансмембранных белках T. litoralis |
| 12 | annotation:(type:transmem) AND organism:"Methanospirillum hungatei JF-1 (strain ATCC 27890 / DSM 864 / NBRC 100397 / JF-1) [323259]" AND proteome:up000001941 | 547 | Записи о трансмембранных белках M. hungatei |
| 13 | keyword:dna-binding AND organism:"Thermococcus litoralis (strain ATCC 51850 / DSM 5473 / JCM 8560 / NS-C) [523849]" AND proteome:up000015502 | 67 | Записи о ДНК-связывающих белках T. litoralis |
| 14 | keyword:dna-binding AND organism:"Methanospirillum hungatei JF-1 (strain ATCC 27890 / DSM 864 / NBRC 100397 / JF-1) [323259]" AND proteome:up000001941 | 44 | Записи о ДНК-связывающих белках M. hungatei |
| 15 | annotation:(type:function chaperone) AND organism:"Thermococcus litoralis (strain ATCC 51850 / DSM 5473 / JCM 8560 / NS-C) [523849]" AND proteome:up000015502 | 3 | Записи о шаперонах T. litoralis |
| 16 | annotation:(type:function chaperone) AND organism:"Methanospirillum hungatei JF-1 (strain ATCC 27890 / DSM 864 / NBRC 100397 / JF-1) [323259]" AND proteome:up000001941 | 3 | Записи о шаперонах M. hungatei |
Исследование протеома T. litoralis
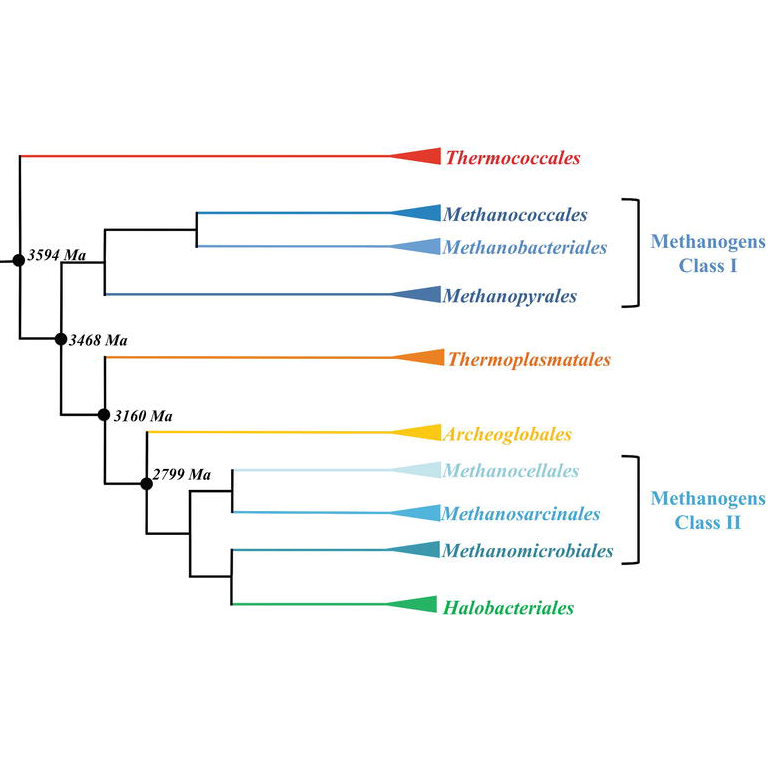
Для изучения особенностей T. litoralis, связанных с её гипертермофильностью, проведено сравнение её протеома с референсным протеомом мезофильной, но в то же время похожей на T. litoralis археи. Для сравнения был выбран протеом Methanospirillum hungatei; эта архея (Рис. 4) тоже облигатно анаэробна и способна к хемоавтотрофному образу жизни, вместе с T. litoralis входит в тип Euryarchaeota (Рис. 5), но при этом растёт при относительно низких температурах [7]. Предполагается, что при таком выборе количество глобальных отличий протеомов, не связанных с гипертермофильностью T. litoralis, будет наименьшим, и можно будет определить все белки, отвечающие за устойчивость T. litoralis к высоким температурам.
Протеомы сравнивались по долям белков из трёх групп: трансмембранных, ДНК-связывающих и шаперонов (Табл. 3, 4). Значительное различие было обнаружено только для ДНК-связывающих белков: их доля в протеоме T. litoralis оказалась в 1.88 раз больше, чем в протеоме M. hungatei. В то время как схожесть доль трансмембранных белков неудивительна, одинаковое количество шаперонов у обоих архей противоречит ожиданиям: предполагалось, что их роль у гипертермофильной археи более значима. Результат исследования означает, что у T. litoralis устойчивость к высоким температурам достигается в основном за счёт стабилизации структуры ДНК за счёт дополнительных белков. В таком случае фолдинг белков при столь высоких температурах может поддерживаться только за счёт изменений в последовательности шаперонов или сразу всех белков археи. Однако вероятнее всего, что шапероны у T. litoralis слабо изучены и лишь малая их доля отмечена в протеоме.
| Организм | Thermococcus litoralis | Methanospirillum hungatei JF-1 |
| Proteome ID | UP000015502 | UP000001941 |
| Количество белков | 2506 | 3087 |
| Количество белков в Swiss-Prot | 18 | 221 |
| Доля трансмембранных белков в протеоме | 0.2071 | 0.1772 |
| Доля ДНК-связывающих белков в протеоме | 0.0267 | 0.0142 |
| Доля шаперонов в протеоме | 0.0012 | 0.0010 |
Список литературы
- Lee, S.-J. et al. (2002). TrmB, a sugar-specific transcriptional regulator of the trehalose/maltose ABC transporter from the hyperthermophilic archaeon Thermococcus litoralis. Journal of Biological Chemistry, 278(2), 983–990. DOI: 10.1074/jbc.m210236200.
- Bertoldo, C., & Antranikian, G. (2006). The Order Thermococcales. The Prokaryotes, 69–81. DOI: 110.1007/0-387-30743-5_5.
- Neuner, A., Jannasch, H. W., Belkin, S., & Stetter, K. O. (1990). Thermococcus litoralis sp. nov.: A new species of extremely thermophilic marine archaebacteria. Archives of Microbiology, 153(2), 205–207. DOI: 10.1007/bf00247822.
- Kong, H., Kucera, R.B., Jack, W.E. Characterization of a DNA polymerase from the hyperthermophile archaea Thermococcus litoralis. Vent DNA polymerase, steady state kinetics, thermal stability, processivity, strand displacement, and exonuclease activities. J Biol Chem. 1993;268(3):1965–75. PMID: 8420970.
- Lee, S.-J., Surma, M., Hausner, W., Thomm, M., & Boos, W. (2008). The role of TrmB and TrmB-like transcriptional regulators for sugar transport and metabolism in the hyperthermophilic archaeon Pyrococcus furiosus. Archives of Microbiology, 190(3), 247–256. DOI: 10.1007/s00203-008-0378-2.
- Презентация о UniProt с приведённой динамикой количества записей о белках в TrEMBL и Swiss-Prot.
- Ferry, J. G., & Boone, D. R. (2015). Methanospirillum. Bergey’s Manual of Systematics of Archaea and Bacteria, 1–6. DOI: 10.1002/9781118960608.gbm00511.