Human Protein Atlas
Выбор белка для анализа
Human Protein Atlas – база данных, созданная в 2003 году и содержащая информацию о тканеспецифичной экспрессии генов белков человека, а также их общую аннотацию (достоверность существования гена, его координаты, функции белка, локализация в клетке и т.д.). Чтобы понять, что анализировать, была найдена (в разделе "METABOLIC") функция, объединяющая выданные белки – оказалось, что все они вовлечены в катаболизм жирных кислот (Рис. 1), некоторые участвуют также в окислении других липидов (стероидов, витаминов):
- ACAA1 – Acetyl-CoA acyltransferase 1
- ACOT2 – Acyl-CoA thioesterase 2
- ACOX1 – Acyl-CoA oxidase 1
- ACSBG1 – Acyl-CoA synthetase bubblegum family member 1
- ACSL1 – Acyl-CoA synthetase long chain family member 1
- AMACR – Alpha-methylacyl-CoA racemase
- ECI1 – Enoyl-CoA delta isomerase 1
- EHHADH – Enoyl-CoA hydratase and 3-hydroxyacyl CoA dehydrogenase
- HACL1 – 2-hydroxyacyl-CoA lyase 1
- HADHA – Hydroxyacyl-CoA dehydrogenase trifunctional multienzyme complex subunit alpha
- HSD17B4 – Hydroxysteroid 17-beta dehydrogenase 4
- KRTAP11-1 – Keratin associated protein 11-1
- MEIKIN – Meiotic kinetochore factor
- MYO5B – Myosin VB
- PHYH – Phytanoyl-CoA 2-hydroxylase
- SLC27A2 – Solute carrier family 27 member 2
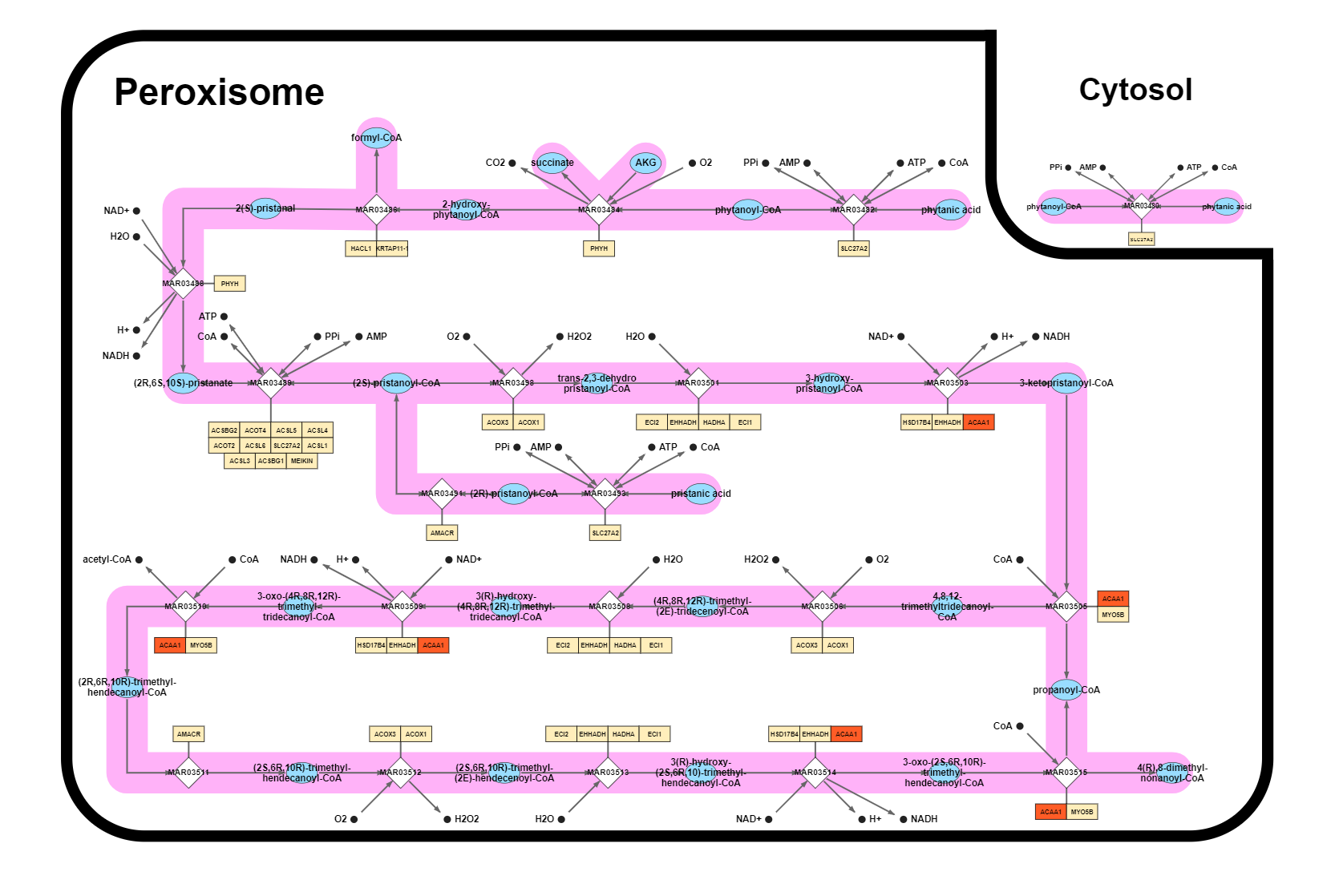
Рисунок 1. Пример метаболического пути с участием выданных белков (взято из раздела атласа "METABOLIC") – β-окисление фитановой кислоты – в нём участвуют все белки из списка и только они.
Исходя из полученной информации и возможностей атласа было решено рассмотреть один из ферментов наиболее простого метаболического пути – β-окисления насыщенных жирных кислот с чётным числом атомов углерода (эти же ферменты вовлечены в наибольшее число метаболических путей, так как катаболизм более сложных ж.к. сводится к тем же реакциям). Эти ферменты наиболее исследованы из всех, по ним ожидалось найти наиболее полную информацию.
Тканеспецифичность
В качестве такого фермента была выбрана ACAA1 – тиолаза. Она не имеет гомологов в предложенном списке, но в атласе есть один её гомолог – ACAA2. Изоформа ACAA1 активна в пероксисомах, а ACAA2 – в митохондриях (Рис. 2).
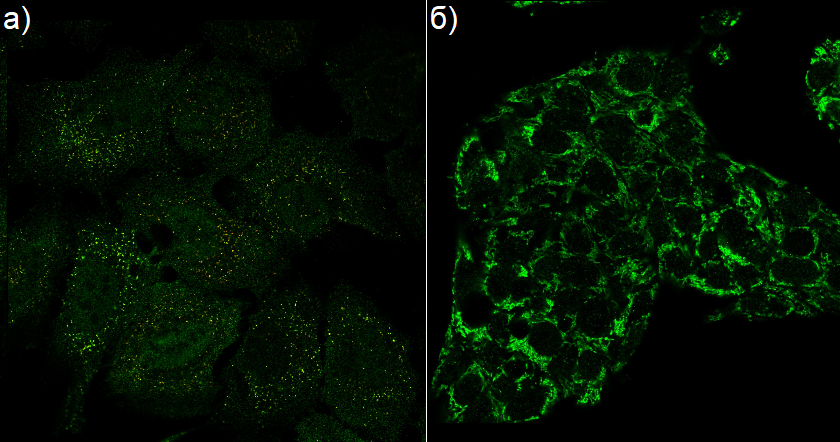
Рисунок 2. Доказательства локализации а) белкового продукта гена ACAA1 в пероксисомах (красный сигнал от пероксисом и зелёный от ACAA1, меченных антителами с флуоресцентной меткой, накладываются друг на друга, в результате видны жёлтые точки) и б) белкового продукта ACAA2 в митохондриях (зелёный сигнал от ACAA2 совпадает с локализацией митохондрий). Изображения добыты в разделе атласа "SUBCELLULAR".
Несмотря на то, что соотношения экспрессий их мРНК (Рис. 3, б, г) в разных тканях примерно равны (больше всего экспрессируются в печени и в почках, абсолютный уровень экспрессии больше для ACAA2), для белковой экспрессии (Рис. 3, а, в) есть органы, в которых она существенно различается у двух изоформ: ACAA1 активно экспрессируется в головном мозге, а в желудочно-кишечном тракте – слабо. Для ACAA2 верно обратное. Также видно больше различий в конкретных тканях по сравнению с экспрессией мРНК. Из этого можно сделать вывод, что выбор в пользу экспрессии конкретной изоформы осуществляется на уровне трансляции. На данном примере видно, что данные RNA-seq отражают тканеспецифичность белка достаточно неточно.
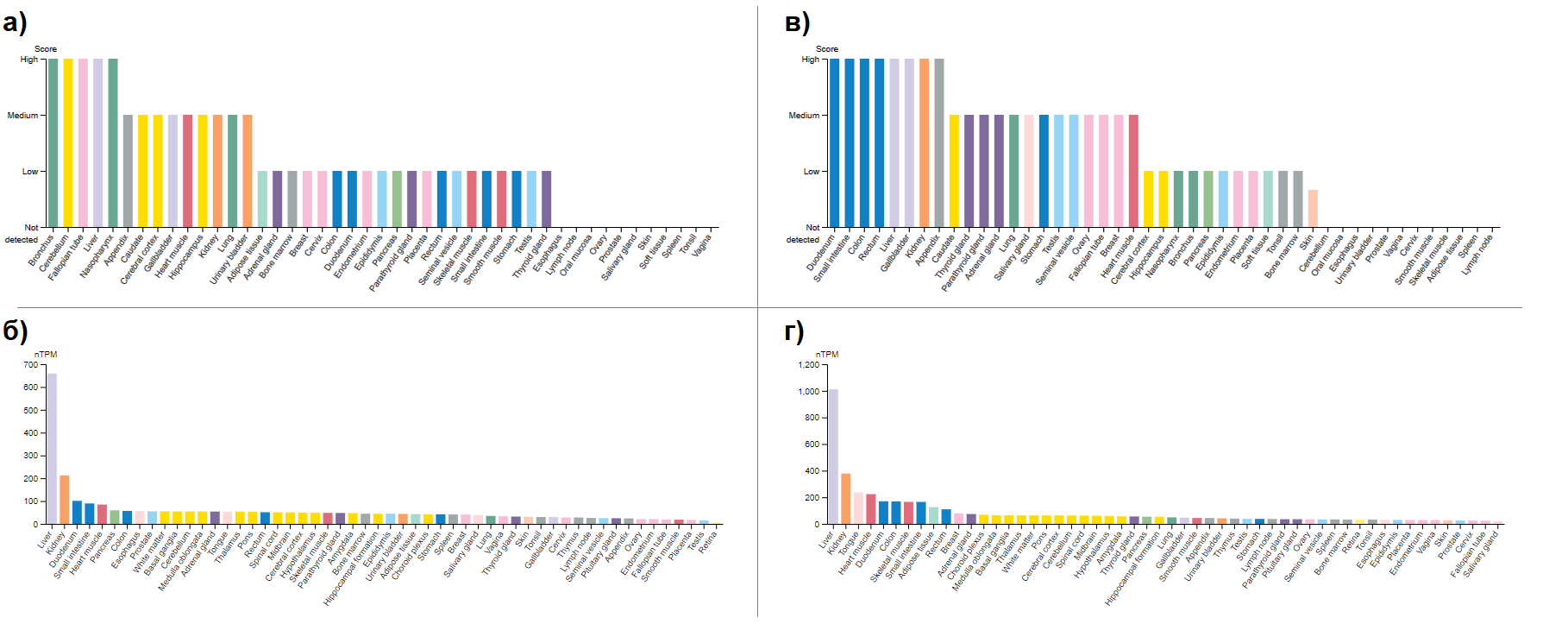
Рисунок 3. Экспрессия а) белкового продукта ACAA1; б) мРНК ACAA1; в) белкового продукта ACAA2; г) мРНК ACAA2.
Особые функции ACAA1 в головном мозге
Стоит отметить, что существование отдельной изоформы тиолазы в головном мозге было ожидаемо – нейроны не используют жиры в качестве источника энергии, β-окисление может им понадобиться для синтеза мембранных и сигнальных липидов (в данном случае неэнергоэффективное окисление в пероксисомах). Это косвенно подтверждается полным списком функций ферментов в разделе "METABOLIC" (Рис. 4) – ACAA1 вовлечён в большее число реакций, что свидетельствует скорее в пользу синтетической активности, чем энергетической функции, в частности, больше реакций в метаболизме лейкотриенов, играющем важную роль в пролиферации в том числе нейронов [1].
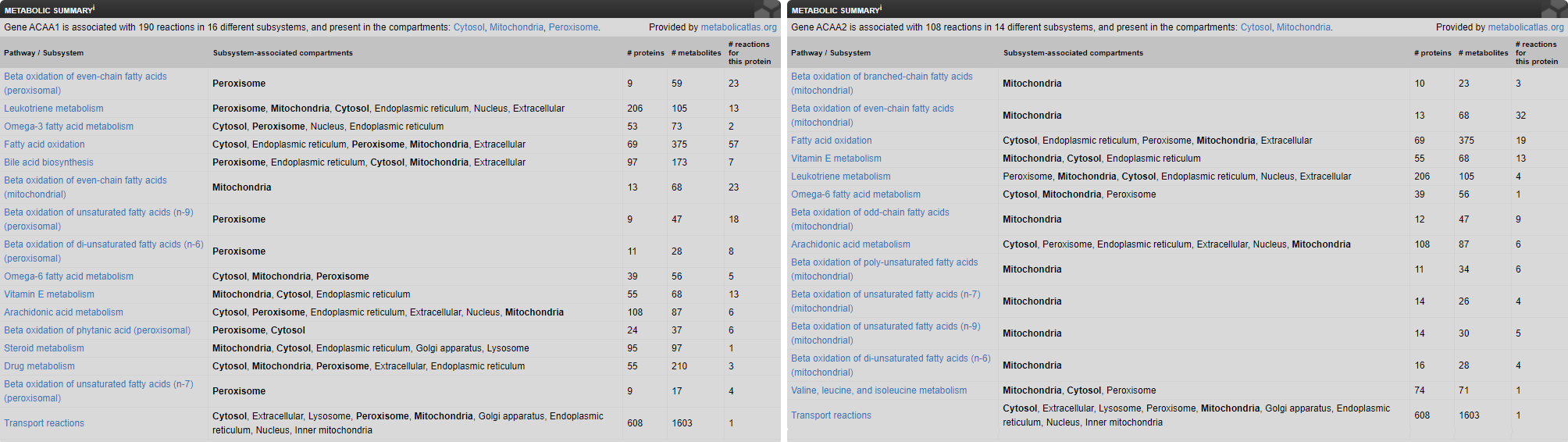
Рисунок 4. Метаболические пути, в которых задействованы ACAA1 и ACAA2.
Подтверждение (косвенное, т.к. рассматривается экспрессия мРНК, а не белка) факта об экспрессии ACAA1 именно в нейронах, а не только в глиальных клетках, установлен с помощью раздела атласа "SINGLE CELL" (Рис. 5) – у ACAA1 на нейроны приходится бОльшая доля экспрессии, чем у ACAA2.
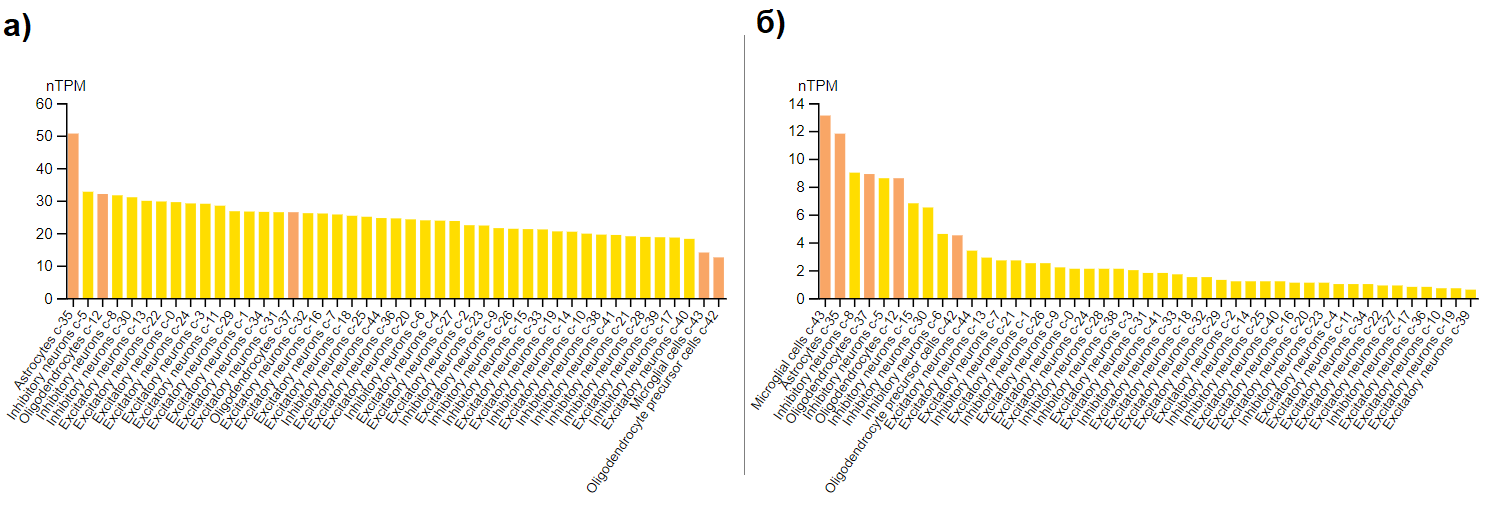
Рисунок 5. Экспрессия в головном мозге мРНК а) ACAA1 и б) ACAA2. Жёлтым цветом обозначены нейроны, оранжевым - глия.
Связанные патологии
Различие в экспрессии двух изоформ также иллюстрирует повышенный риск смерти больных раком головы и шеи при пониженной экспрессии ACAA1 (Рис. 6, график получен в разделе атласа "Pathology"). Для ACAA2 такой связи не наблюдается.
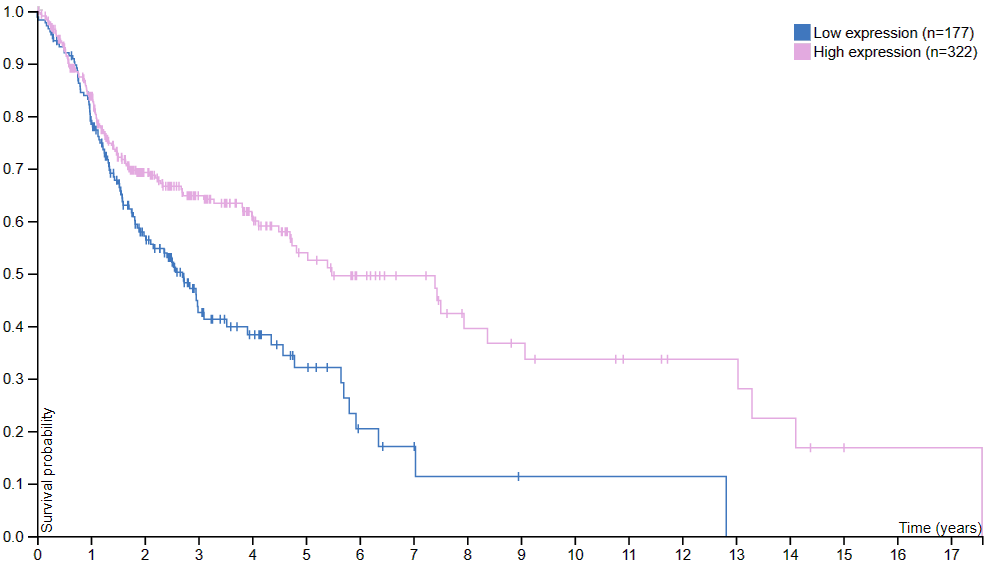
Рисунок 6. Вероятность смерти после постановки диагоза рака головы и шеи (Time – время, прошедшее после постановки диагоза).
Список литературы
- Falomir-Lockhart, Lisandro Jorge; Cavazzutti, Gian Franco; Giménez, Ezequiel; Toscani, Andrés Martín (2019). Fatty Acid Signaling Mechanisms in Neural Cells: Fatty Acid Receptors. Frontiers in Cellular Neuroscience, 13–162. DOI: 10.3389/fncel.2019.00162.