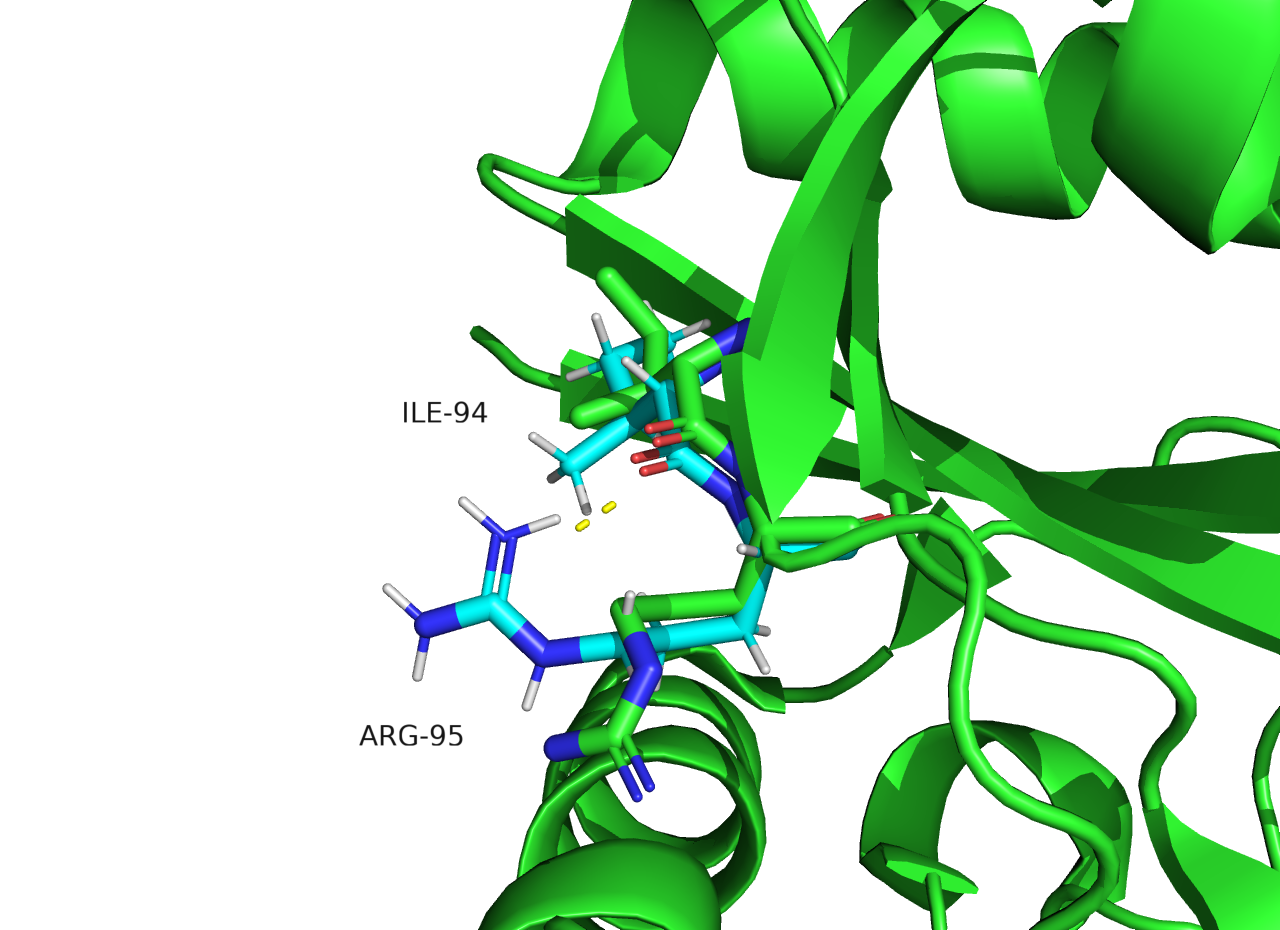
Задание 1. Вводное¶
Необходимо было сравнить структуры YTH домена белка YTHDC2 из человеческого (Homo sapiens) организма. Этот белок взаимодействует с N6-метиладенозином в составе РНК и стабилизирует связанный таким образом транскрипт.
PDB ID PCA структуры: 6K6U
Разрешение PCA структуры: 2.27 Å
PDB ID ЯМР структуры: 6LR2
Число моделей в ансамбле ЯМР структуры: 20
В этом задании мы описывали различия PCA структуры с первой ЯМР моделью.
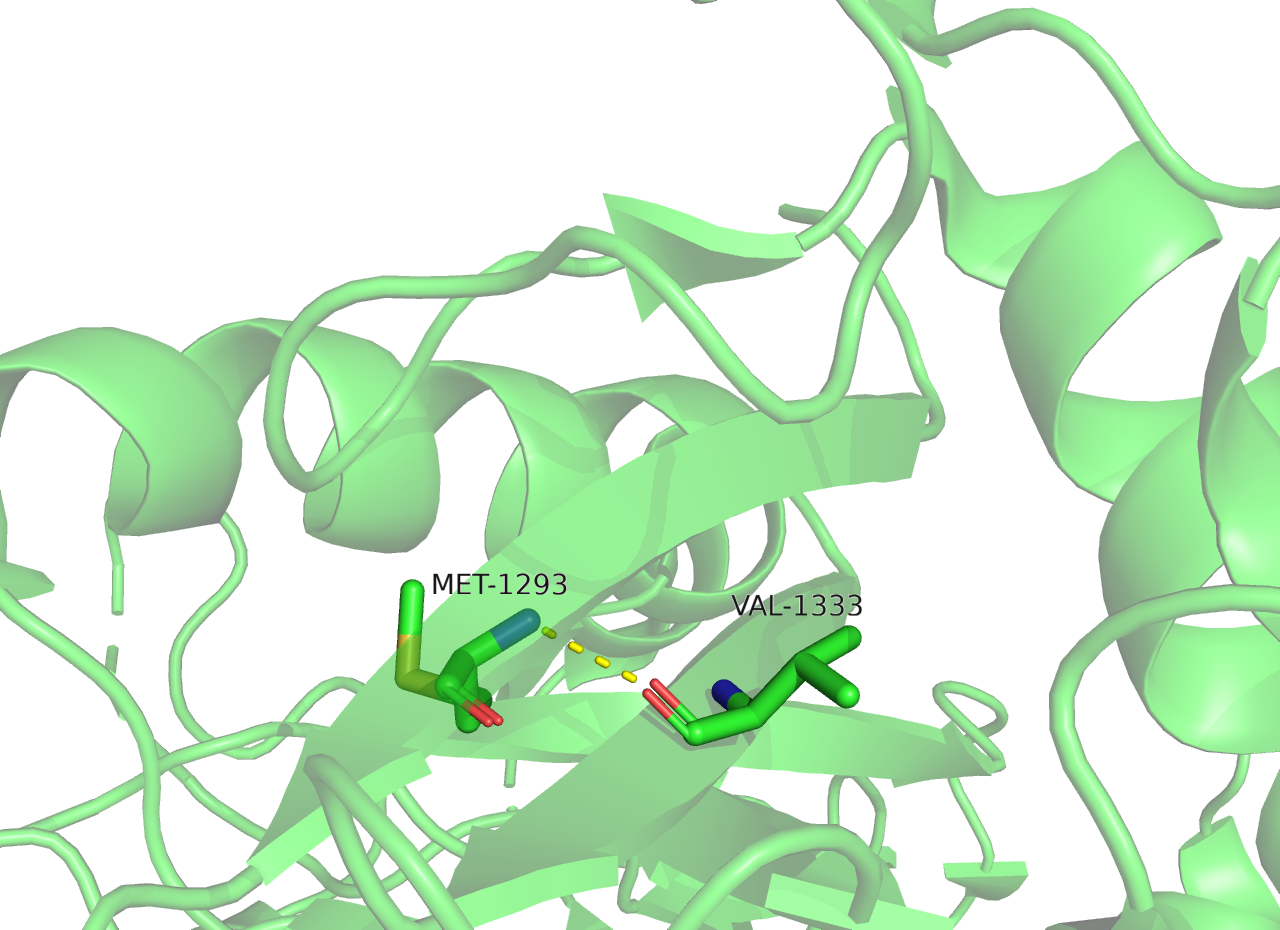
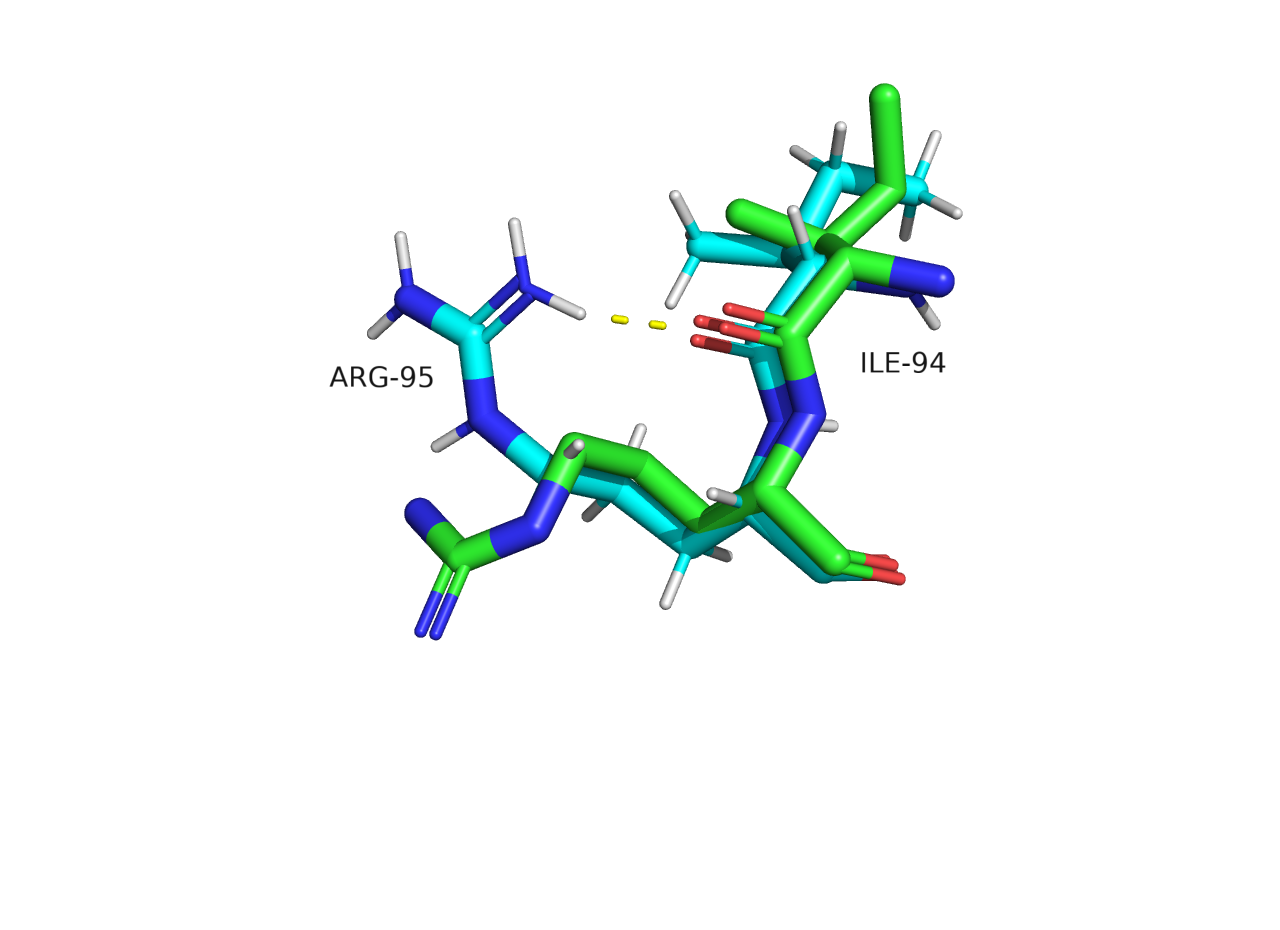
Сравнение этих двух структур показывает, что в двух структурах немного отличается положение атомов. В частности положение линкерных фрагментов сильно отличается (Рисунок 1), как и направление радикалов аминокислот на поверхности белка (Рисунок 2.1).
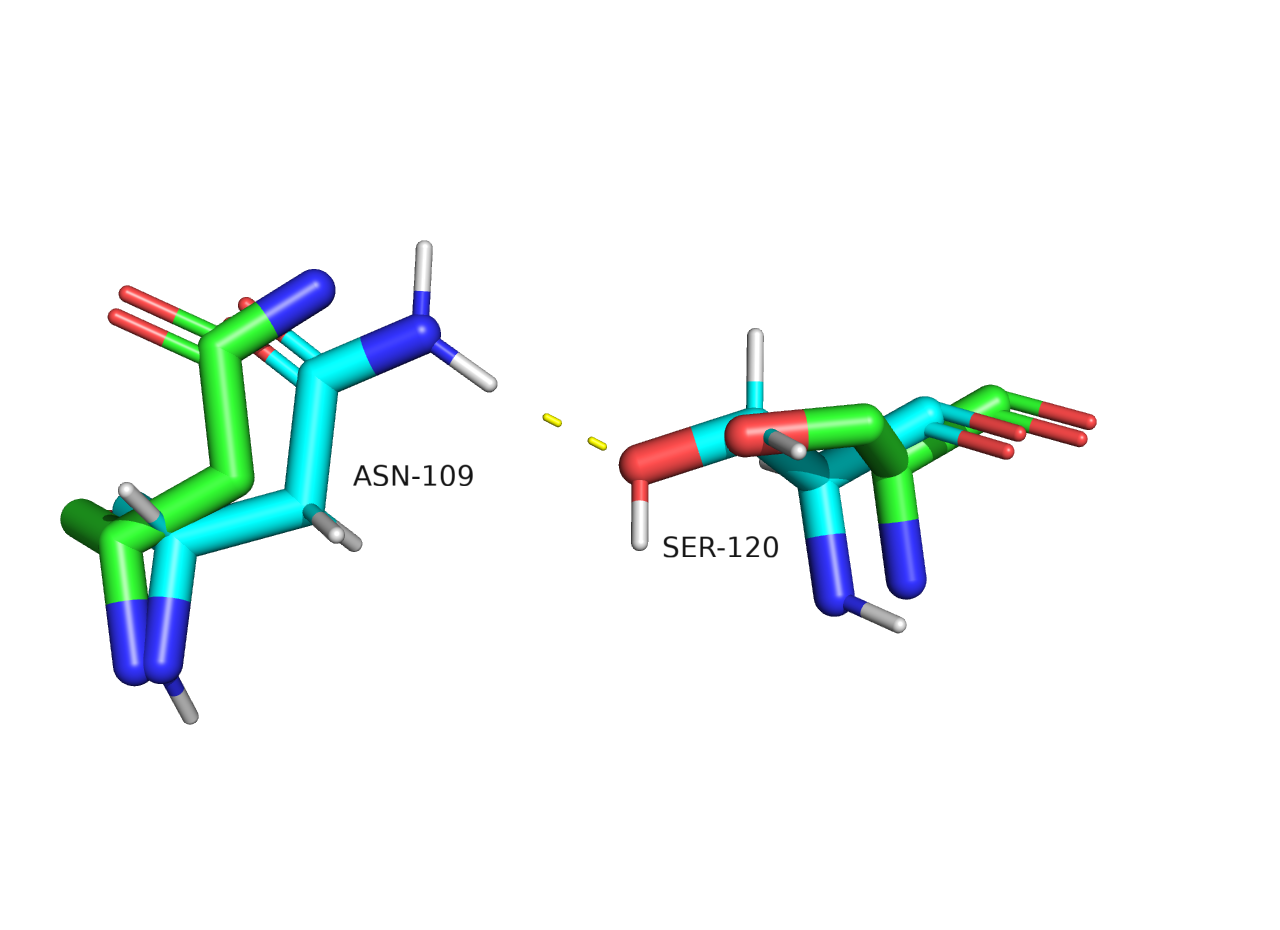
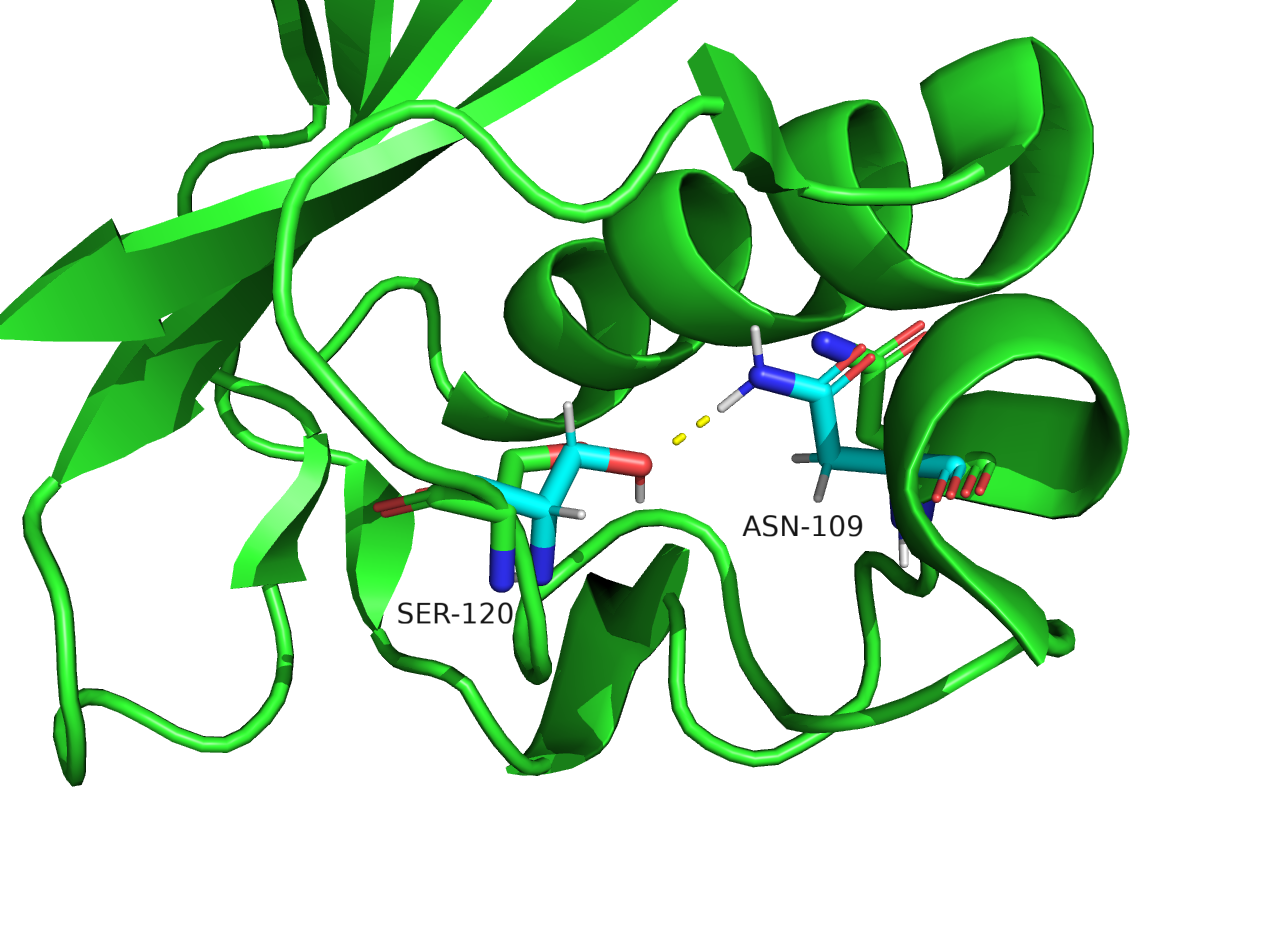
При сравнении расположения атомов водорода в двух структурах становится заметно, что атомы принадлежащие остову белка расположены почти одинаково, с точностью до различий в геометрии самого остова в двух моделях (Рисунок 2.2). Обычно различается положение водородов боковых групп аминокислот. Так, например, на рисунке 2.2 водород гидроксильной группы серина направлен в разные стороны в двух моделях.
Также можно заметить, что ЯМР модель содержит больше аминокислот на N и C концах белка (Рисунок 1).
Кроме того в ЯМР структуре остутсвует вода.
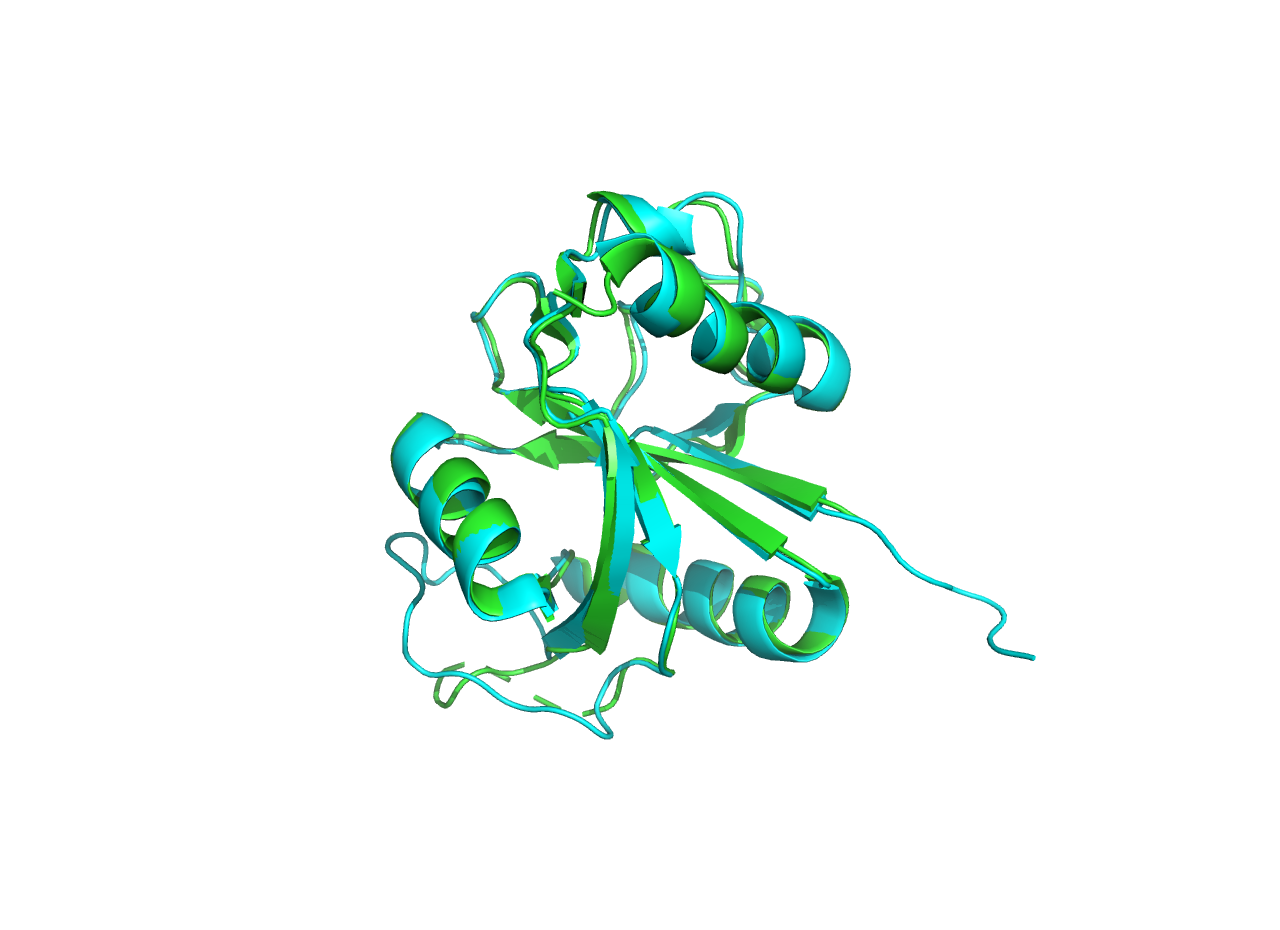
Рисунок 1 Сравнение структур PCA и ЯМР, представление cartoons. PCA изображен зеленым, ЯМР голубым. Представлена 1 модель ЯМР.
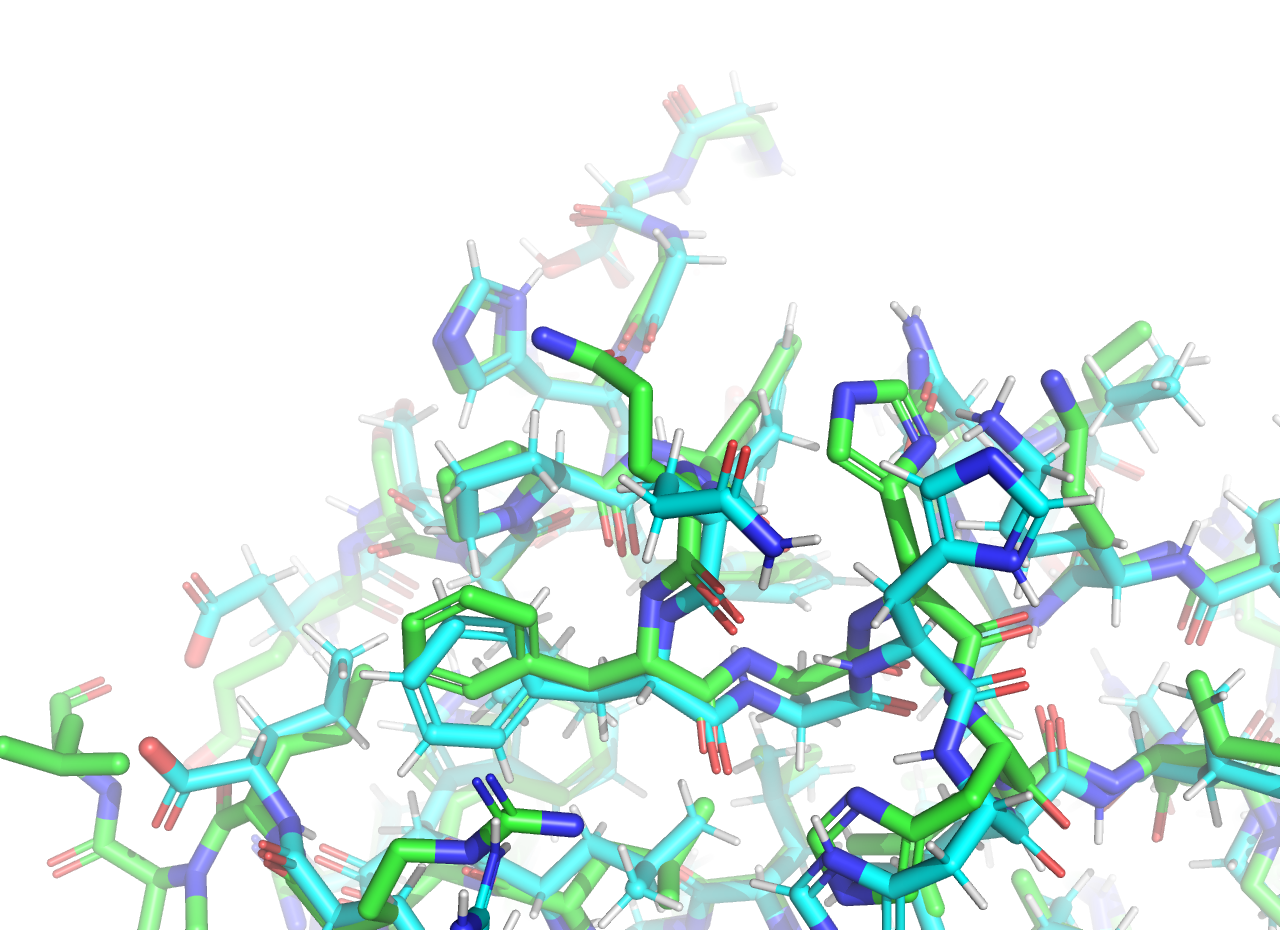
Рисунок 2.1 Сравнение структур PCA и ЯМР, представление sticks. PCA изображен зеленым, ЯМР голубым. Представлена 1 модель ЯМР.
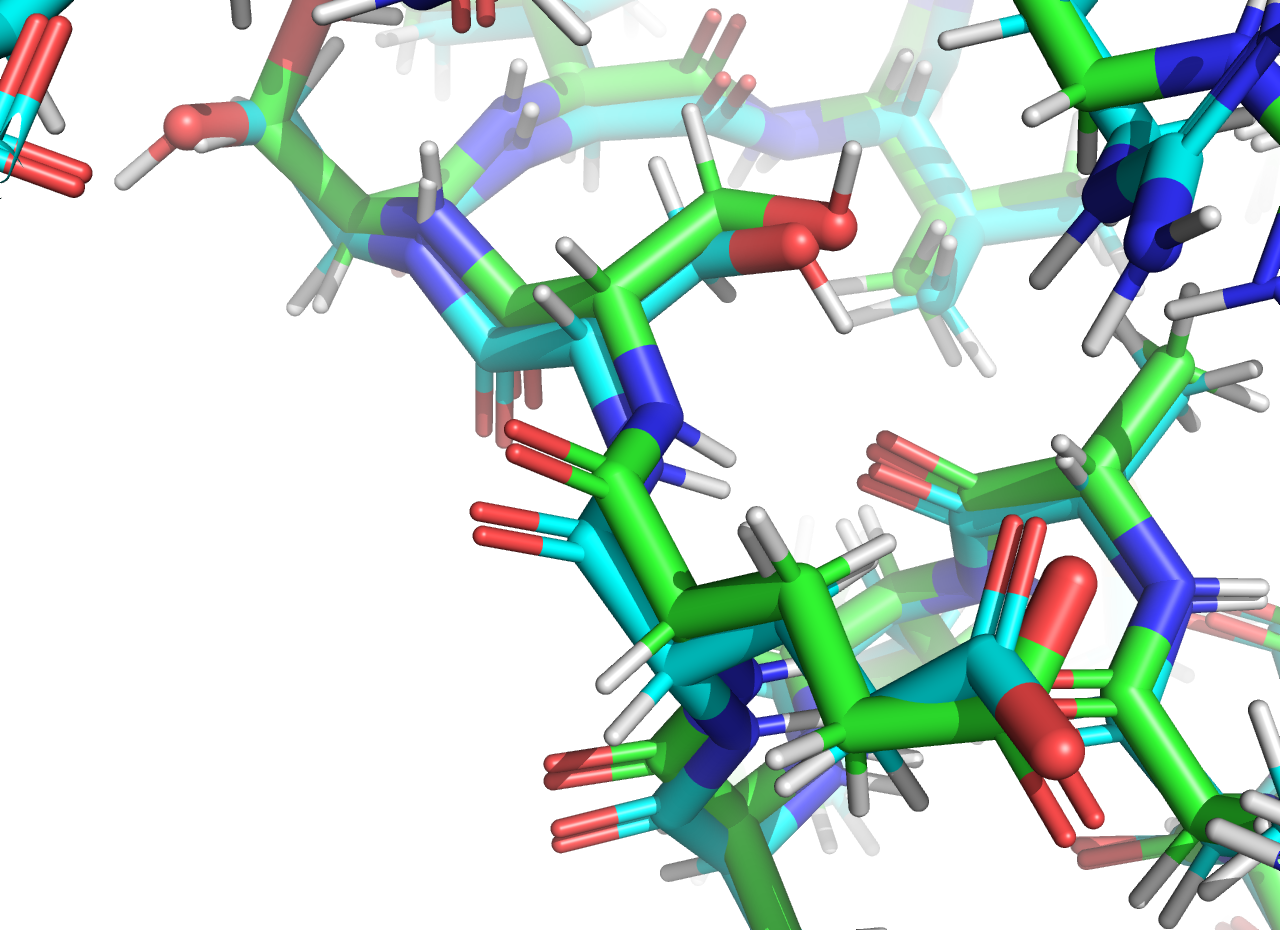
Рисунок 2.2 Сравнение расположения атомов водорода в структурах PCA и ЯМР, представление sticks. Представлена 1 модель ЯМР.