Cтруктура 2-дегидропантоат 2-редуктазы. База PDB. PyMOL.
Объектом моего анализа стал белок кетопантоатредуктаза (альтернативное название 2-дегидропантоат 2-редуктазы), выделенный из бактерии Porphyromonas gingivalis. Данные получены из базы PDB (Protein Data Bank). Ген, кодирующий соответствующий белок называется PANE или PG_2205. Разрешение (расстояние, на котором две соседкие точки можно идентифицировать как отдельные) состовляет 2.15 ангстрем (10⁻¹⁰ м), что достаточно много. Метод изучения структуры: ренгеновская дифракция.
Анализ структуры в целом
Данный объект является белком, а именно ферментом, который относится к классу оксидоредуктаз. Оксидоредуктазы - ферменты, учавствующие в окислительно-восстановительных реакциях. Катализирует НАДФН-зависимое восстановление кетопантоата в пантоиновую кислоту.
Катализируемая реакция: (R)-пантоат + НАДФ + = 2-дегидропантоат + НАДФН + Н +
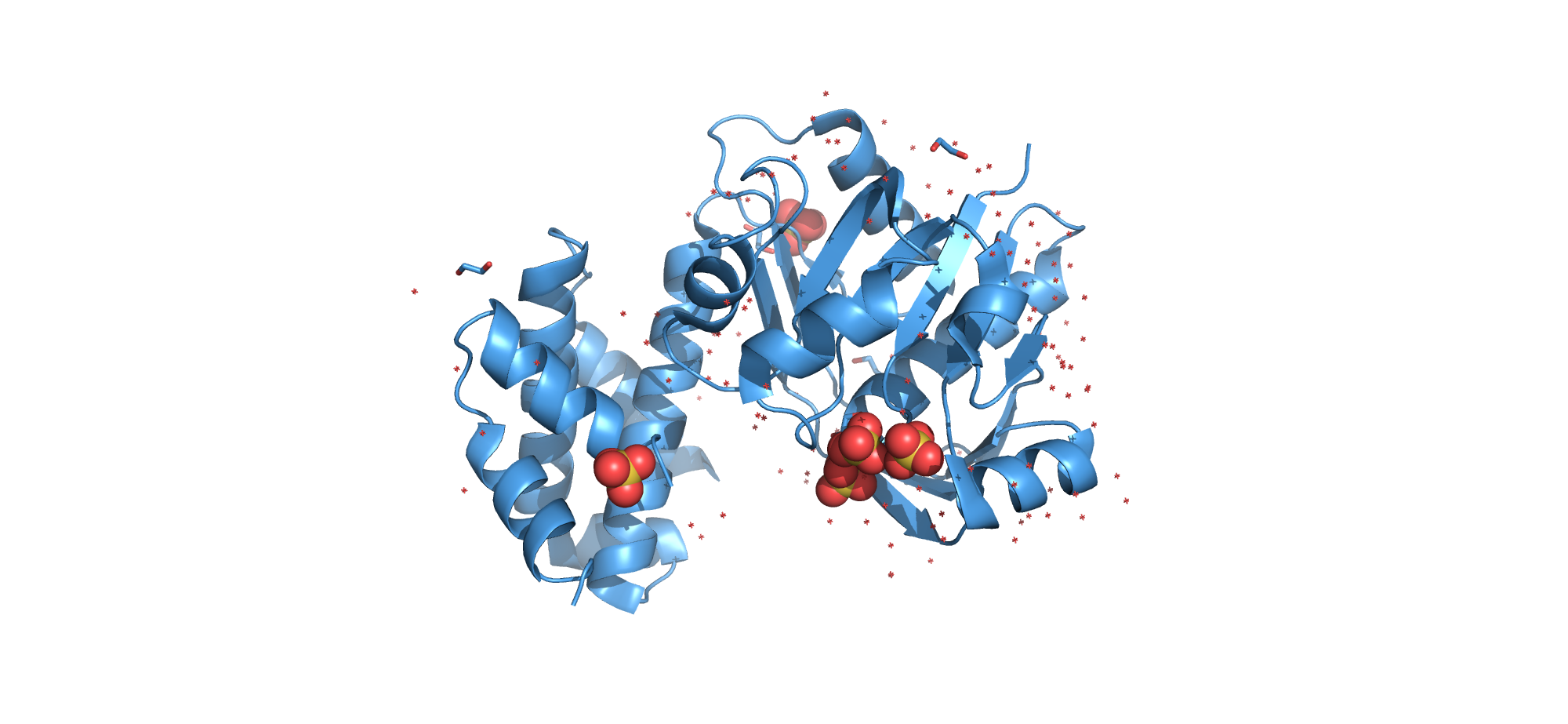
В структуре присутствует 1 полимерная цепь. Обозначена как цепь А (CHAIN: A;)
В молекуле есть одна биологическая единица (BIOMOLECULE: 1), ей является мономер (BIOLOGICAL UNIT: MONOMERIC). Биологическая единица не отличается от асимметрической.
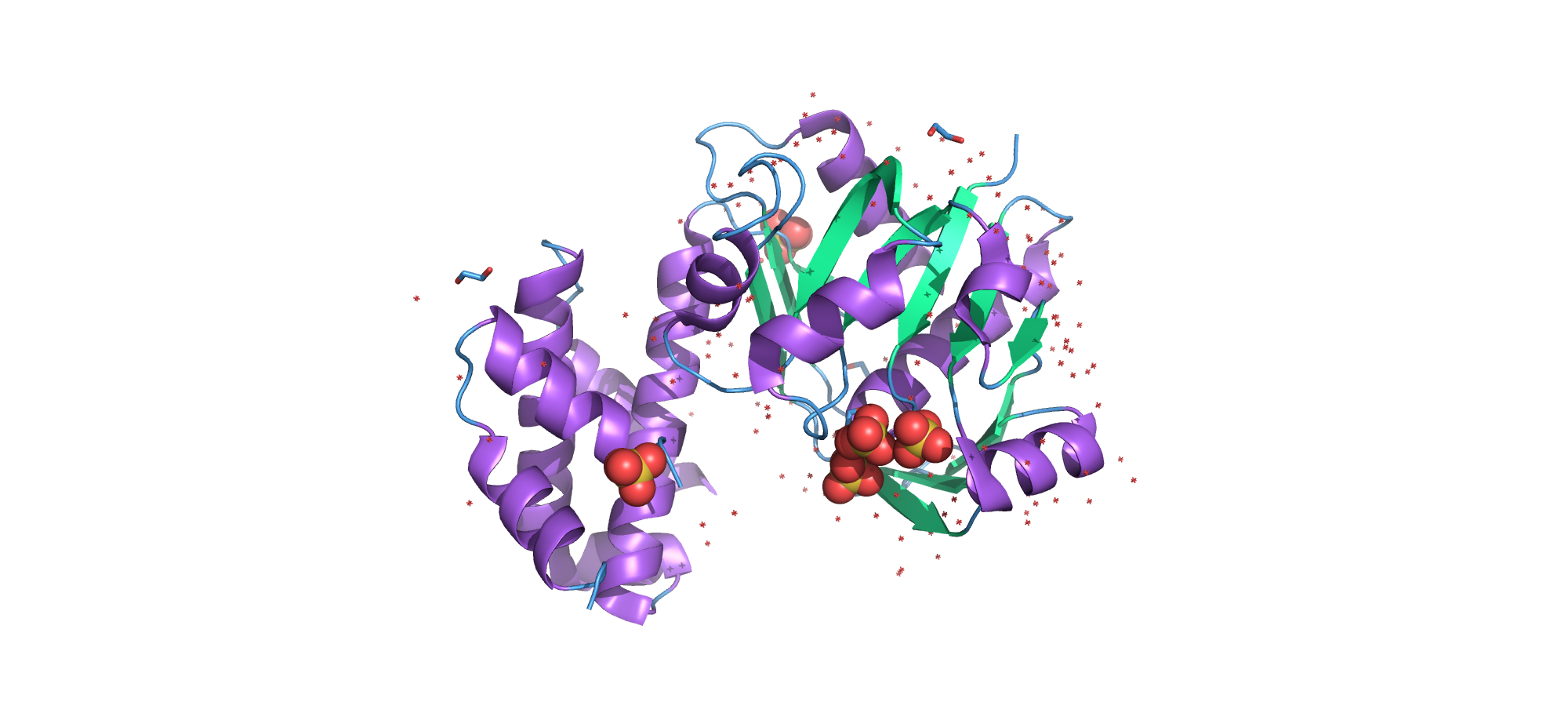
На рис. 2 видно, что во вторичной структуре данного белка преобладают альфа-спирали.
Анализ отдельных цепей
Полипептидная цепь в данной белке только одна.
Данная макромолекула относится к организму: Porphyromonas gingivalis W83
uniprot_id: Q7MT04, название: 2-dehydropantoate 2-reductase
Функция молекулы заключается в катализе НАДФН-зависимого восстановления кетопантоата в пантоиновую кислоту.
В последовательности нет мутаций.
Модифицированные аминокислотные остатки: aa_modification
Анализ малых молекул
Строки из PDB файла, соответствие малым молекулам: small_mol
В записи присутствуют следующие малые молекулы:
Сульфат ион
Краткое наименование: SO4
Полное наименование: SULFATE ION
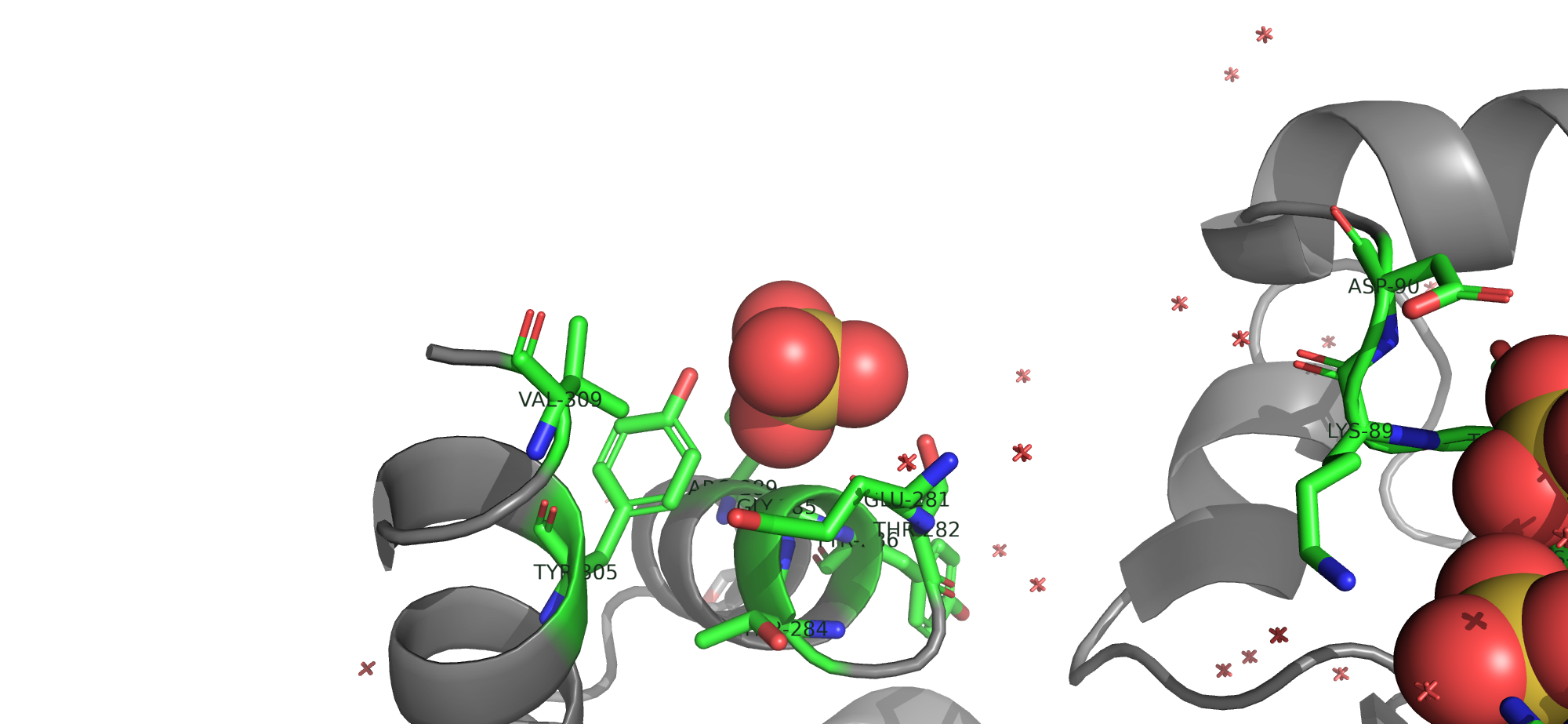
Данный тип малых молекул расположен в активном центре фермента. Об этом свидетельствуют следующие строки:
SITE 2 AC1 9 LYS A 143 SO4 A 318 EDO A 320 HOH A 443
SITE 2 AC2 8 LYS A 143 SO4 A 318 HOH A 365 HOH A 393
SITE 2 AC4 10 THR A 88 ASP A 90 SO4 A 315 SO4 A 316
SITE 2 AC6 8 GLY A 17 CYS A 87 SO4 A 315 SO4 A 318
1,2-ЭТАНДИОЛ
Краткое наименование: EDO
Полное наименование: 1,2-ETHANEDIOL
Данный тип малых молекул расположен в активном центре фермента. Об этом свидетельствуют следующие строки:
SITE 2 AC1 9 LYS A 143 SO4 A 318 EDO A 320 HOH A 443
SITE 3 AC4 10 EDO A 320 HOH A 443
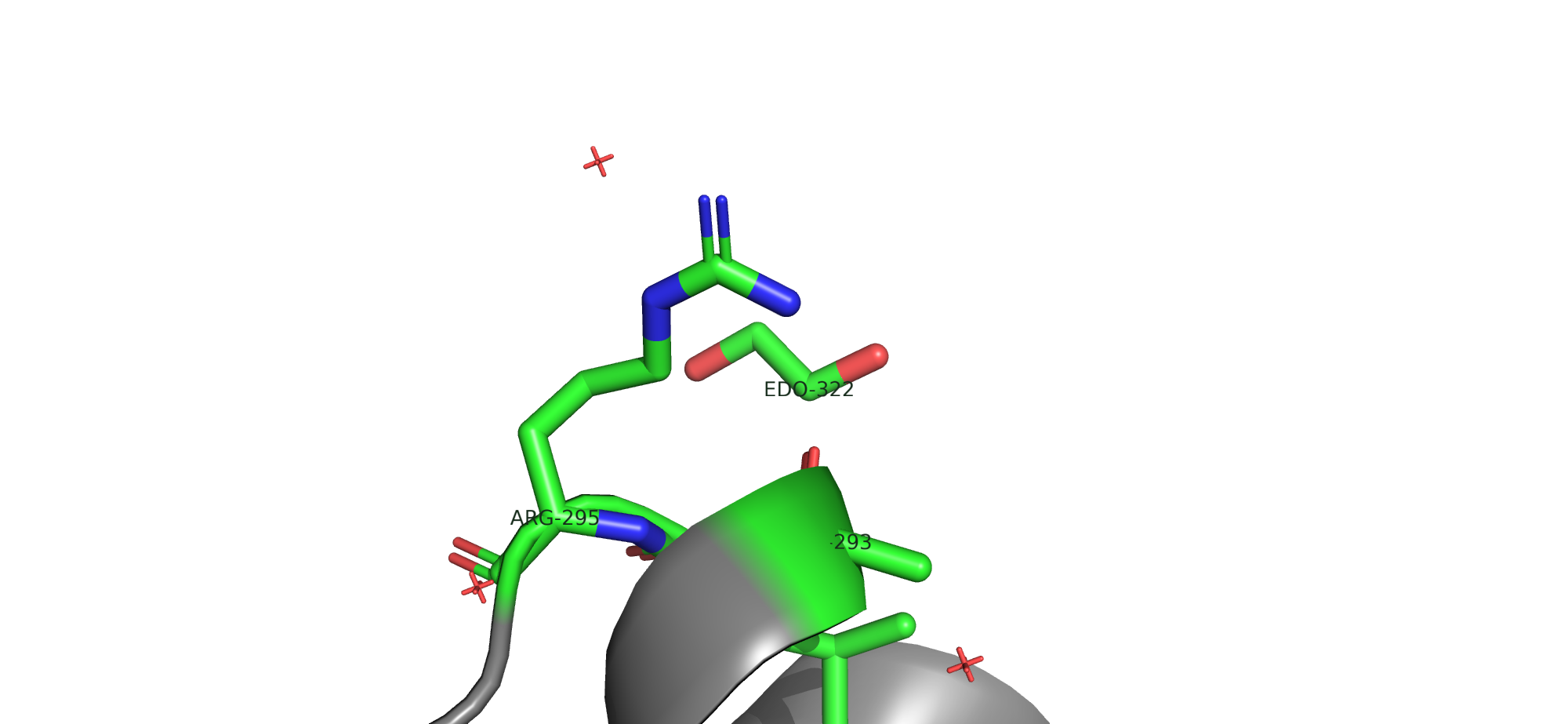
SITE 1 AC5 4 TYR A 186 ASN A 187 EDO A 324 HOH A 459
Селенометионин
Краткое наименование: MSE
Полное наименование: SELENOMETHIONINE
Является модифицированным остатком метионина, выполняющим функцию связывания с L-пептидом (пептидом с L-аминокислотами). Можно предположить, что данная модификация играет роль в выполнении функции фермента, так как важна для формирования нативной конформации белка. В активном центре молекулы его нет.
Активный центр
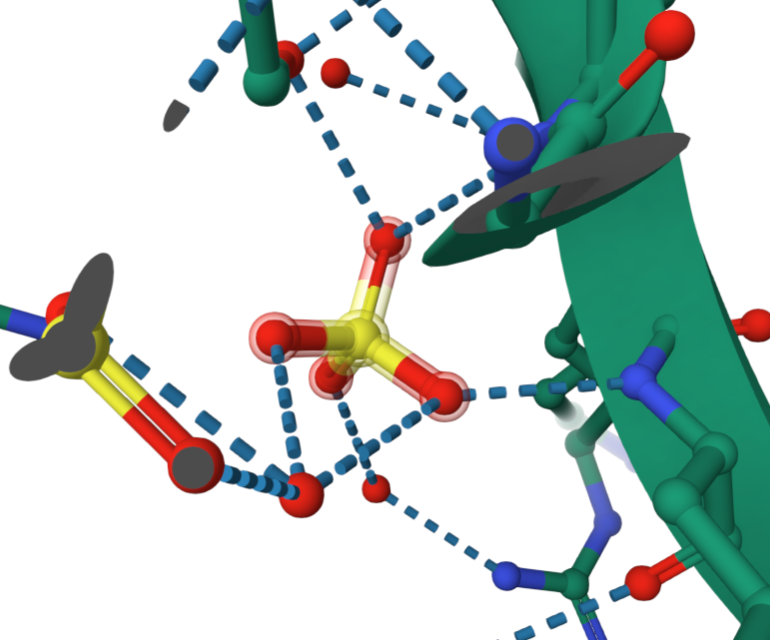
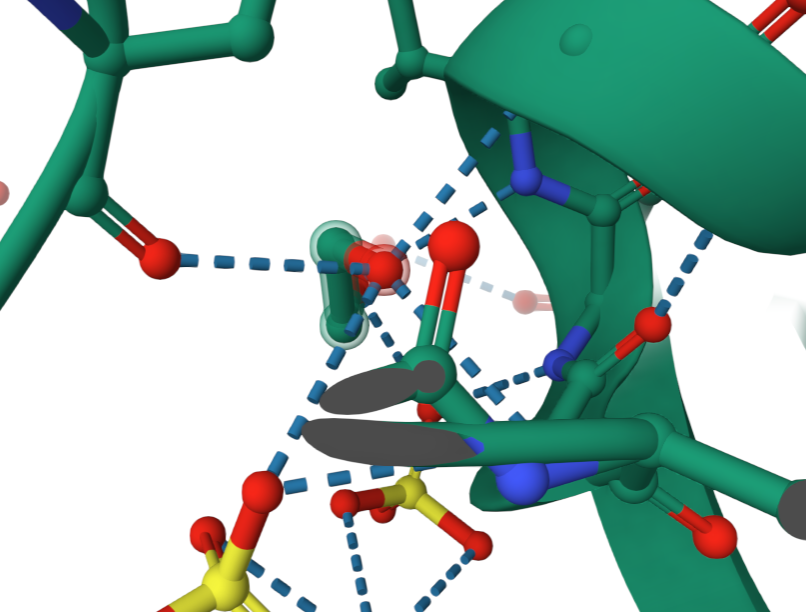
Интересно узнать какие аминокислоты находятся в активном центре фермента. Для этого синим я выделила лиганды, а розовым аминокислоты, которые находятся рядом и скорее всего могут взаимодействовать с ними.
Предположение: аминокислоты, которые выделены розовым находятся в активном центре фермента.
Поскольку статьи, описывающей получение моей структуры нет, с помощью BLAST я нашла бактерии с похожими белками: Methylococcus capsulatus, Levilactobacillus brevis, Geobacter metallireducens GS-15. Но, к сожалению, статей про получение структуры их белков тоже нет, поэтому в ответе на дополнительные задания я буду опираться на свои знания и представления.
Выше я описала более подробно, что сульфат ион и 1,2-этандиол присутствуют в активном центре фермента. Так как активный центр весьма специфичен, можно предположить, что данные малые молекулы напрямую важны для протекания катализируемой реакции. Я думаю, нельзя предположить учавствуют они в реакции или формируют правильную структуру активного центра молекулы для дальнейшего взаимодействия. Селенометионин в активном центре отсутствует. Так как известно, что он учавствует в связывании молекулы с L-пептидом, можно предположить, что данная малая молекула помогает ферменту принять необходимую конформацию, в которой он будет активен.
Катализируемая реакция: (R)-пантоат + НАДФ + = 2-дегидропантоат + НАДФН + Н +
Сульфат ион имеет отрицательный заряд, поэтому он может связываться с положительно заряженными аминокислотами (Lys, Arg, His), тем самым учавствуя в поддержании третичной структуры белка или учавствовать в переносе протона в реакции.
Селенометионин является модификацией метионина (Met), думаю, он может появится в составе белков, если выращивать бактерии на субстрате обогащенном Селеном.
Возможно, данные малые молекулы также неоходимы для получения структуры белка методом ренгеновской дифракции.
Взаимодействия между аминокислотными остатками
Поскольку радикалы аминокислот имеют различное строение и как следствие химические свойства, они часто могут взаимодействовать между собой. Это необходимо для образования вторичной или третичной структуры белка, поддержания его конформации. Водородные связи могут образовываться между атомами, которые входят в состав остова белка.
Водородные связи
Водородные связи - это тип полярных взаимодействий, который обусловлен электростатическим притяжением двух атомов с большой разницей электроотрицательности.
На сильно электроотрицательном атоме (O или N, F в биологических системах встречается реже) формируется частично отрицательный заряд δ-. Так как атом притягивает электроны сильнее, вероятность расположения их около него выше. Такой атом называется акцептором водорода.
На доноре водорода соответственно формируется частично положительный заряд δ+.
В белке водородная связь может формироваться внутри остова, то есть между водородом аминогруппы (N перетягивает на себя электронную плотность) и карбоксильным кислородом (тут кислород перетягивает на себя электронную плотность).
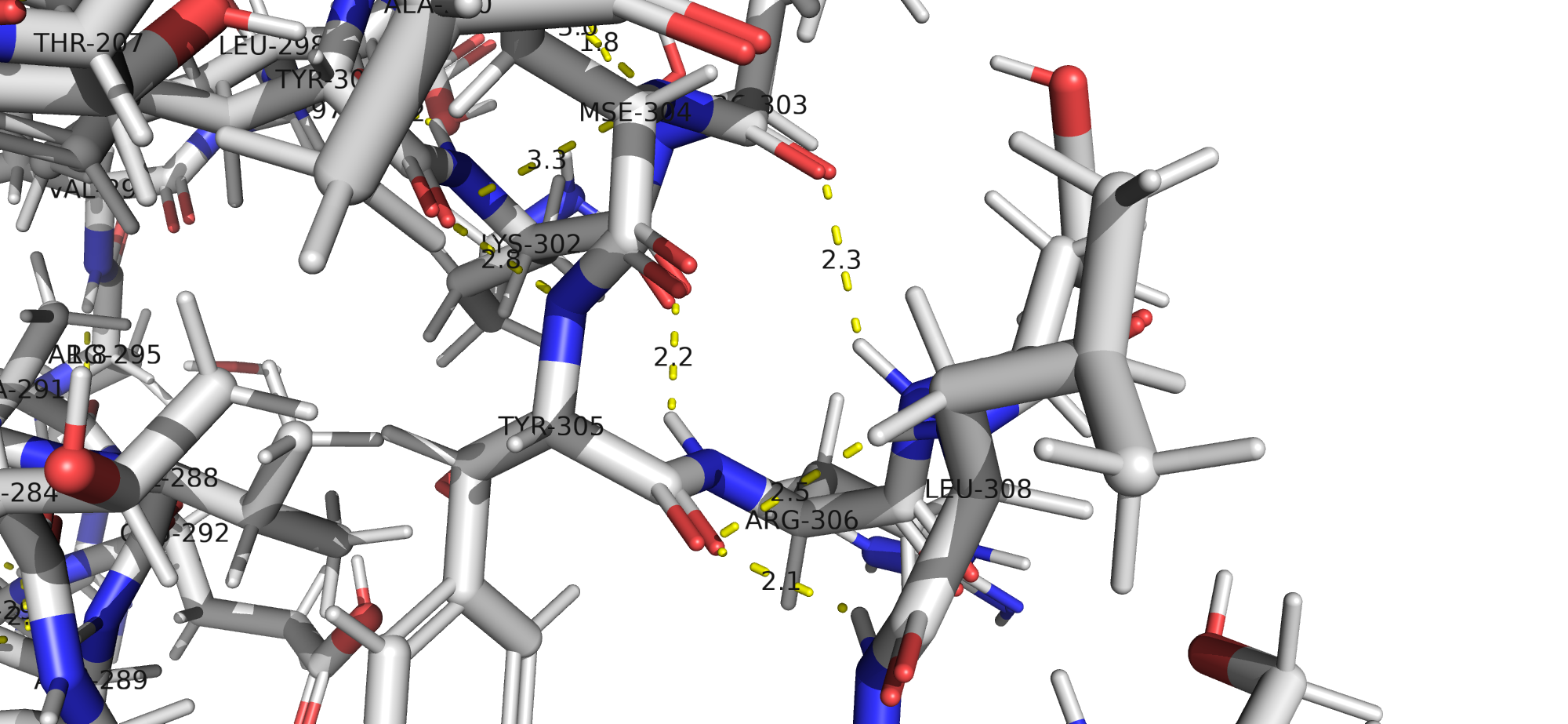
Также в белке могут быть водородные связи, затрагивающая атомы боковых радикалов аминокислот.
На рис. 12 можно увидеть водородные связи между радикалами Тирозина (кислород -ОН) и Аргинина (гуанидиновая группа), а также Аргинина (гуанидиновая группа) и Аспарагиновой кислоты (карбоксильный кислород).
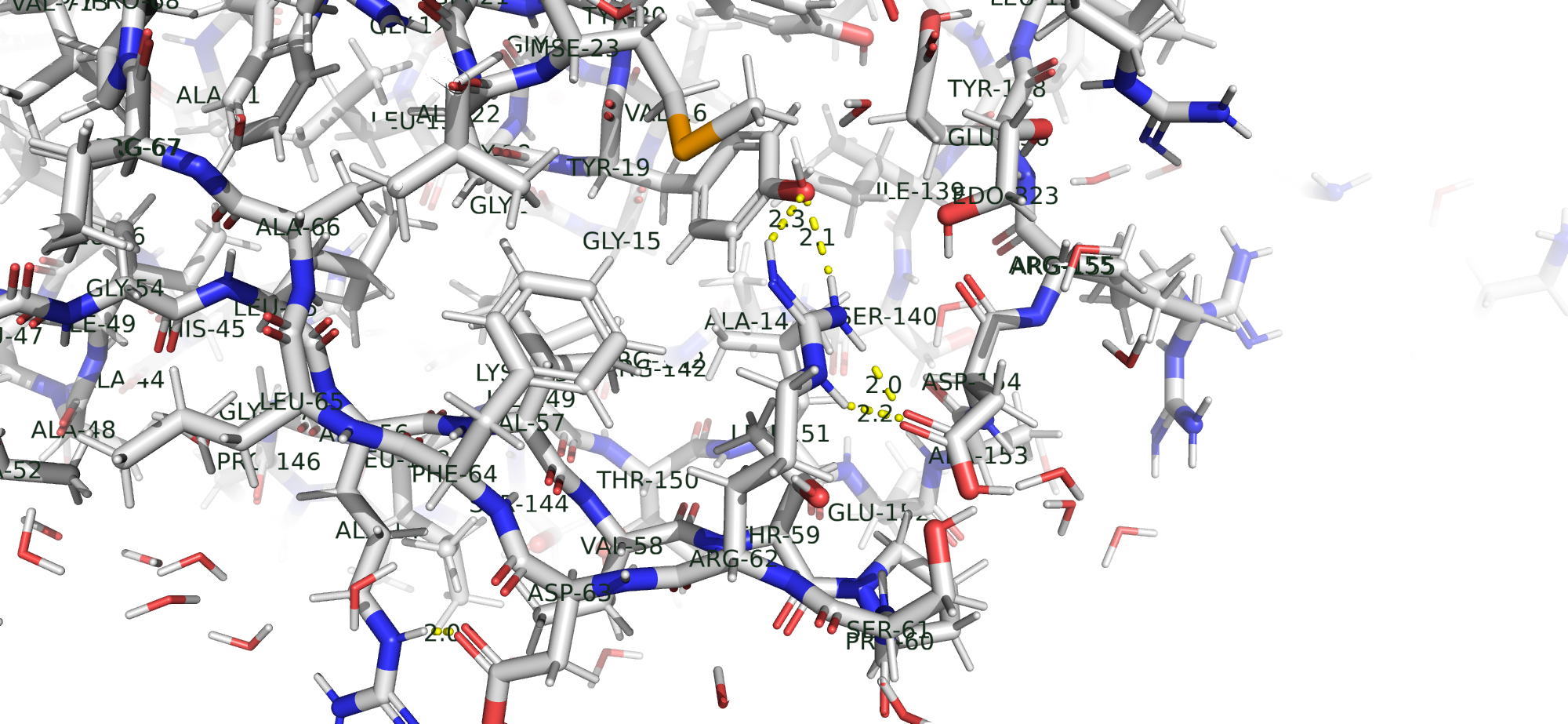
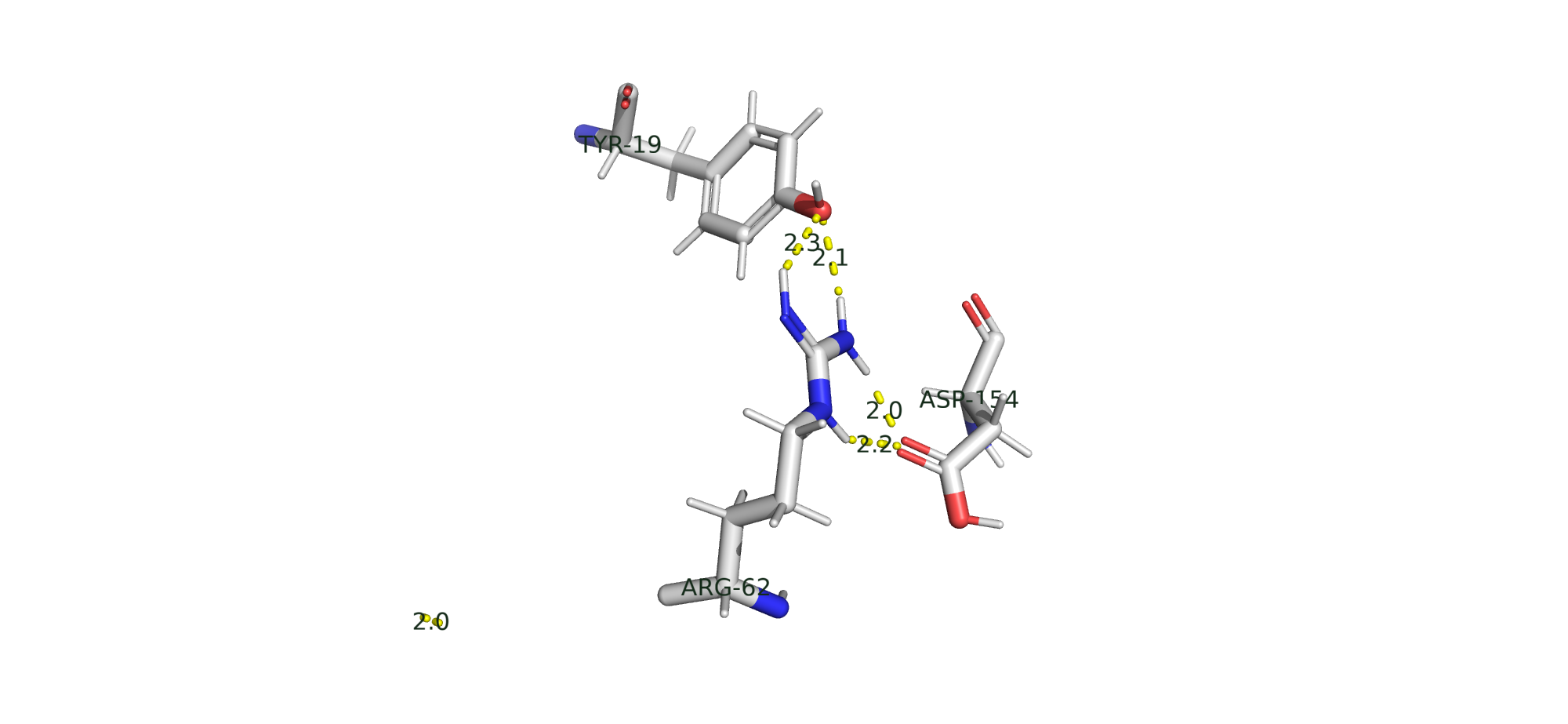
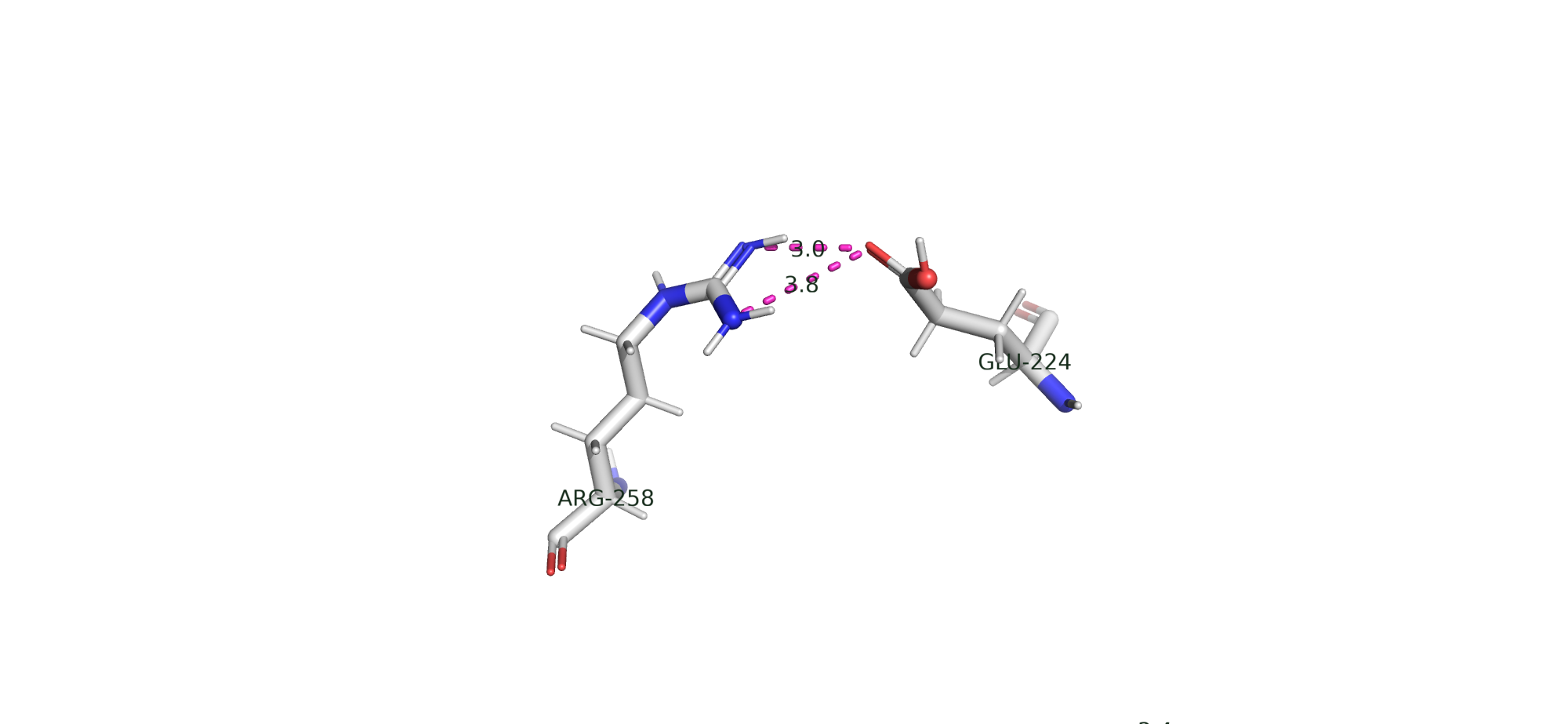
Солевой мостик
Между положительно заряженными аминокислотами (Lys, Arg, His) и отрицательно заряженными аминокислотами (Asp, Glu) могут возникать электростатические взаимодейсия, если они близко расположены в пространстве (до 4.0 Å; до 6 существуют, но менее стабильны). Расстояние важно, так как согласно закону Кулона, оно обратно пропорционально силе ионных (электростатических) взаимодействий.
На рис. 14 видно солевые мостики между радикалами Аргинина и Глутаминовой кислоты.
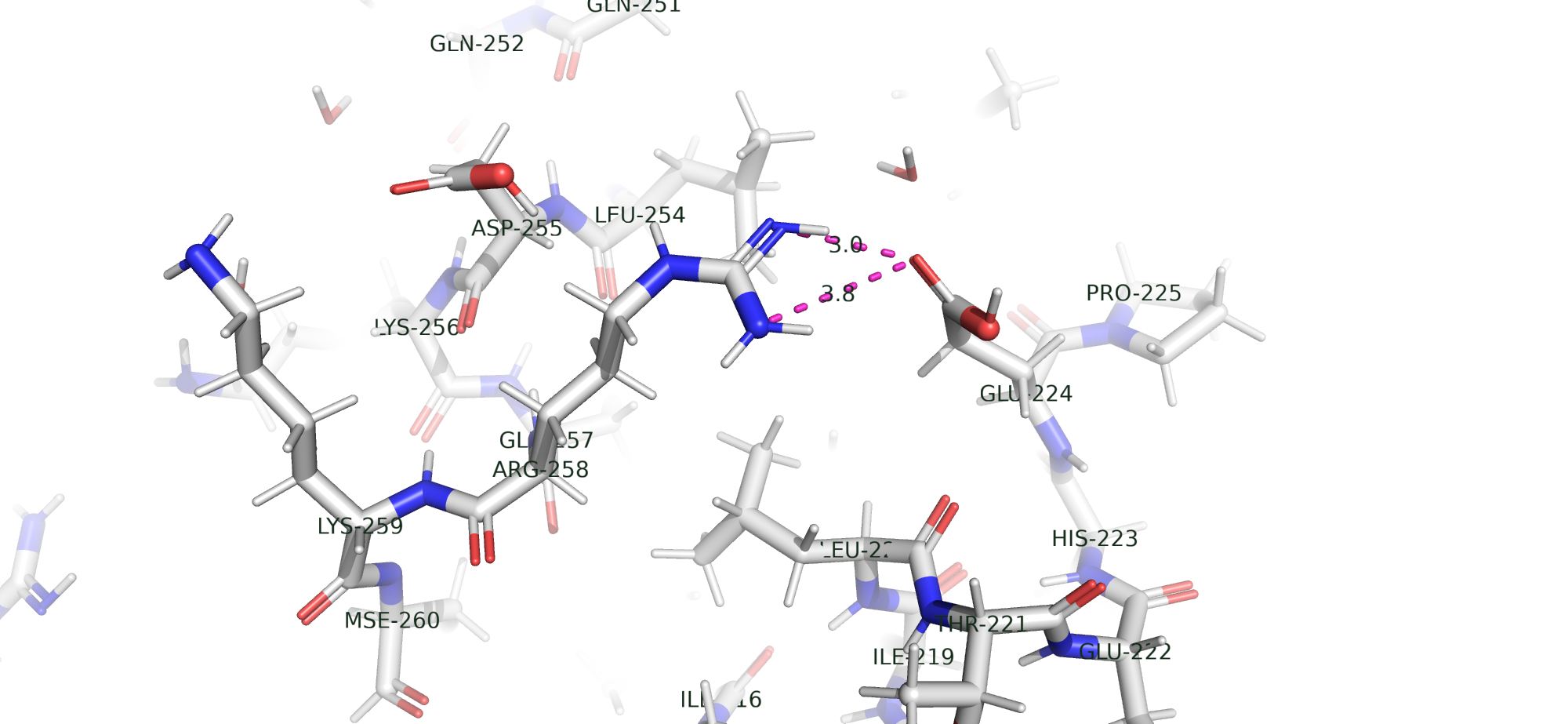
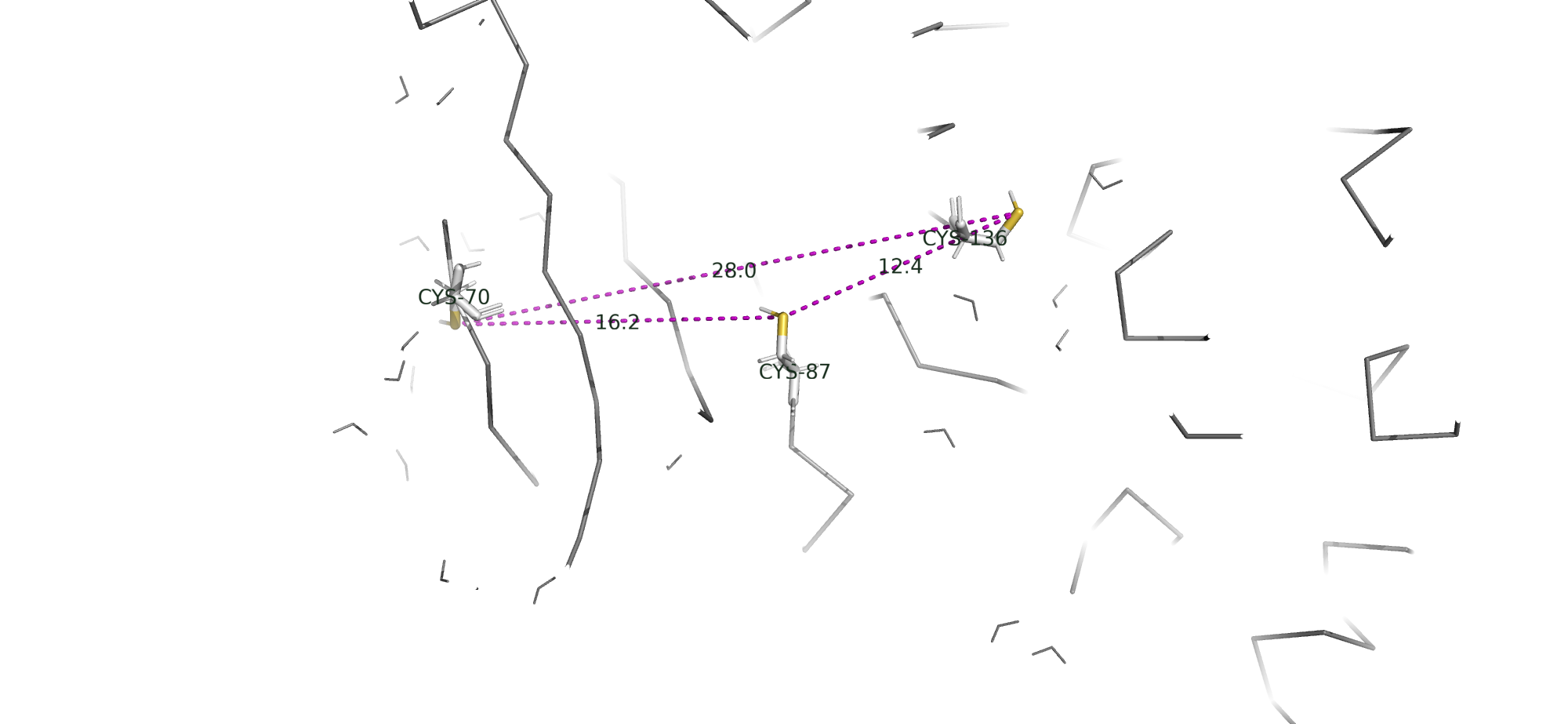
Дисульфидная связь
Дисульфидные мостики - это связи, которые образуются между остатками Цистеина, необходимы для поддержания структуры белка.
В белке отсутствуют дисульфидные мостики, поэтому я продемонстрировала все Цистеины (номера аминокислотных остатков: 70, 87 и 136), а также показала расстояние между ними. Минимальное составило 12,4 Å, что слишком много для образования связи.
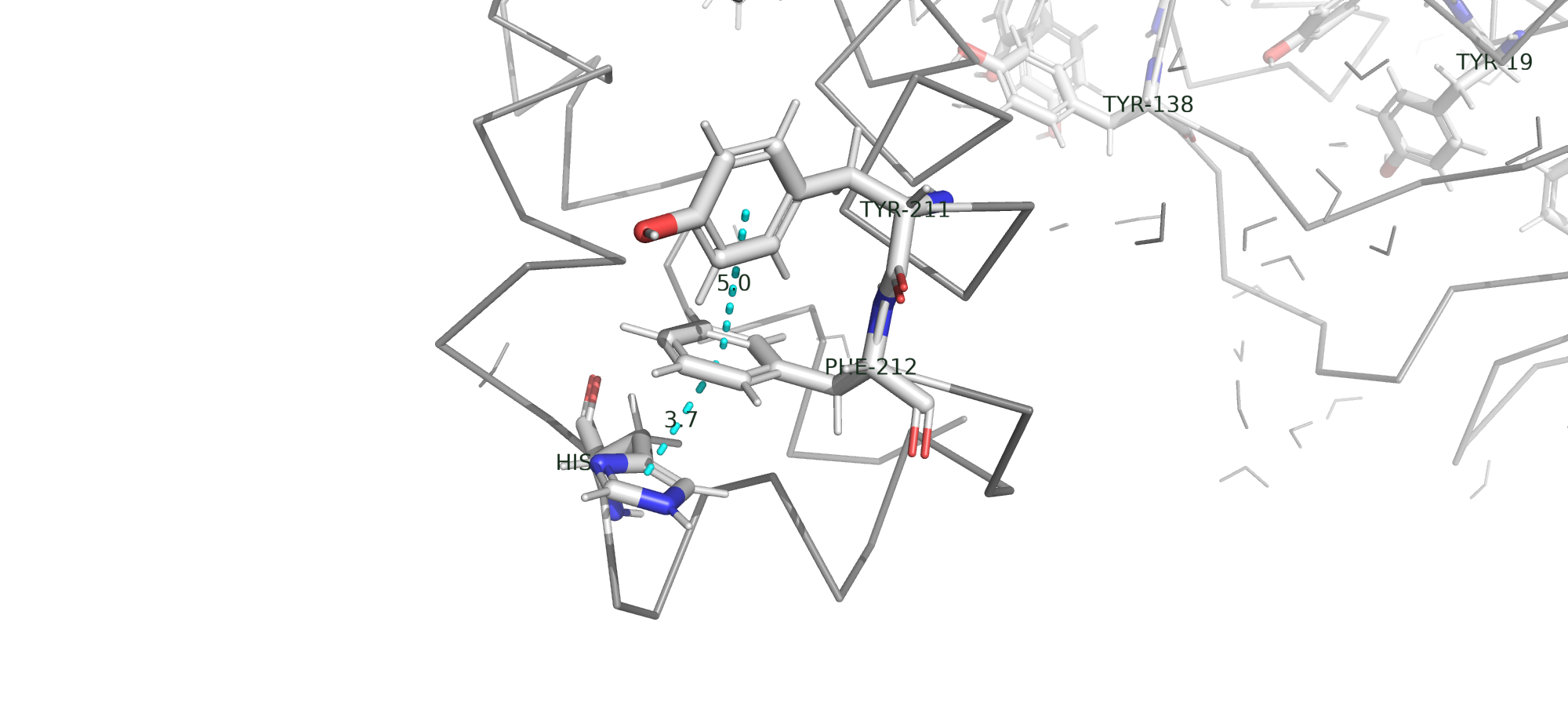
Стекинг
Стекинг - это взаимодействие между остатками ароматических аминокислот (Trp, Phe, Tyr, His), которое происходит в результате перекрывания π-электронных облаков, расположеных перпендикулярно плоскости кольца.
На рисунке представлены параллельно сдвинутый стекинг между Гистидином и Фенилаланином; T-стекинг между Фенилаланином и Тирозином.