Сравнение ЯМР- и РСА-структур одного белка
В данном практикуме необходимо было сравнить 3 водородные связи в ЯМР и РСА структурах выбранного белка. Я выбрала матриксную металлопротеиназу 12, которая способна разрушать белки внеклеточного матрикса и играет важную роль в пролиферации, апоптозе, ремоделировании тканей и т.д. Данный фермент соответствует критерию: ЯМР структура должна иметь не менее 10 моделей (в моем случае - 20). Краткая характеристика фермента и его структур представлена в таблице 1.
Таблица 1. Краткая характеристика фермента и его структур
| Параметр | Значение |
| Название фермента на английском | Matrix metalloproteinase 12 (MMP12) |
| Название фермента на русском | Матриксная металлопротеиназа 12 |
| Тип фермента | Гидролаза |
| PDB-ID (ЯМР) | 1ycm |
| Число моделей ЯМР | 20 |
| PDB-ID (РСА) | 6eox |
| Разрешение структуры (РСА) | 1.3 A |
Сходство укладки ЯМР и РСА структур проверяла с помощью совмещения (рис. 1). Как можно увидеть - структуры неплохо накладываются друг на друга: α-спирали и β-тяжи совмещаются почти идеально, петли совмещаются хуже, возможно, из-за того, что в растворе они более подвижны.
Рис. 1 - Совмещенные структуры 1ycm (зеленые структуры) и 6eox (желтая структура)
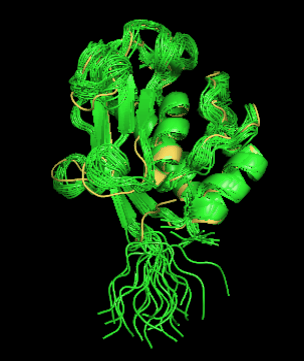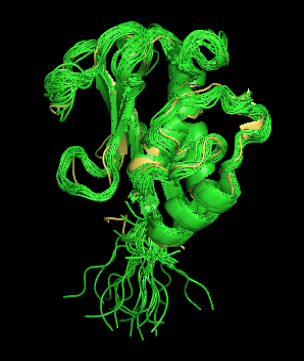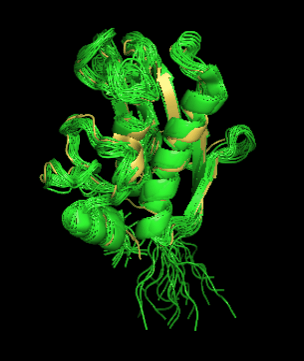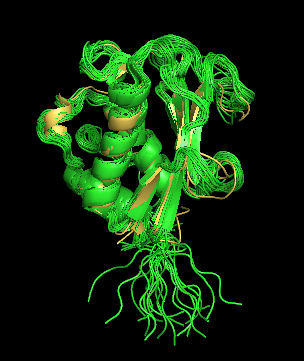 |
Затем выбирала водородные связи для анализа (расстояние между атомами меньше 3.5 A):
(1) остовная связь в ядре белка, α-спирали (Ala216-Ile220) (рис. 2);
(2) водородная связь боковых цепей в ядре белка (Asn211-Thr215) (рис. 3);
(3) водородная связь в петлях (атомы остова петли), выходящих на поверхность глобулы (Ser189-Gly192) (рис. 4).
Рис. 2 - Остовная связь в ядре белка, α-спирали (Ala216-Ile220)
(крупно и на общем фоне глобулы)
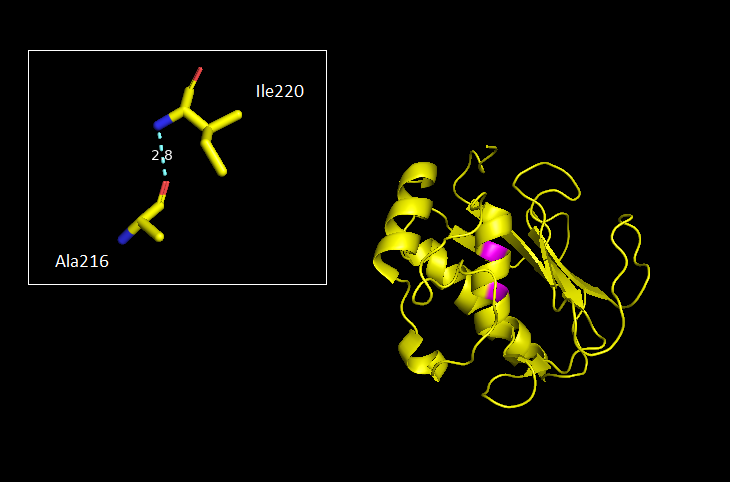 |
Рис. 3 - Водородная связь боковых цепей в ядре белка (Asn211-Thr215)
(крупно и на общем фоне глобулы)
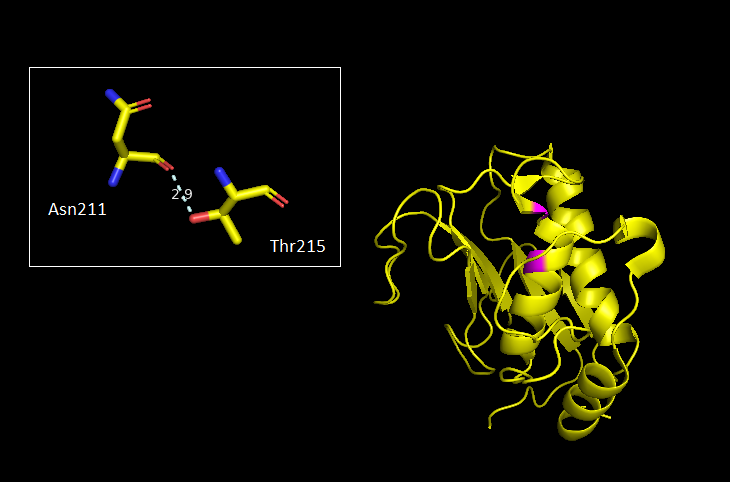 |
Рис. 4 - Водородная связь в петлях, выходящих на поверхность глобулы (Ser189-Gly192)
(крупно и на общем фоне глобулы)
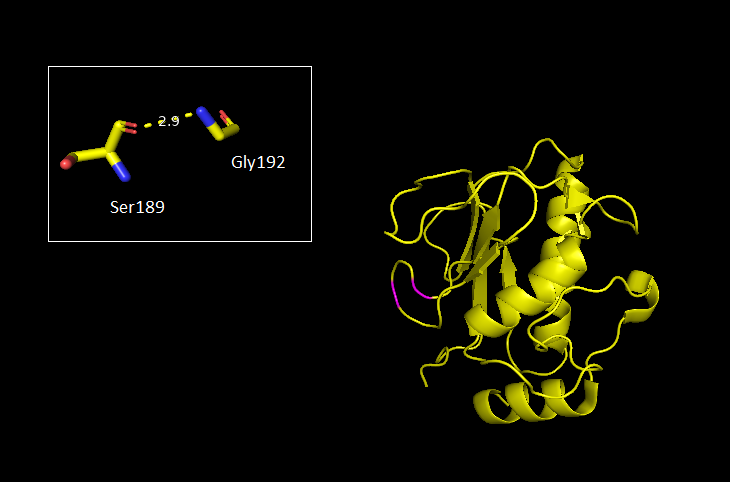 |
Выбранные донорно-акцепторные пары были рассмотрены на ЯМР моделях. Результаты представлены в таблице 2. Как можно увидеть - остовная связь (Ala216(O)-Ile220(N)) присутствует абсолютно во всех ЯМР моделях, поэтому можно сделать вывод, что данная область - довольно стабильна (это было ожидаемо). Боковые цепи более подвижны, значит, вероятность наблюдения водородных связей в ЯМР моделях значительно ниже, что и подтверждают полученные данные - лишь в 8 моделях из 20 присутствует выбранная связь (Asn211(O)-Thr215(OG1)). Петли также отличаются высокой подвижностью, поэтому я ждала результатов худших, нежели получила по факту (85% моделей содержали данную связь (Ser189(O)-Gly192(N))). Возможно, это связано с удачными ЯМР моделями или удачно выбранной связью.
Меньшие длины связей в ЯМР моделях я бы объяснила подвижностью белка в растворе.
Таблица 2. Краткая характеристика расстояний между донорами и акцепторами
| Донор-акцептор | d (РСА) | % моделей ЯМР | dmin (A) | dmax (A) | dmed (A) |
| Ala216(O)-Ile220(N) | 2.8 | 100% | 1.7 | 1.8 | 1.8 |
| Asn211(O)-Thr215(OG1) | 2.9 | 40% | 1.8 | 2.3 | 1.9 |
| Ser189(O)-Gly192(N) | 2.9 | 85% | 1.9 | 2.7 | 2.1 |