Внутримолекулярные взаимодействия в структуре 2BKX
Общая информация о структуре
- Идентификатор PDB: 2BKX.
- Название белка: Н-ацетилглюкозамин-6-фосфат деаминаза (N-acetylglucosamine-6-phosphate deaminase)
- Количество цепей в PDB-файле: 2 (A и B цепи).
Изображение белка представлено на рис. 1. В PDB-файле помимо координат атомов белка и молекул воды приведены координаты атомов молекул фруктозы-6-фосфата (F6R, fructose-6-phosfate). Всего таких молекул в файле 2 (по одной в каждой цепи).
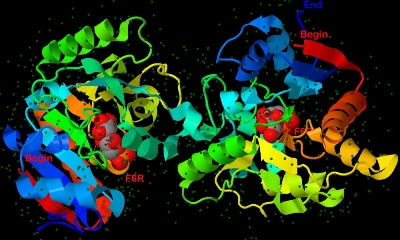 Рис. 1. Изображение структуры белка 2BKX. Цепи белка покрашены в цвета радуги, от красного (в начале цепи) до синего (в конце цепи). Начало и конец подписаны соответственно "Begin" и "End". Маленькие темно-зеленые сферы - кислороды молекул воды. Белым выделен один из продуктов - фруктозо-6-фосфат они подписаны "F6R".
Рис. 1. Изображение структуры белка 2BKX. Цепи белка покрашены в цвета радуги, от красного (в начале цепи) до синего (в конце цепи). Начало и конец подписаны соответственно "Begin" и "End". Маленькие темно-зеленые сферы - кислороды молекул воды. Белым выделен один из продуктов - фруктозо-6-фосфат они подписаны "F6R". Такое изображение белка можно получить с помощью такой последовательности команд на скриптовом языке программы Jmol.
Анализ структуры альфа-спиралей и бета-листов в цепи A белка с кодом PDB 2BKX
В каждой цепи есть альфа-спирали и бета-листы. Далее приводится анализ одной альфа спирали и одного бета-листа цепи А.
Первая альфа-спираль цепи А состоит из аминокислотных остатков с 8 по 27 (всего 20). В ней 5.5 витков. Шаг спирали равен 5.3 ангстрем (рис. 2) (чтобы получить шаг спирали, нужно разделить длину спирали на количество витков: 29.11 / 5.5 ~= 5.3). На один виток спирали приходится 3.6 аминокислотных остатков (рис. 2) (чтобы получить количество аминокислотных остатков на шаг спирали, нужно разделить их количество на число витков спирали: 20 / 5.5 = 3.6). Остаток с номером n образует водородные связи с остатками с номерами n + 4 и n - 4. Например, остаток с номером 17 образует водородные связи с остатками с номерами 13 и 21 (рис. 3).
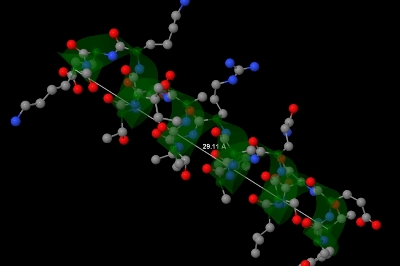 Рис. 2. Изображение первой альфа-спирали цепи A белка 2BKX. Серая линия соединяет начало и конец спирали. Длина этой линии равна длине спирали - 29.11 ангстрем. С-альфа атомы покрашены в зеленый цвет. Цвет остальных атомов соответствует стандартным цветам их химических элементов.
Рис. 2. Изображение первой альфа-спирали цепи A белка 2BKX. Серая линия соединяет начало и конец спирали. Длина этой линии равна длине спирали - 29.11 ангстрем. С-альфа атомы покрашены в зеленый цвет. Цвет остальных атомов соответствует стандартным цветам их химических элементов. Такое изображение белка можно получить с помощью такой последовательности команд на скриптовом языке программы Jmol.
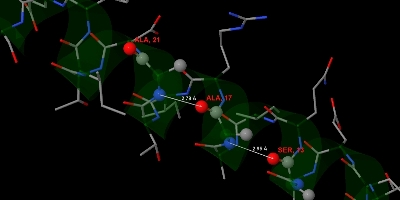 Рис. 3. Изображение первой альфа-спирали цепи A белка 2BKX. С-альфа атомы зеленого цвета. А цвета атомов соответствуют стандартным цветам для их химических элементов (углероды серые, кислороды красные и азоты синие). Большими сферами показаны атомы аминокислотных остатков с номерами 13, 17 и 21. Остаток с номером 17 образует водородные связи с остатками с номерами 13 и 21. Эти водородные связи выделены серыми линиями. Их длины в ангстремах подписаны рядом.
Рис. 3. Изображение первой альфа-спирали цепи A белка 2BKX. С-альфа атомы зеленого цвета. А цвета атомов соответствуют стандартным цветам для их химических элементов (углероды серые, кислороды красные и азоты синие). Большими сферами показаны атомы аминокислотных остатков с номерами 13, 17 и 21. Остаток с номером 17 образует водородные связи с остатками с номерами 13 и 21. Эти водородные связи выделены серыми линиями. Их длины в ангстремах подписаны рядом. Такое изображение белка можно получить с помощью такой последовательности команд на скриптовом языке программы Jmol.
Первый бета-лист антипараллельный (в антипараллельном бета-листе, направления амидных связей полипептидных цепей противоположны, а в параллельном полипептидные цепи сонаправлены) (рис. 4). Он состоит из трех бета-тяжей состоящих из аминокислотных остатков с номерами 67-69, 153-156 и 178-181 соответственно. Данный бета-лист образует вогнуто-выпуклую поверхность, что хорошо заметно на рисунке 4.
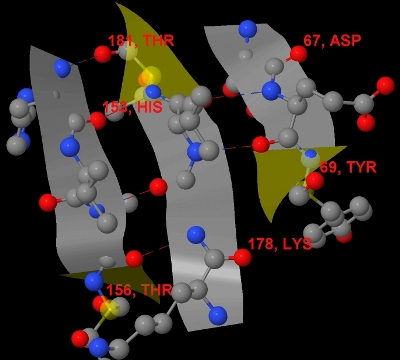 Рис. 4. Изображение первого бета-листа белка 2BKX. Он состоит из трех бета-тяжей состоящих из аминокислотных остатков с номерами 67-69, 153-156 и 178-181 соответственно. Крайние остатки бета-тяжей подписаны номером остатка и названием аминокислоты. Углероды покрашены в серый цвет, кислороды - в красный, азоты - в синий. Желтым цветом выделена стрелка на конце каждого бета-тяжа, показывающая его направление. Из того, что соседние бета-тяжи имеют стрелки в разные направления, можно сделать вывод, что это антипараллельный бета-лист. Водородные связи между тяжами выделены пунктирными линиями.
Рис. 4. Изображение первого бета-листа белка 2BKX. Он состоит из трех бета-тяжей состоящих из аминокислотных остатков с номерами 67-69, 153-156 и 178-181 соответственно. Крайние остатки бета-тяжей подписаны номером остатка и названием аминокислоты. Углероды покрашены в серый цвет, кислороды - в красный, азоты - в синий. Желтым цветом выделена стрелка на конце каждого бета-тяжа, показывающая его направление. Из того, что соседние бета-тяжи имеют стрелки в разные направления, можно сделать вывод, что это антипараллельный бета-лист. Водородные связи между тяжами выделены пунктирными линиями. Такое изображение белка можно получить с помощью такой последовательности команд на скриптовом языке программы Jmol.
Внутримолекулярные взаимодействия боковых групп белка в цепи A структуры 2BKX
В белке всего 4 цистеина, в частности, в цепи А их 2 (аминокислотные остатки с номерами 6 и 113) и расположены они достаточно далеко (рис. 5). Поэтому дисульфидных мостиков в этом белке нет.
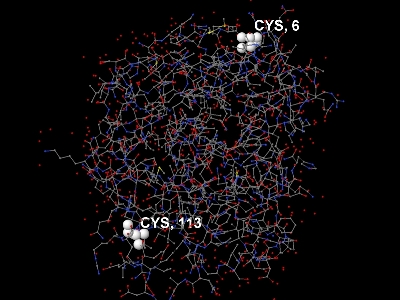 Рис. 5. Изображение цепи А белка 2BKX. Углероды покрашены в серый цвет, кислороды - в красный, азоты - в синий. Цистеины выделены белым цветом и подписаны "CYS" и номером аминокислотного остатка.
Рис. 5. Изображение цепи А белка 2BKX. Углероды покрашены в серый цвет, кислороды - в красный, азоты - в синий. Цистеины выделены белым цветом и подписаны "CYS" и номером аминокислотного остатка. Такое изображение белка можно получить с помощью такой последовательности команд на скриптовом языке программы Jmol.
Солевые мостики образуются в результате взаимодействия боковых цепей отрицательно заряженных аминокислот (глутаминовая и аспарагиновая кислоты) и положительно заряженных аминокислот (лизин, гистидин, аргинин). Солевые мостики в белке nagba показаны на рисунке 6. Один из солевых мостиков в большом масштабе показан на рисунке 7. Он образован глутамином с номером 143 и гистидином с номеров 138.
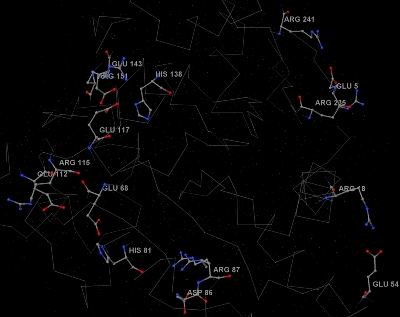 Рис. 6. Изображение цепи А белка 2BKX. Углероды покрашены в серый цвет, кислороды - в красный, азоты - в синий. Показаны солевые мостики. Атомы аминокислот, образующие связь, выделены и подписаны большими синими или красными надписями, состоящими из номера и названия аминокислоты. Так же маленькими серыми надписями подписаны все заряженные аминокислоты в белке.
Рис. 6. Изображение цепи А белка 2BKX. Углероды покрашены в серый цвет, кислороды - в красный, азоты - в синий. Показаны солевые мостики. Атомы аминокислот, образующие связь, выделены и подписаны большими синими или красными надписями, состоящими из номера и названия аминокислоты. Так же маленькими серыми надписями подписаны все заряженные аминокислоты в белке. Такое изображение белка можно получить с помощью такой последовательности команд на скриптовом языке программы Jmol.
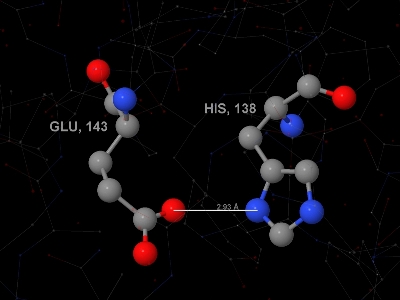 Рис. 7. Изображение солевого мостика в цепи А белка 2BKX. Углероды покрашены в серый цвет, кислороды - в красный, азоты - в синий. Солевой мостик образован аминокислотными остатками с номерами 138 (гистидин) и 143 (глутамин). Расстояние между атомами, образующими связь (кислород глутамина и азот гистидина) - 2.93 ангстрема.
Рис. 7. Изображение солевого мостика в цепи А белка 2BKX. Углероды покрашены в серый цвет, кислороды - в красный, азоты - в синий. Солевой мостик образован аминокислотными остатками с номерами 138 (гистидин) и 143 (глутамин). Расстояние между атомами, образующими связь (кислород глутамина и азот гистидина) - 2.93 ангстрема. Такое изображение белка можно получить с помощью такой последовательности команд на скриптовом языке программы Jmol.