1.Различия во множественных выравниваниях, построенных разными программами
Для выполнения этого задания я выбрала 6 белков из 10 практикума. Эти 6 белков были выравнены программах Tcoffee, Clustal, Muscle. Результаты представлены на рисунке 1. Ссылка на выравнивание. T-coffee использует комбинацию локальных и глобальных парных выравниваний. Muscle -самая быстрая программа, использующая kmer counting и мельчит последовательности на кусочки, базированные а построенных деревьях (refinement using tree-dependent restricted partitioning[1]). Custal omega - постреон не на жадном алгоритме, который не позволяет исправлять ошибки, возникшие на ранних стадиях. В 2000 году был придуман принцип Целостности (the consistency principle), позволивший разработать более точные алгоритмы. данный метод основан на построении guide tree, производящий не N^2, а N logN вычислений, где N-количество последовательностей [2].

1) В 37 позиции в Tcoffee глицины у двух первых и последних белков поставлены напротив глицинов 37 позиции, а не 41.
2) В Tcoffee аминокислоты поцизий 84-87 и 116-119 разнесены и образуют границы гомологичных блоков, а в Muscle и Clustal они собраны посередене этого инделя и образуют собственный гомологичный блок. Причем в Muscle и Clustal таким образом образуются 2 инделя, что уменьшает вес этих выравниваний.
3) Позиции 226-228 различаются между собой во всех 3-х выравниваниях. В этом участке необходимо где-то поставить гэпы и разные программы ставят столбик гэпов на разных позициях.
4) Разница в последних позициях. Программы Tcoffee и Muscle строят выравнивание, оканчивающееся на столбик аминокислот, а Clustal ставит в конце более коротких белков гэпы до окончания самого длинного белка.
2.Описание различных доменных архитектур домена KH-1
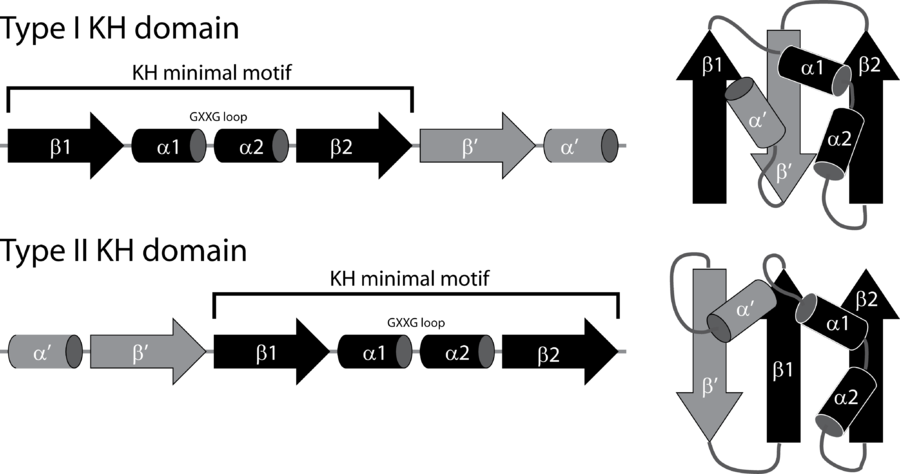
Для выполнения этого задания я выбрала KH домен, состоящий из примерно 7- аминоксилотных остатков, представленный во многих белках, связывающихся с аминоксилотами. Существует два типа таких доменов (см. рисунок 2). Первый обычен для эукариот, второй - для прокариот. Связывание осуществляется за счет "щели", образованной между альфа спиралью 1 и 2, высококонсервативным участком. Связывание осуществляется за счет гидрофобных взаимодействий. Также отмечено, что в этом связывании отсутствуют стэкинг-взаимодействия между аминоксилотными остатками и нуклеотидами. KH-1 домен принадлежит к KH-клану, который является вторым по распространенности среди РНК-связывающих доменов [3].
1. Первый тип архитектуры, про который я хочу рассказать, это линейно расположенные друг за другом несколько доменов. Такой тип архитектуры встречается у белка KSRP или FUBP2 (Q92945). Схема доменов отображена на рисунке 2.
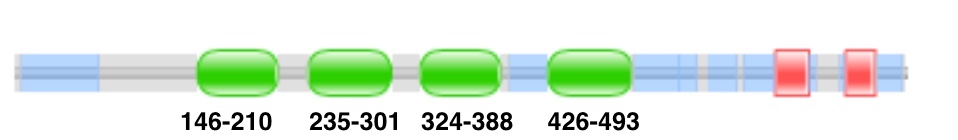
Этот белок содержит 4 KH-домена, первые два из которых расположены на расстоянии 25 а.о., а между третьим и четвертым - 50 а.о.. Этот белок служит для регуляции деградации РНК, содержащих в 3`-нетранслируемой области AU-богатые участки. Такой тип регуляции экспрессии генов широко распространен в генах, участвующих в про- и анти-воспалительном ответе [5]. Такая архитектура встречается у 130 белков.
| Resume |
| Рисунок 3. Связывание KH-доменов с РНК |
2. Второй тип доменной архитектуры включает в себя соседствование KH-1 домена с AKAP7_NLS (РНК-лигаза подобный домен). Такой тип архитектуры встречается у белка L8H5E2_ACACA Акантамебы и еще у 287 белков. Пример организации белка приведен на рисунке 4. Как мы видим, KH-домен может идти " в связке" с другим функциональным доменом. То есть RH-домен беспечивает связывание белка с РНК, а функциональный домен уже осуществляет свою функцию.

3. Следующий тип архитектуры включает в себя соседствование KH-1 домена и Tudor домена и встречается у 210 белков. Мы будем рассматривать его на примере T1FU13_HELRO, белка плоского червя. Tudor домен включает в себя примерно 50 аминокислотных остатков и узнает метилированные гистоны [6]. И опять мы видим сочетание связывающего и функционального доменов в одном белке. Пример структуры представлен на рисунке 5.

3. Список литературы
[1] https://www.ncbi.nlm.nih.gov/pubmed/15034147
[2] http://msb.embopress.org/content/7/1/539
[3] http://pfam.xfam.org/family/PF00013#familySummaryBlock
[4] http://pfam.xfam.org/family/PF00013#tabview=tab2
[5] King P.H., Chen C.-Y. Role of KSRP in control of type I interferon and cytokine expression. // J. Interferon Cytokine Res. 2014. Vol. 34, № 4. P. 267–274.
[6] http://pfam.xfam.org/family/PF00567#tabview=tab0