Часть 1. Гидрофобные ядра эндонуклеазы LMAP (2J63)
| Cores> | Текст скрипта |
| Phe351A | Текст скрипта |
| DNAprot | Текст скрипта |
| DNA | Текст скрипта |
| Для переключения изображений нажмите "Resume" |
На данной странице вы узнаете описание внутренностей белка Эндонуклеазы LMAP (2J63).
Цепь А данного белка содержит 1 гидрофобное ядро размером в 632 атома, что составляет 23,81% от общего числа атомов данной цепи. При нажатии кнопки 'Cores' вы увидите изображение гидрофобного ядра цепи А . При нажатии кнопки 'Resume' можно увидеть выходы этого ядра на поверхность белка.
Как можно увидеть, не более 15% атомов гидрофобного ядра
экспонировано на поверхность белка, осатльные его элементы скрываются внутри
глобулы. Это неудивительно, ведь вода стремится образовывать
водородные связи (т.к. связывание понижает химическую энергию, а система, согласно
термодинамике стремится к состоянию с минимальной энергией), поэтому гидрофобные
молекулы, не способные к этому, она отталкивает, и они принимают
конформацию, обеспечивающую минимальную площадь соприкосновения с водой.
| Расстояние в ангстремах | Количество атомов (не считая PHE 351) |
| 1 | 0 |
| 2 | 2 |
| 3 | 7 |
| 4 | 35 |
| 5 | 65 |
| 6 | 90 |
| 7 | 124 |
Из таблицы 1 видно, что начиная с расстояния в 4 ангстрема от выбранной аминокислоты в выбранное поле попадает большое количество атомов, закрывающих бОльшую часть поверхности фенилаланина. Возможно, это значение является характерным расстоянием между центрами ковалентно не связанными атомами в белке. Интересен тот факт, что даже при визуализации всех атомов цепи в виде ван-дер-ваальсовых радиусов, мы все равно будем видеть атомы нашего фенилаланина (См. рис. 1).
 |
| Рисунок 1. Изображение ван-дер-ваальсовых радиусов цепи А с выделенным зеленым PHE351 |
Давайте посчитаем, сможет ли между соседними атомами поместиться молекула воды (ее радиус примем равной ван-дер-ваальсовому радиусу кислорода, равному 1,52 ангстрема [1]). Сначала посчитаем максимально доступное расстояние между центрами соседними атомами (для кислорода, т.к. он обладает наименьшим радиусом из всех основных молекул, входящих в состав белков) = 4-3,04 = 0,96 ангстрем (4 ангстрема-характерное расстояние между ковалентно не связанными атомами, полученное эмпирическим путем из предыдущего задания данного практикума). Диаметр молекулы воды - 3,04 ангстрема. Получается, что места для этой молекулы не остается.
Часть 2. Комплекс белка с ДНК (5g35)
При нажатии на кнопку 'DNAprot' вы увидите изображение участка ДНК, связанного с белком репарации Rad14. Кроме осуществления репарации белки могут связываться с ДНК для того, чтобы изменить укладку хроматина и привлечь транскрипционный аппарат (транскрипционные активаторы), регулировать экспрессию генов (обычно данные взаимодействия изучаются с помощью хроматиновой иммунопреципитации и ДНК-микрочипов) [2]. Кроме того, существуют различные метилазы, метилирующие цепи ДНК и защищающие их от нуклеаз-белков, расщепляющих ДНК. Белки не обязательно должны иметь ферментативную активность, чтобы связаться с ДНК, например, существуют различные гистоны, участвующие в упаковке хроматина и SSB-белки, связывающие одноцепочечную ДНК при репликации, препятствующие спариванию расплетенных цепочек ДНК.Дополнительные задания. Для того, чтобы увидеть расположение доноров и акцепторов водородных связей на поверхности ДНК нажмите кнопку 'DNA'. Как можно видеть на изображении 'Protein contacts with DNA', этот белок взаимодействует с сахаро-фосфатным остовом большой бороздки ДНК (красным и синим цветами показаны атомы ДНК и белка, расположенные на расстоянии менее 5 ангстрем друг от друга).
Из рисунка 2 видно, что по расположению доноров и акцепторов водородных связей можно различить нукеотиды большой бороздки ДНК.
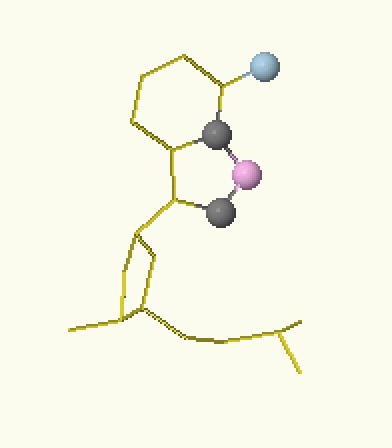 | 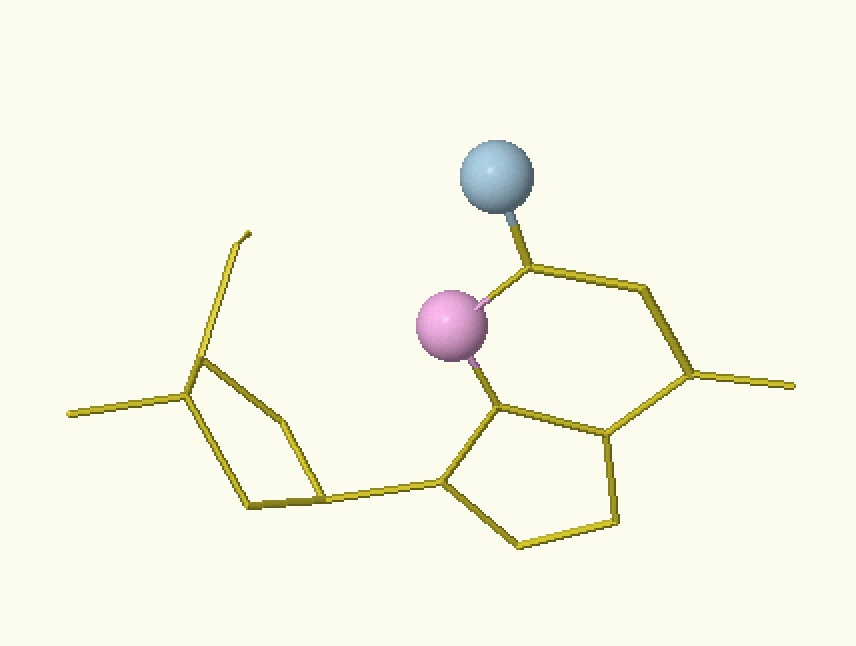 | 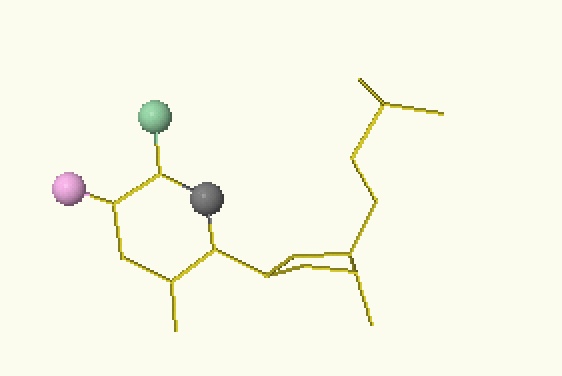 | 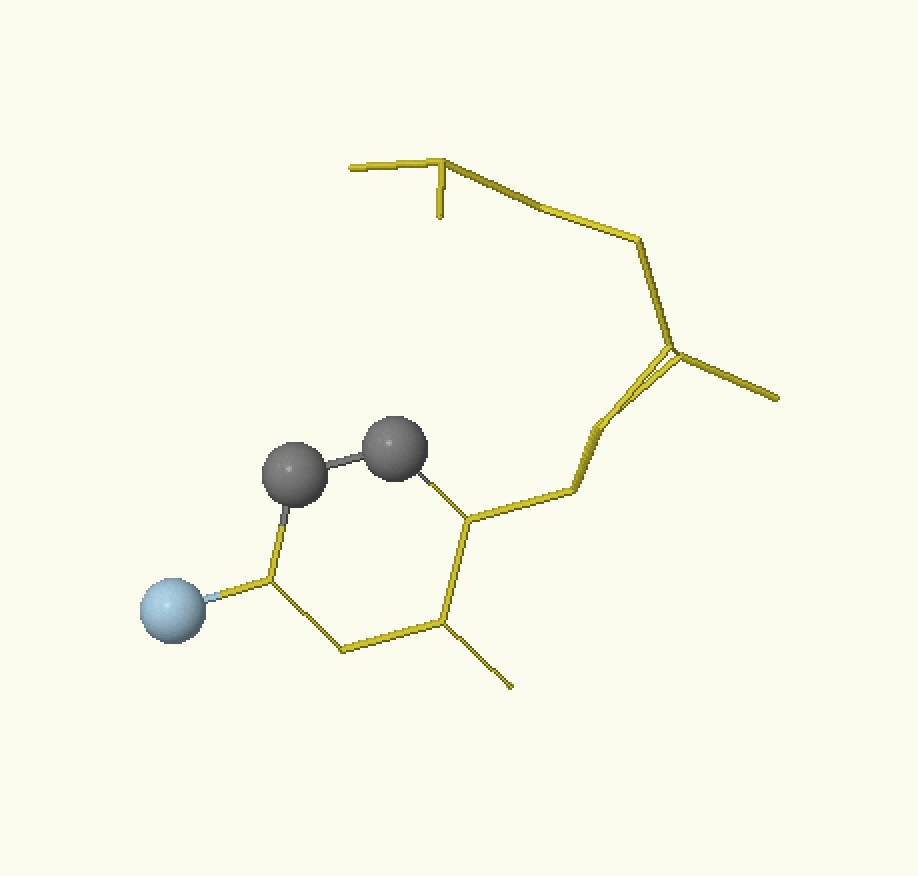 |
| АМФ | ГМФ | ТМФ | ЦМФ |
| Рисунок 2. Расположение доноров (голубой) и акцепторов (розовый) водородных связей на нуклеотидах большой бороздки ДНК | |||
Водородных связей между сахаро-фосфатным остовом и белком обнаружено не было.
На видео задания 5 представлена реакция фосфорилирования тирозина-37. К белку подходит диэтил- 4-нитрофенол-фосфат [3] и служит донором фосфатной группы для этой реакции. Реакция протекает по механизму бимолекулярного нуклеофильного замещения [4]. Возможно, эта реакция является ингибирующей, а возможно, и активирующей белок (фосфорилирование по тирозину приводит к различным эффектам для различных белков).
[1] http://www.nado.znate.ru/Радиус_Ван_дер_Ваальса
[2] Ren B. и др. Genome-wide location and function of DNA binding proteins. // Science. 2000. Т. 290. № 5500. С. 2306–9.
[3] http://www.sigmaaldrich.com/catalog/product/aldrich/855790?lang=en®ion=RU
[4] https://ru.wikipedia.org/wiki/Реакции_нуклеофильного_замещения