Общая характеристика структуры
- Название белка: Гистидин-содержащий белок-переносчик фосфора в системе фосфотрансферазы (Histidine-containing phosphocarrier protein of the phosphotransferase system)
- Идентификатор в базе данных PDB:2FEP
- Количество цепей:2:цепь A и цепь S
- Небелковые компоненты в PDB-файле: в файле PDB также приведены координаты 3 молекул сульфат ионов
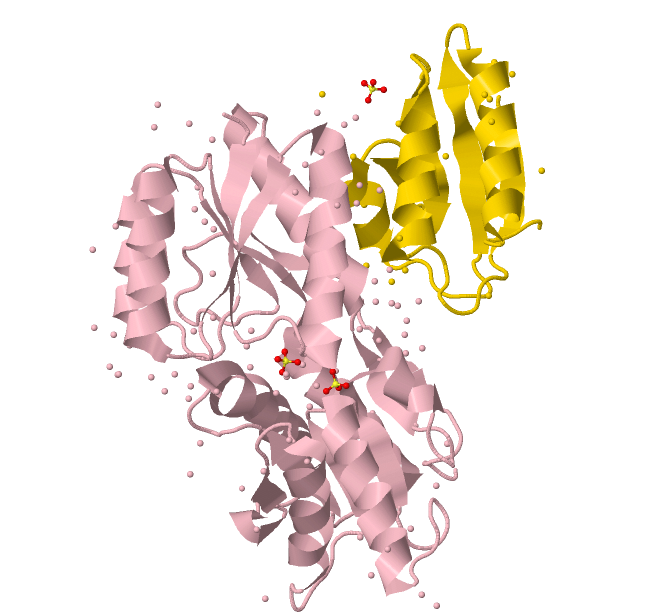 |
|
Рис. 1 Общий вид структуры: цепь А-розовый, цепь S-золотой,
небелковые лиганды покрашены стандартными цветами для определенных элементов | |
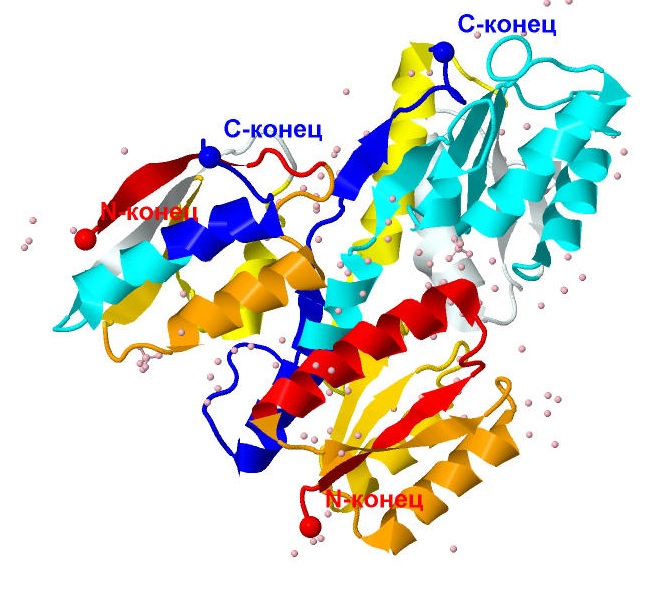 |
|
Рис. 2 Последовательность расположения различных групп из элементов вторичной структуры. От N-конца к C-концу цвета изменяются градиентом от красного к синему |
Анализ структуры альфа-спиралей и бета-листов в цепи A белка с кодом
PDB 2FEP
В этом разделе будет представлена характеристика двух произвольно выбранных элементов вторичной структуры белка: одного бета-слоя (из четырех бета-тяжей и одной альфа-спирали).
Расположение этих элементов в структуре белка показано на рисунке 3.
В альфа спирали через каждые 4 витка атомы главной цепи занимают одинаковые позиции и могут быть соединены условной линией, которая будет параллельна "оси" всей спирали. Так был произведен расчет длины шага альфа-спирали(см.рис.4)Шаг спирали составил 5,53 ангстрема.
Также было подсчитано число остатков аминокислот на виток спирали. Одинаковые позиции (через 4 витка) занимают атомы каждого 16-го аминокислотного остатка, следовательно: 16/4=4 аминокислотных остатка на виток спирали.
На рисунке 5(см.рис.5)представлено изображение некого аминокислотного остатка n и двух водородных связей, которые он образует с остатками n+4 (с помощью карбоксильной группы)и остатком n-4 с помощью аминогруппы. Стоит отметить,что линии, соединяющие азот и кислород ,-лишь схематичное изображение связи, так как в водородной связи есть еще и атом водорода, не показанный на рисунке.
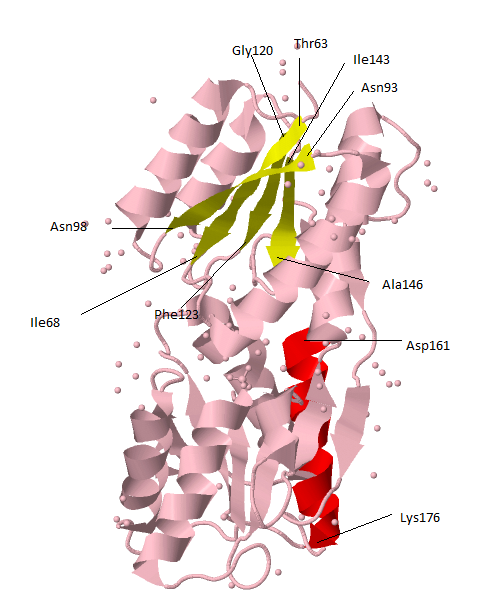 |
Рис. 3Описываемые альфа-спираль и бета-лист на структуре цепи A. Аминокислотные остатки начала и конца каждого из выбранных элементов вторичной структуры. |
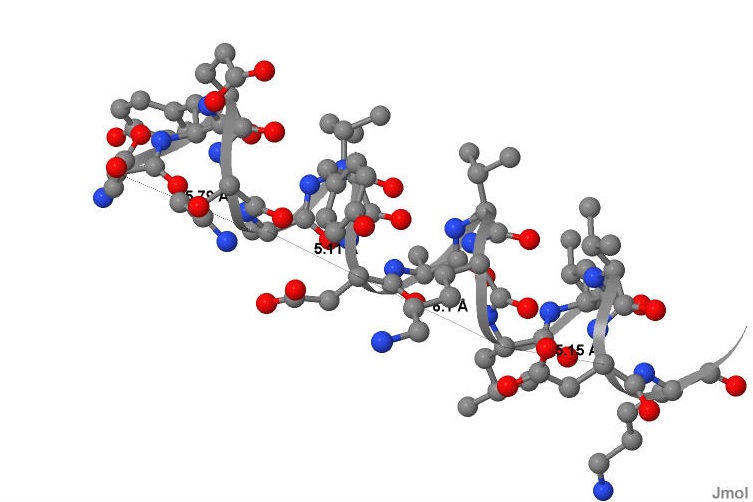 |
Рис. 4Измерение шага альфа-спирали |
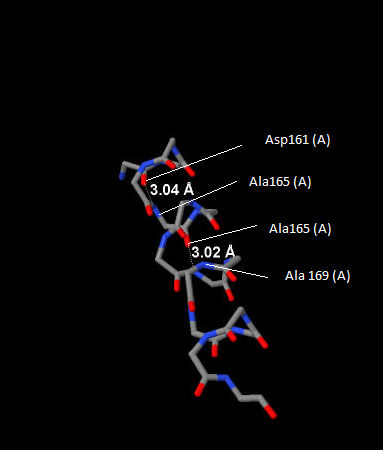 |
Рис. 5Расположение водородных связей при n-ом аминокислотном остатке в альфа-спирали.Длина связи.Атомы окрашены стандартными цветами. |
Бета-лист представлен четырьмя бета-тяжами,которые параллельны друг другу. Лист образует вогнутую поверхность, которая представлена на рисунке 6.
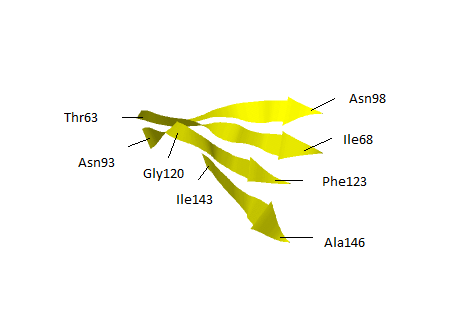 |
Рис. 6Бета-лист белка(63-146 а.к) |
Внутримолекулярные взаимодействия боковых групп белка структуры 2FEP
Для поиска дисульфидных мостиков необходимо найти цистеиновые остатки. Их в данном белке нет(командой Jmol выделено
0 атомов),а значит, нет и дисульфидных мостиков.
В данном белке есть солевые мостики, они образуются между отрицательно и положительно заряженными аминокислотами.
Длина такой связи не превышает 4-х ангстрем. Найденные солевые мостики показаны на рисунке 7, а отдельный солевой
мостик на рисунке 8.
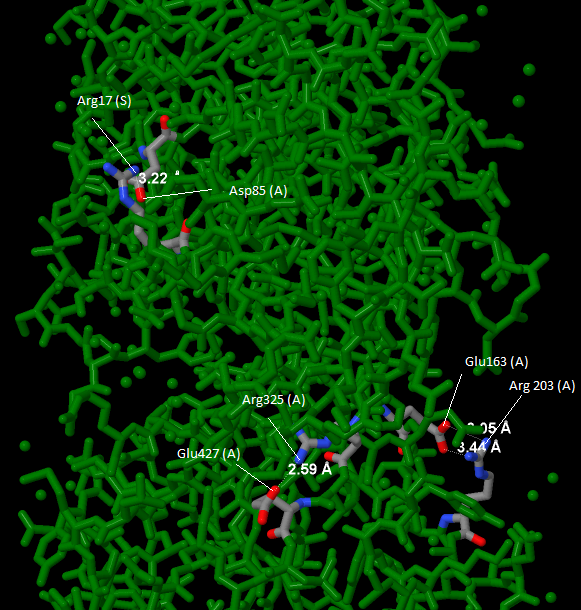 |
Рис. 7Потенциальные пары, способные образовать солевые мостики |
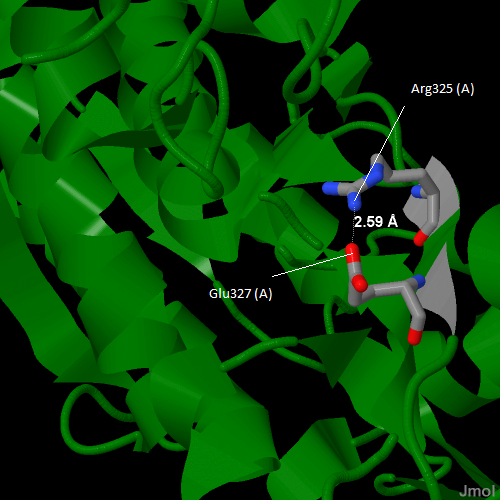 |
Рис.8Солевой мостик между Arg325 (A) и Glu327 (A) |
© Boskhomdzhieva Baina, 2012