Описание контактов внутри кристалла
Кристаллографические характеристики структуры гистидин-содержащего белка-переносчика фосфора в системе фосфотрансферазы 2FEP указаны в поле CRYST1 файла PDB:
CRYST1 67.620 67.620 167.218 90.00 90.00 90.00 P 41 21 2 8
Первые три числа представляют длины направляющих векторов, следующие три - углы между ними. В одной ячейке содержится 8 молекул.2FEP является гетеротетрамером,ячейка кристалла состоит из цепей- A и S.
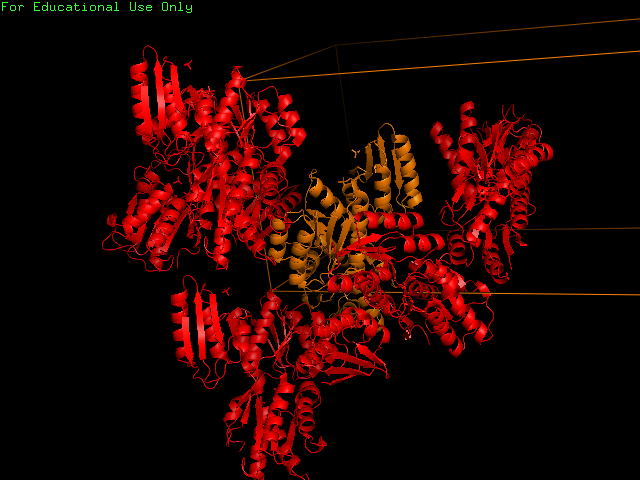 |
Рис. 1 Изображение молекул соседних ячеек белка 2fep |
|
Для отображения водородных связей и восстановления ячейки использовались следующие команды:
symexp symp, 2fep, 2fep, 2, 1
select st1, byres (2fep within 3.5 of symp*)
select st2, byres (symp* within 3.5 of 2fep)
color white, byres (st2 and (st1 around 3.5))
color white, byres (st1 and (st2 around 3.5))
show sticks, byres (st1 and (st2 around 3.5))
show sticks, byres (st2 and (st1 around 3.5))
distance hbonds, st1, st2, 3.5, 2
show cell
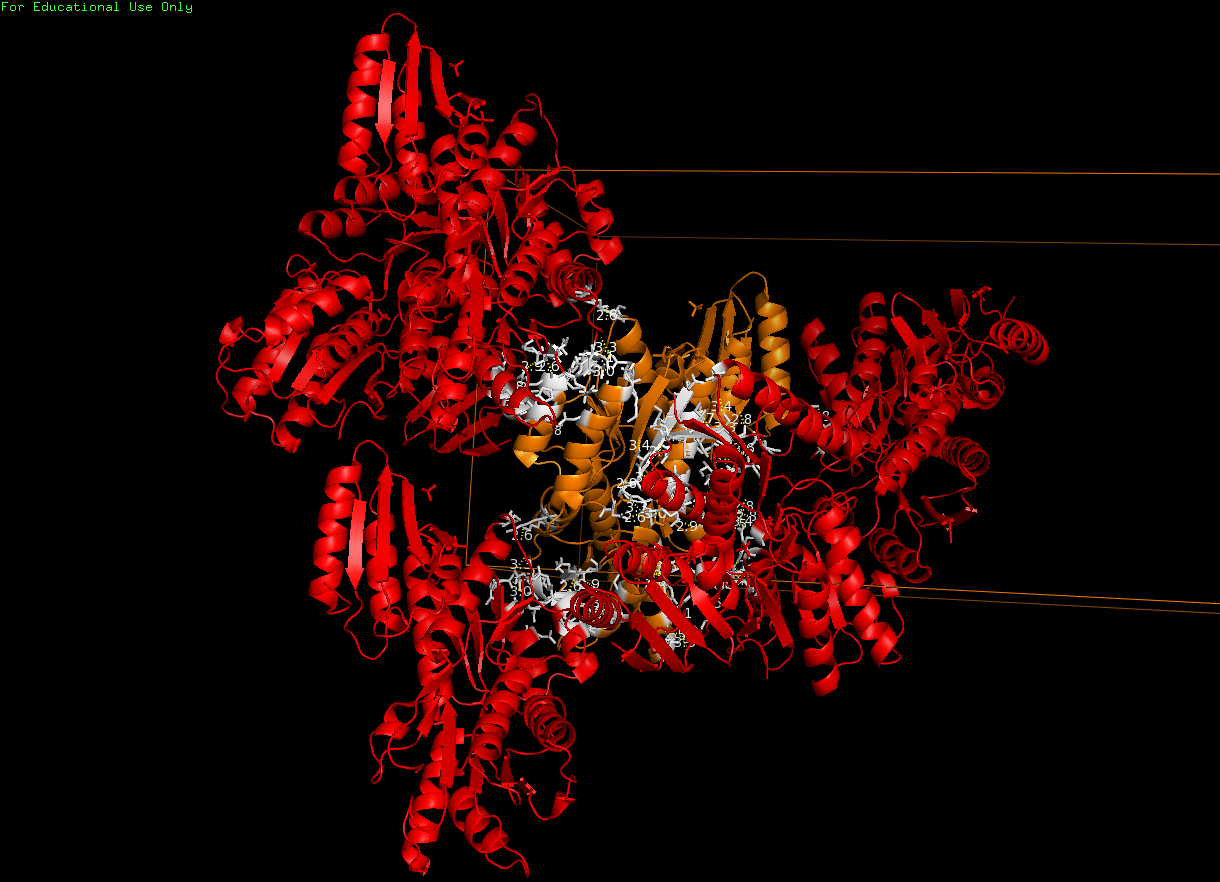 |
Рис. 2Взаимодействия между соседними молекулами |
|
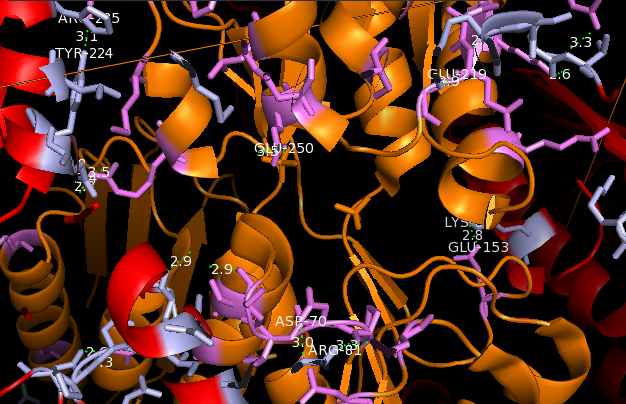 |
Рис. 3 Водородные связи между остатками цепи A: Pro69 и Arg81, Arg279 и Glu250, Arg138 и Glu219, Asp100 и Arg81,Tyr224 и Arg285, Glu153 и Lys82, Asp70 и Arg81 |
|
Для нахождения гидрофобных взаимодействий применили следующие команды.
symexp symp, 2fep, 2fep, 20
select hyph, resn leu+ile+val+phe+trp+met+ala
distance hyphint, byres(hyph and 2fep), byres(hyph and symp*), 4
select hyph_res1, byres((hyph and 2fep) within 4 of (hyph and symp*))
select hyph_res2, byres((hyph and symp*) within 4 of (hyph and 2fep))
show sticks, hyph_res*
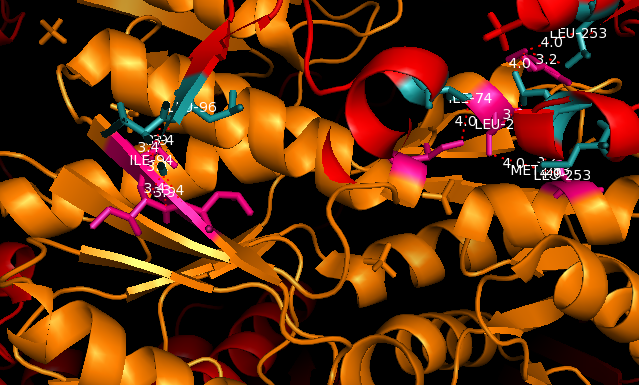 |
Рис. 3 Гидрофобные взаимодействия между остатками Ile-74,Leu-253, Met- 283,Ile-94, Leu-96 цепи А и соседних молекул |
|
Анализ взаимодействий белка с соседствующими в кристалле молекулами позволяет получить более полное представление о структуре. Рассмотрение и визуализация этих контактов для структуры 2FEP позволили продемонстрировать свойство симметрии в кристалле,получить представление о взаимодействии молекул соседних ячеек и сделать вывод о том, что водородные связи и гидрофобные взаимодействия играют большую роль в кристаллизации белка 2FEP.
Расположение белковых цепей в структуре ДНК-белкового комплекса
Была выбрана структура 3HDD (белковая цепь "на краю" ДНК).3HDD (структура комплекса гомеодомена engrailed и ДНК), разрешение 2.2 ангстрем,состоит из 2 цепей A и B.(на рис. 4 цепь А выделена красным цветом, а цепь B- зелёным)
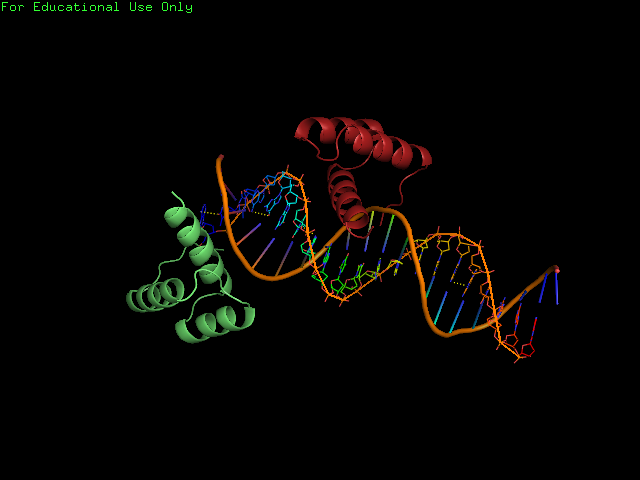 |
Рис. 4 Структура 3HDD |
|
На рис 5.,применив команду symexp, были построены соседние ассиметрические единицы.При этом цепь B белка взаимодействует как с цепью ДНК в «своей» ячейке, так и с цепями ДНК соседнех ячеек.
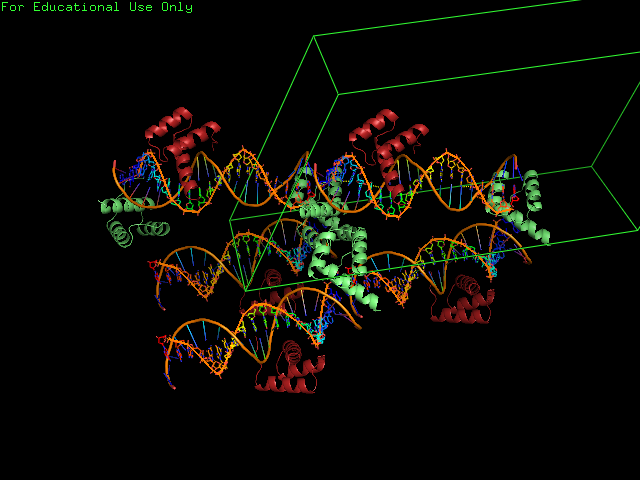 |
Рис. 4 Структура 3HDD и соседних молекул |
|
Рисунок 5 демонстрирует водородные связи между цепью B белка и ДНК из соседней ячейки (фрагменты белка и ДНК, расположенные на расстоянии не более 3,5 ангстрем).
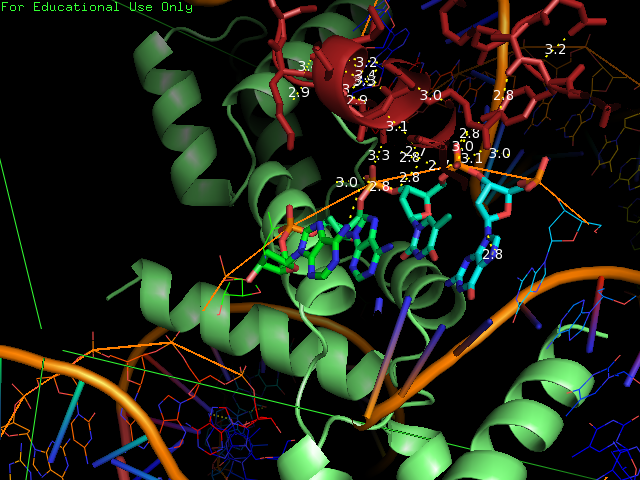 |
Рис. 5 Водородные связи между цепью B белка и ДНК из соседней ячейки |
|
Итак,на примере структуры 3HDD, одной асимметрической единицы не всегда достаточно для анализа структуры. Именно визуализация молекулы ДНК соседней ячейки кристалла и выявление контактов белка с ДНК позволили объяснить странное, на первый взгляд, положение цепи B белка, находящейся «на краю» двойной спирали ДНК асимметрической единицы.
© Boskhomdzhieva Baina, 2015






