Практикум 11
Pfam
Задание 2
| ID | Neuraminidase |
| AC | PF18413 |
| Название | Neuraminidase-like domain |
| #Seed | 85 |
| #Full | 344 |
| #Architectures | 50 |
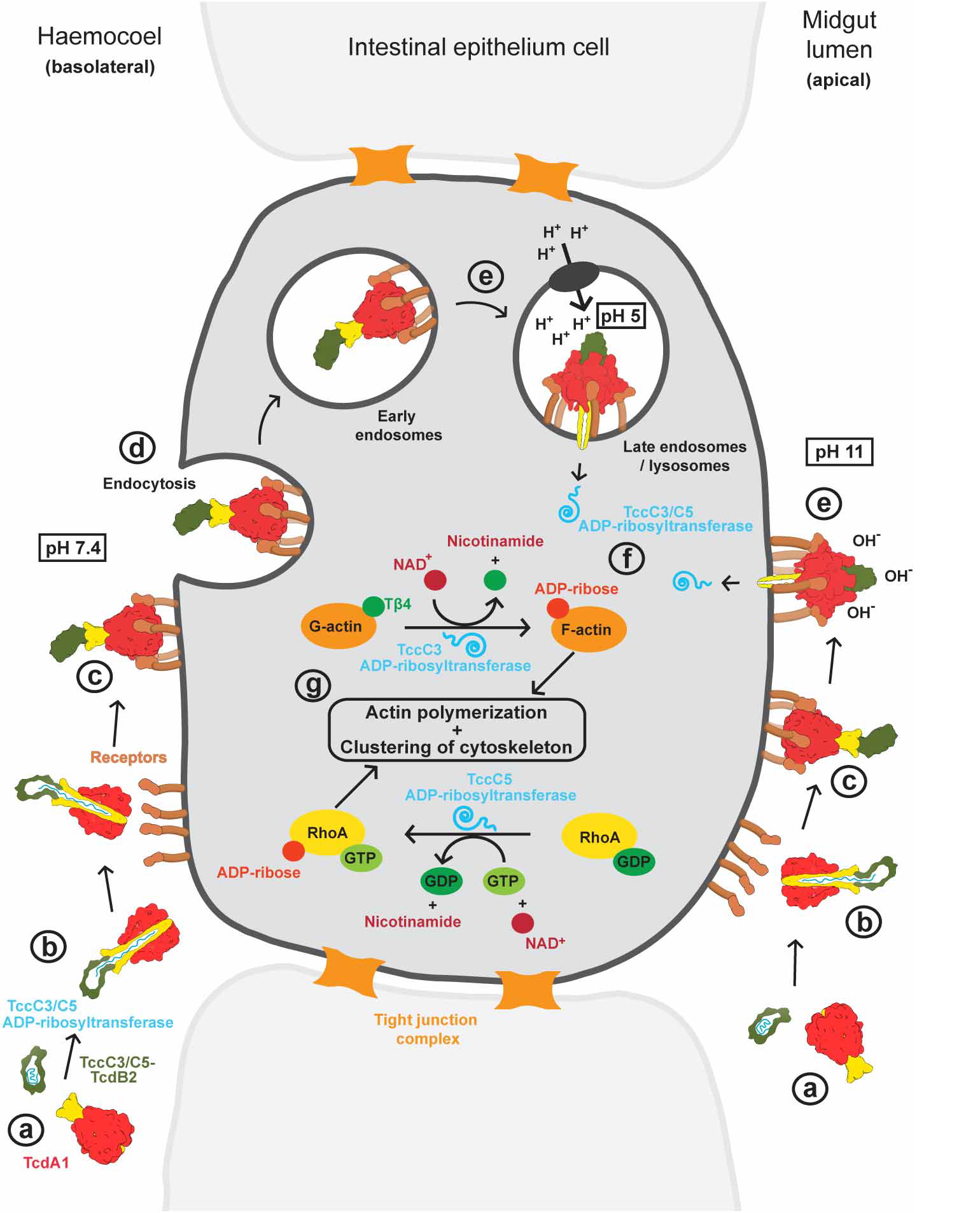
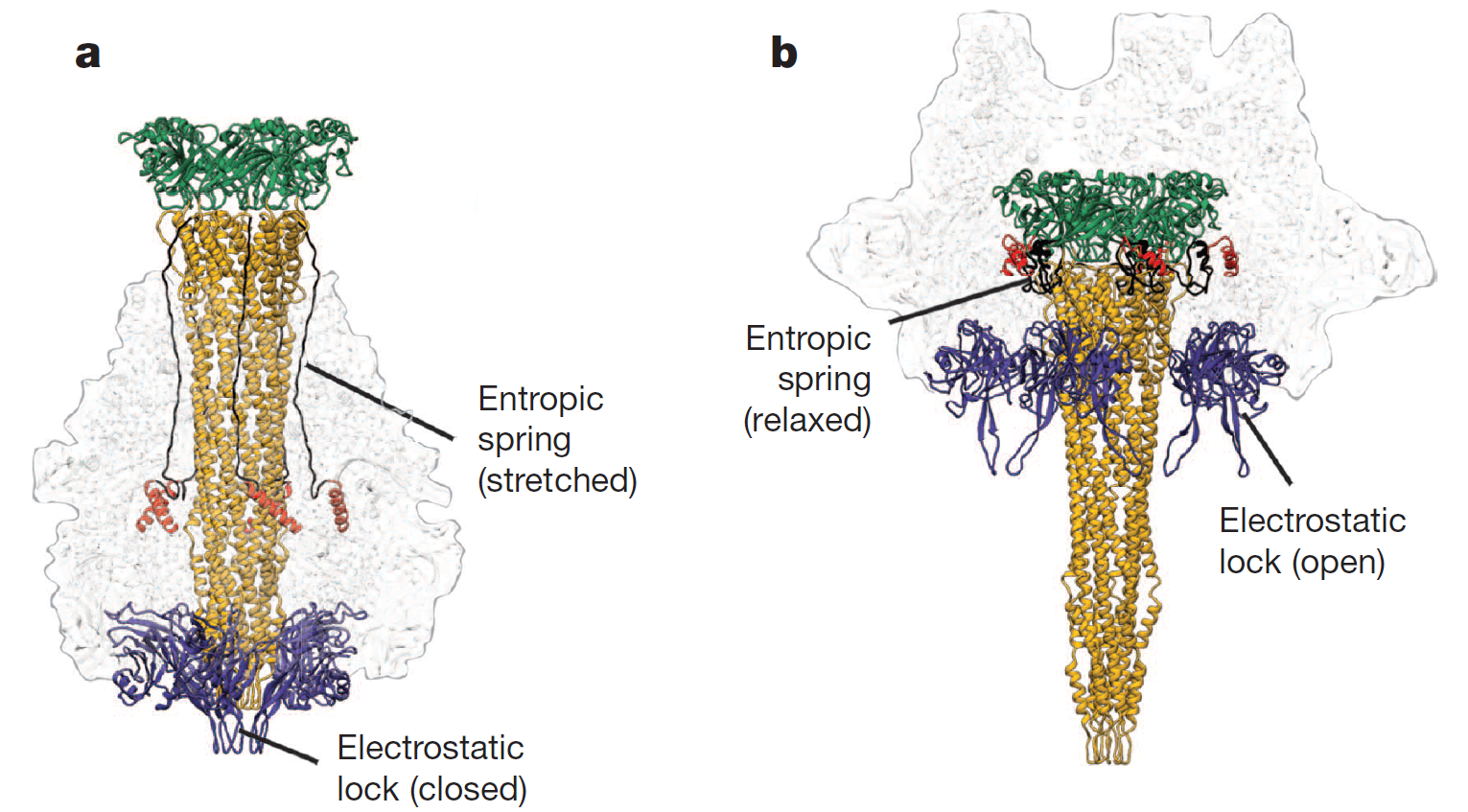
Этот домен встречается в составе A-субъединицы ABC-токсинов. Токсин действует так: B- и C-субъединицы образуют «кокон», внутрь которого от C-субъединиц отщепляется фрагмент, который и является цитотоксичным. С димером из B- и C-субъединицы связывается пентамер из A-субъединиц, который формируют трансмембранную пору, в которую открывается «кокон», и токсин проникает в клетку (рис. 1). Обсуждаемые домены действуют как электростатический замок, который открывает пору в кислой или щелочной среде (рис. 2). Домен называется нейраминидазоподобным, потому что он «пространственно гомологичен» нейраминидазе; нейраминидазной активности, как я понял, у него нет (Meusch et al., 2014; Piper et al., 2019).
Этот домен встречается в белках аскомицетов и разнообразных бактерий, в т. ч. актиномицетов, протеобактерий, цианобактерий и др.
Задание 3
В выравнивании seed этого семейства можно выделить пять консервативных регионов: 1–9, 30–46, 88–98, 127–143, 228–242 остатки. Некоторые (на глаз самые крупные) достоверные блоки, которые можно выделить в выравнивании, перечислены в табл. 2. См. выравнивание в проекте Jalview.
| Колонки | Длина блока | Последовательности | Доля последовательностей, входящих в блок | Комментарий |
|---|---|---|---|---|
| 1–9 | 9 | 2, 4, 6, 10–24, 26–29, 31–33, 35, 47–61, 64–67, 69, 74, 76–78, 82–87 | 61% | Блок начинается аминокислотой с алифатическим радикалом, заканчивается глутаматом или аспартатом. Внутри в 3, 4 и 7 колонках довольно консервативны соответственно валин, валин и тирозин. | 33–46 | 13 | 1, 6, 10–14, 16–43, 46–60, 62–72, 76–84 | 82% | Блок начинается с глицина или аланина, заканчивается аргинином. На 39 позиции у всех последовательностей, входящих в блок, стоит гэп. 31, 32, 43–45 колонки тоже довольно консервативны. |
| 88–98 | 11 | Все, кроме 28, 35, 37, 51, 53, 76. | 93% | Блок начинается с триптофана, заканчивается аминокислотой с алифатическим радикалом, б. ч. изолейцином. 91 остаток — единственный идентичный у всех последовательностей в выравнивании (триптофан). |
| 127–137 | 10 | 1–27, 30–31, 33–40, 42, 44–61, 63, 67–80, 82–85 | 88% | Блок начинается и заканчивается аминокислотами с алифатическим радикалом. Гэп в позиции 135. Внутри очень консервативны 129, 136 позиции (пролин, аргинин), консервативна 130 позиция (валин). Хороший блок. |
| 127–141 | 14 | 1–5, 30–61, 63, 67–80, 82–85 | 66% | 138–140 довольно консервативны; см. пред. |
| 228–242 | 13 | 2–9, 11–23, 25–31, 43, 78–85 | 44% | Блок начинается аминокислотой с алифатическим радикалом, заканчивается триптофаном. Гэпы в позициях 236–237. У последовательностей, принадлежащих к этому блоку, но не у остальных, в позиции 234 стоит глутамат (за единичными исключениями). Интересный блок. |
| 103–118 | 16 | 6–7, 10, 16–19, 21–25, 27–28 | 16% | Блок начинается с пролина, заканчивается глицином. |
| 342–346 | 5 | 2, 6, 8, 10, 12, 14–16, 18–20, 23–24, 28, 30, 27, 39, 46–49, 51–53, 62, 65–68, 71–72, 75, 77, 80, 83–84 | 42% | Блок начинается и заканчивается аминокислотами с алифатическим радикалом. |
Задание 4
Я выбрал архитектуры ABC_toxin_N, Neuraminidase, TcA_TcB_BD (71 белок в full) и ABC_toxin_N, Neuraminidase (35 белков). Я смог найти два достоверных блока, в которые входили бы только последовательности домена из белков с первой архитектурой: в один блок входит 60 последовательностей из первой архитектуры и 4 из второй, в другой — соответсвенно 54 и 1 (см. проект Jalview; перед названиями последовательностей стоят цифры 1 и 2 — указание на архитектуру). Блоков, уникальных для второй архитектуры, или таких, которые разделили бы все последовательности, пришедшие из разных архитектур, я не нашел.
Список литературы
- Meusch, Dominic; Gatsogiannis, Christos; Efremov, Rouslan G.; Lang, Alexander E.; Hofnagel, Oliver; Vetter, Ingrid R.; Aktories, Klaus; Raunser, Stefan. Mechanism of Tc toxin action revealed in molecular detail. Nature 2014, v. 508 (7494), 61–65.
- Piper, Sarah J.; Brillault, Lou; Rothnagel, Rosalba; Croll, Tristan I.; Box, Joseph K.; Chassagnon, Irene; Scherer, Sebastian; Goldie, Kenneth N.; Jones, Sandra A.; Schepers, Femke; Hartley-Tassell, Lauren; Ve, Thomas; Busby, Jason N.; Dalziel, Julie E.; Lott, J. Shaun; Hankamer, Ben; Stahlberg, Henning; Hurst, Mark R. H.; Landsberg, Michael J. Cryo-EM structures of the pore-forming A subunit from the Yersinia entomophaga ABC toxin. Nature Communications 2019, v. 10 (1).