Практикум 3
Структура записи в PDB.
PDB ID рассматриваемой записи — 1ML4.
- Это белок.
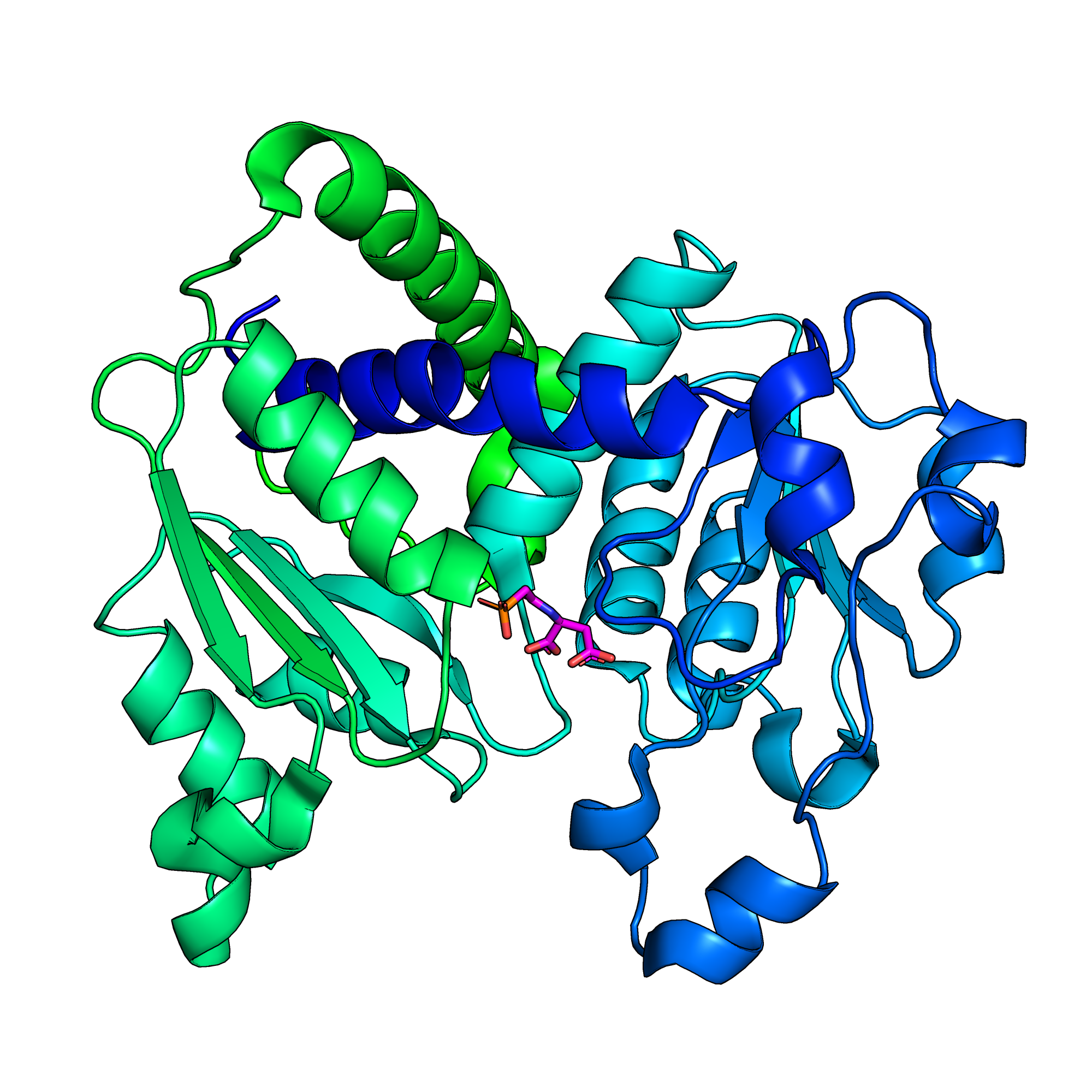
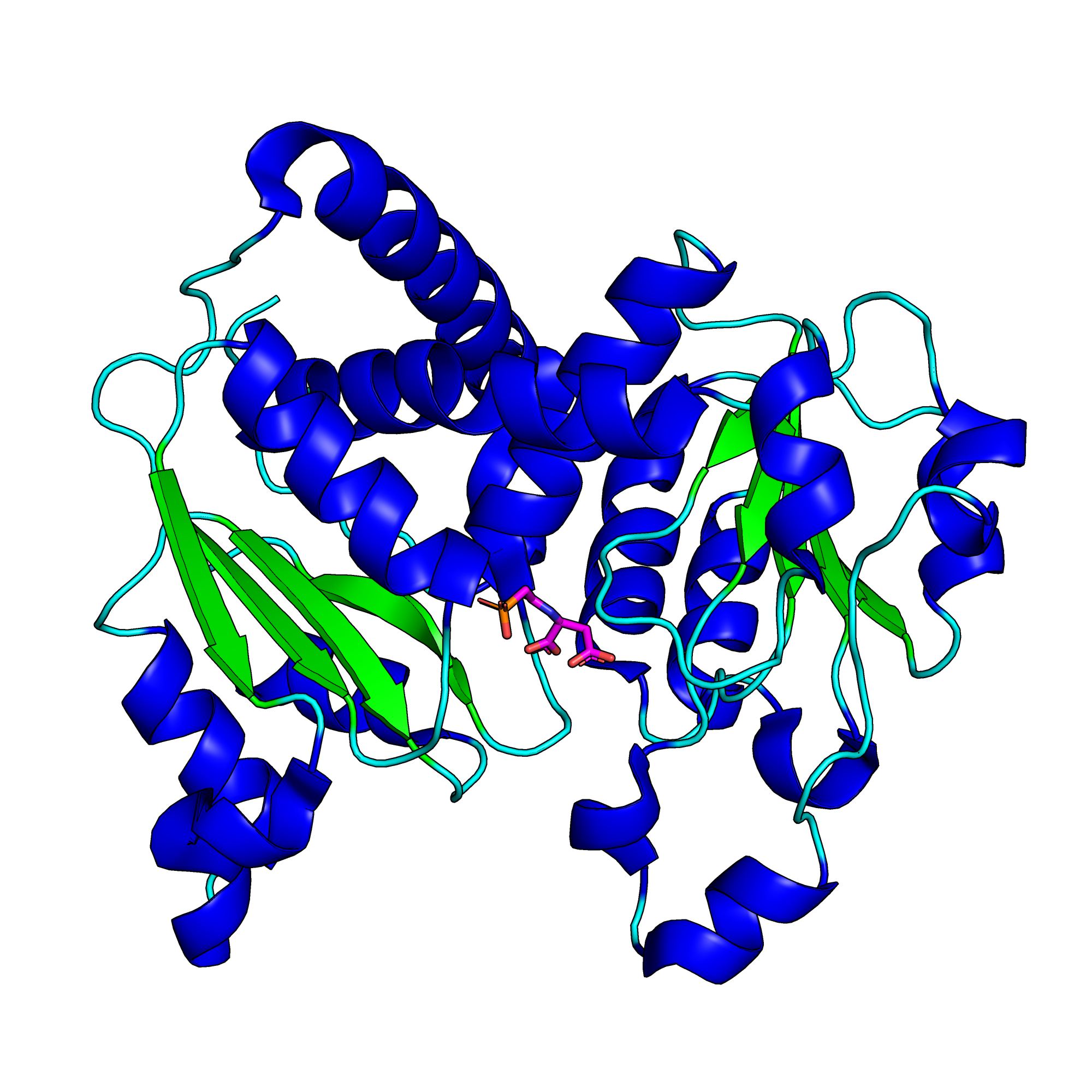
- В структуре одна цепь (рис. 1). α-спиралей в белке больше, чем β-слоев. В α-спирали входит 169 аминокислотных остатков, в β-слои — 46, в петли — 92 (рис. 2).
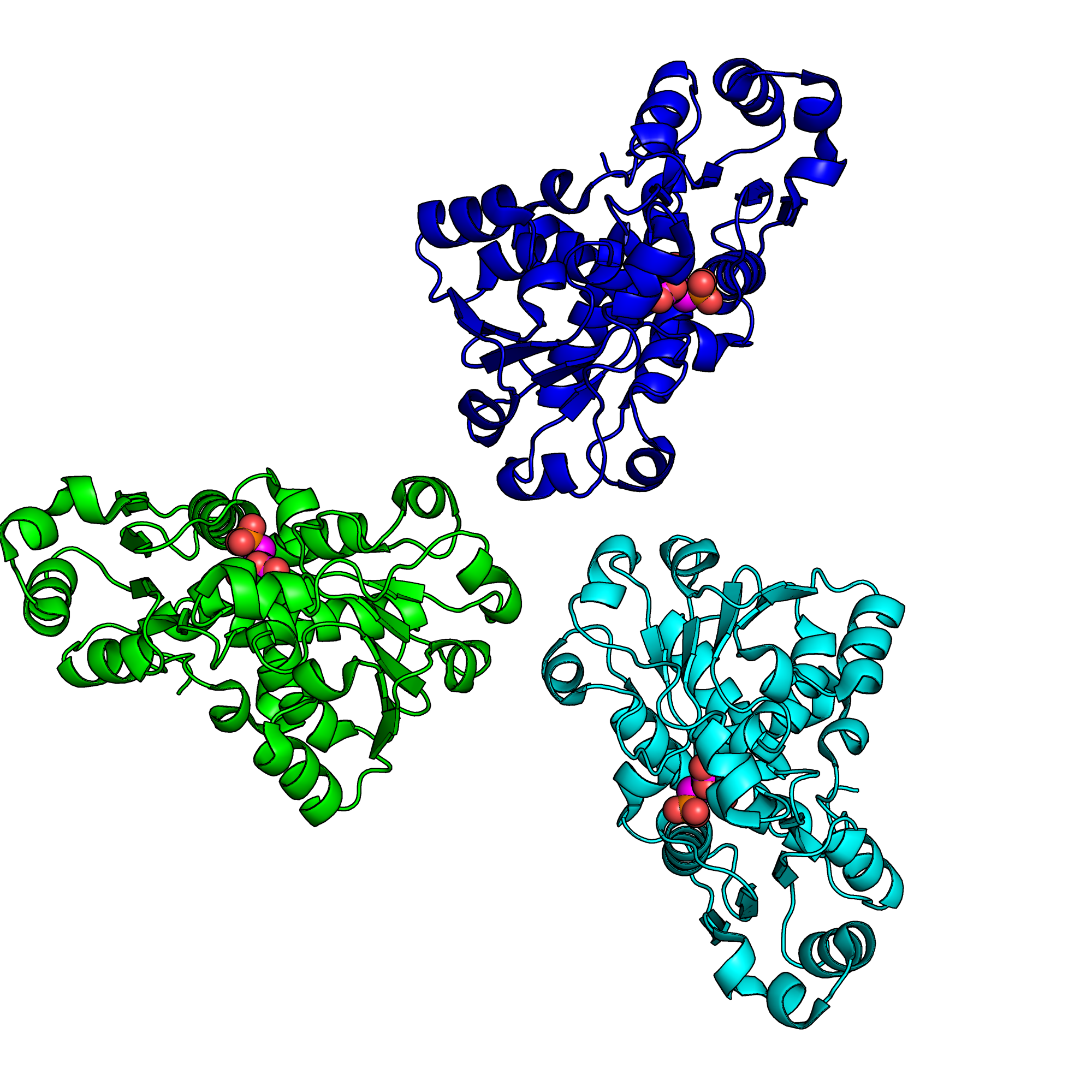
- Биологическая единица — гомотример (три цепи «A») (рис 2.).
- Это белок археи Pyrococcus abyssi (экспрессированный в E. coli).
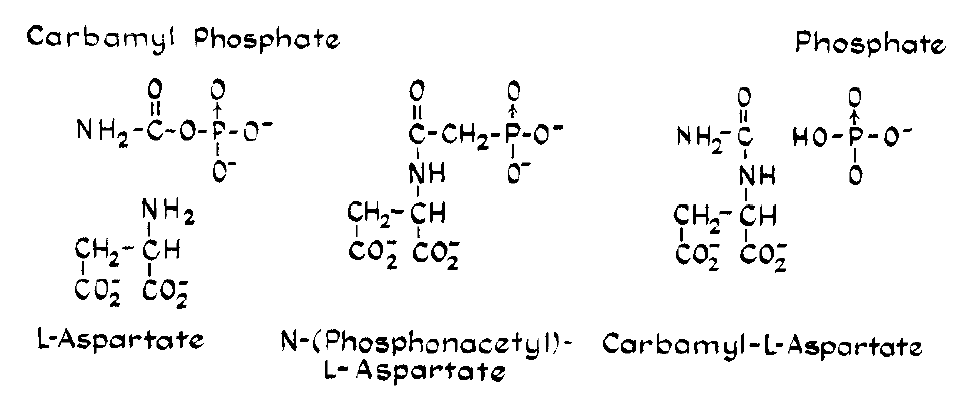
- UniProt ID: P77918; это Aspartate carbamoyltransferase (аспартаткарбомаилтрансфераза), выполняющая каталитическую функцию в реакции: carbamoyl phosphate + L-aspartate = H+ + N-carbamoyl-L-aspartate + phosphate.
- Мутаций нет.
- Модифицированных аминокислотных остатков в цепи нет.
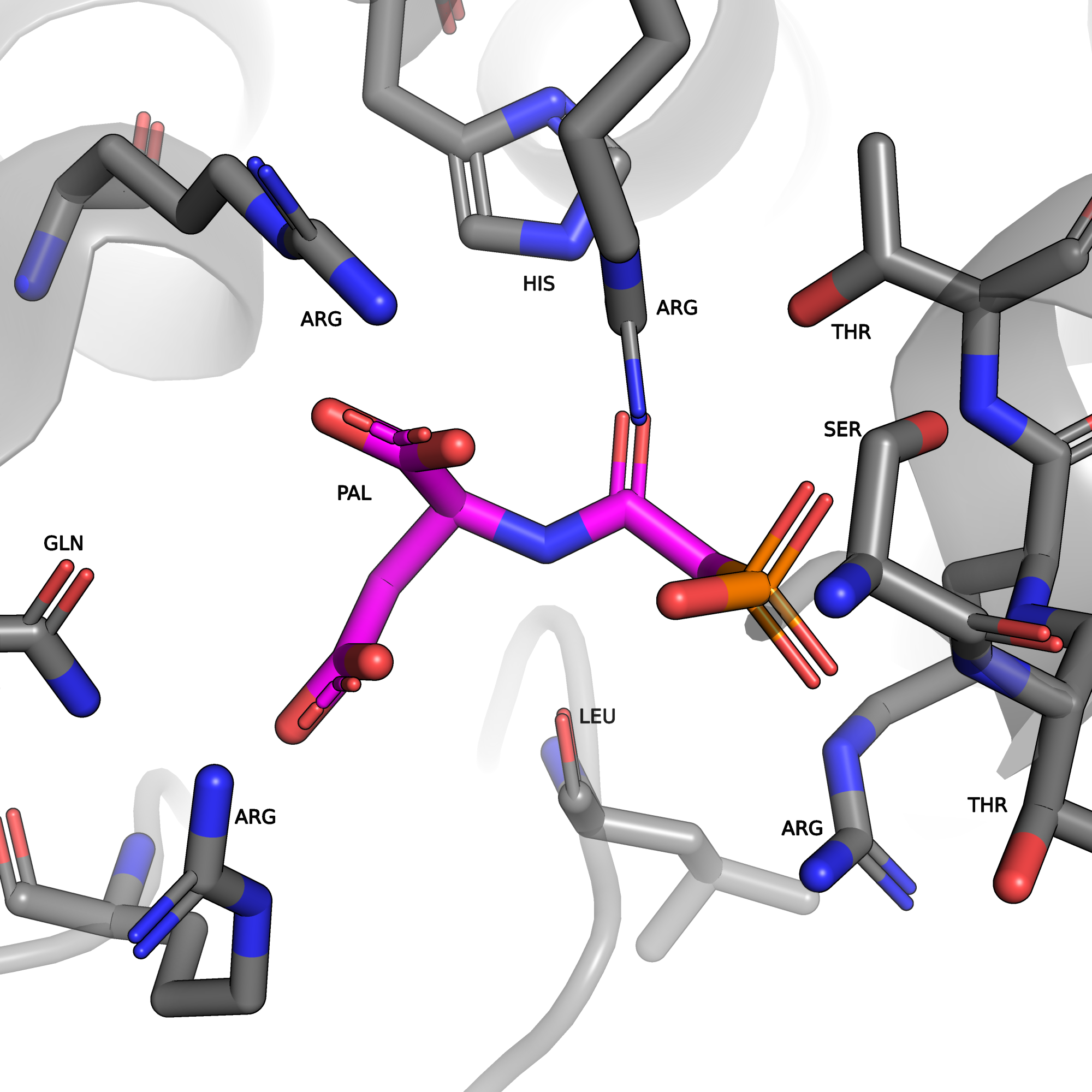
- Малые молекулы, присутствующие в структуре: N-(phosphonacetyl)-L-aspartic acid (PAL) и вода (HOH) (рис. 4).
- Файл, содержащий координаты атомов малых молекул из структуры, находится по ссылке.
- N-(phosphonacetyl)-L-aspartic acid (PALA), с которой связан фермент в этой структуре, не является природным субстратом. Две части молекулы PALA напоминают оба субстрата однвомременно, карбамоилфосфат и L-аспартат (рис. 5). PALA была добавлена, чтобы сымитировать состояние, когда фермент связан с промежуточным продуком катализируемой реакции (Boxtael и др., 2003; Collins, Stark, 1971).
Список литературы
- Van Boxstael, S.; Raymond Cunin, R.; Khan, S.; Maes, D. Aspartate Transcarbamylase from the Hyperthermophilic Archaeon Pyrococcus abyssi: Thermostability and 1.8 Å Resolution Crystal Structure of the Catalytic Subunit Complexed With the Bisubstrate Analogue N-Phosphonacetyl-L-aspartate. J. Mol. Biol. (2003) 326 № 1, 203–216. doi: 10.1016/S0022-2836(02)01228-7
- Collins, D.K.; Stark, G.R. Aspartate Transcarbamylase: Interaction with the Transition State Analogue N-(Phosphonacetyl)-L-aspartate. J. Biol. Chem. (1971) 246 № 21, 6599–6605.