Обзор белка 1YGZ
Вкратце
Кристаллическая форма белка была открыта в 2005 году с помощью метода рентгеновской дифракции научной группой: Wu, C.A., Lokanath, N.K., Kim, D.Y., Park, H.J., Hwang, H.Y., Kim, S.T., Suh, S.W., Kim, K.K. Выделена из Helicobacter pylori 26695.
1YGZ это неорганическая пирофосфатаза (Inorganic Pyrophosphatase). Она катализирует отщеплениие от одного иона пирофосфата двух ионов фосфата:

Пирофосфатаза используется во многих биохимических реакциях, т.к. при отщеплении фосфатной группы выделяется много свободной энергии - 19кДж/моль. Например, она используется в гидролизе липидов, а освободиввшиеся жирные кислоты идут в цикл бета-окисления.
Структура в целом
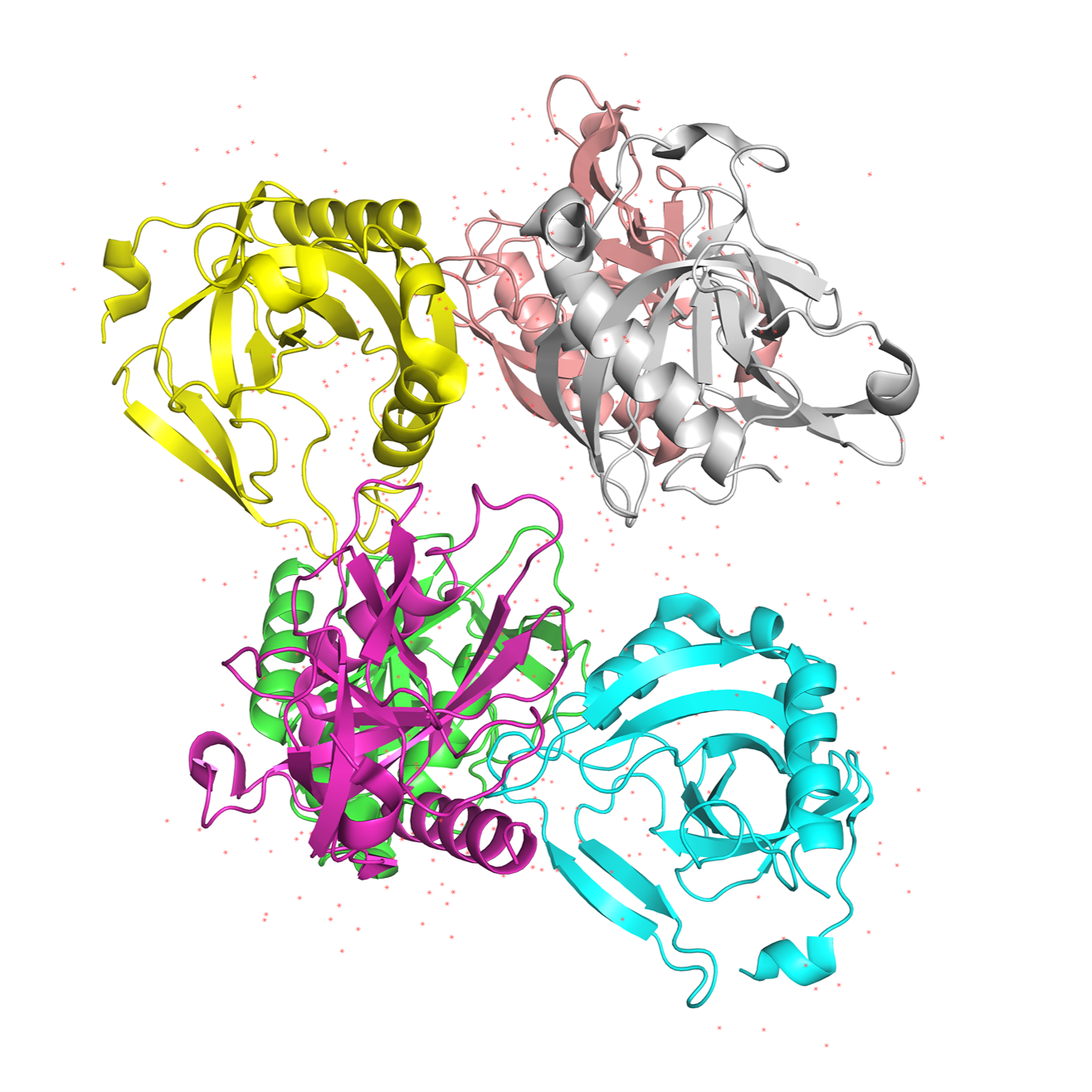
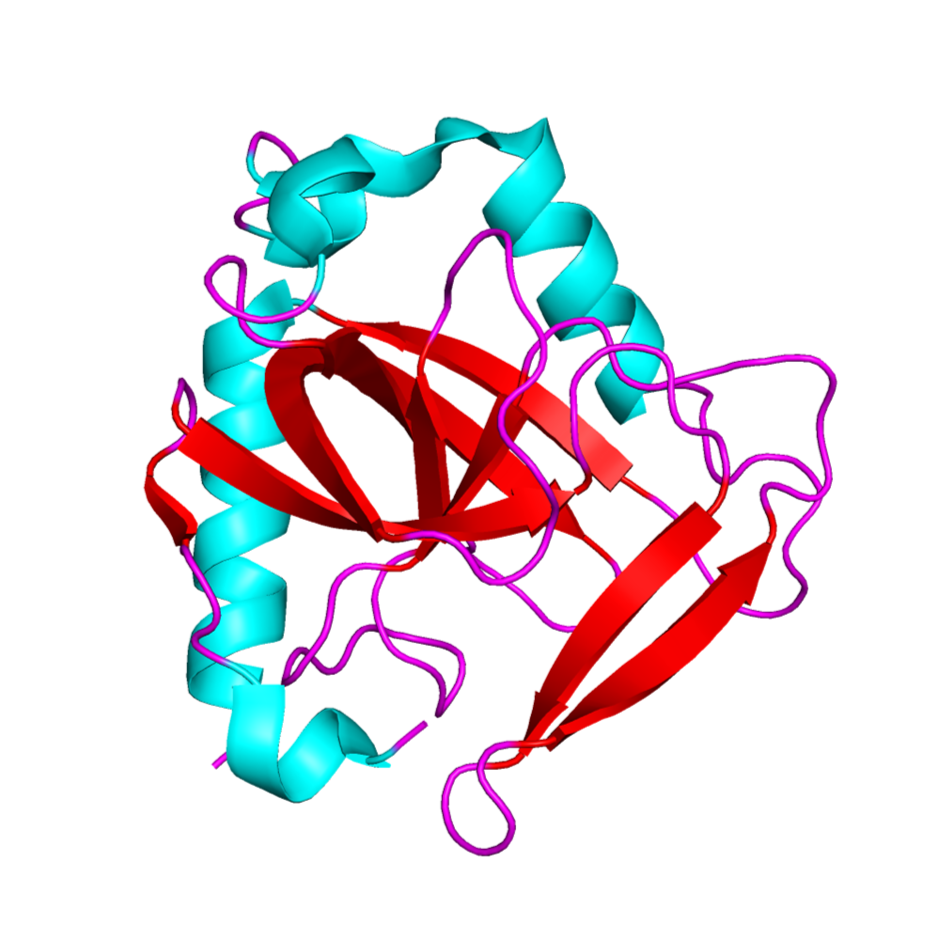
Общий вид молекулы:
Белок состоит из 6 субъединиц: A, B, C, D, E, F. Кристаллографическая асимметричная единица содержит гомогексамерную H-PPase, организованную в виде димера тримеров. То есть молекула собрана из шести (2*3) одинаковых субъединиц характерных для класса пирофосфатаз. В то время как большинство структурных элементов пирофосфатазы (PPases) высококонсервативны, в пирофосфатазе, выделенной из данного штамма H. pylori (H-PPase), некоторые уникальные структурные особенности локализованы в гибких петлях вблизи активного центра, что позволяет предположить, что структурная гибкость этих петель необходима для каталитической эффективности PPase. В правой части белка на рис.2 виден активный центр.
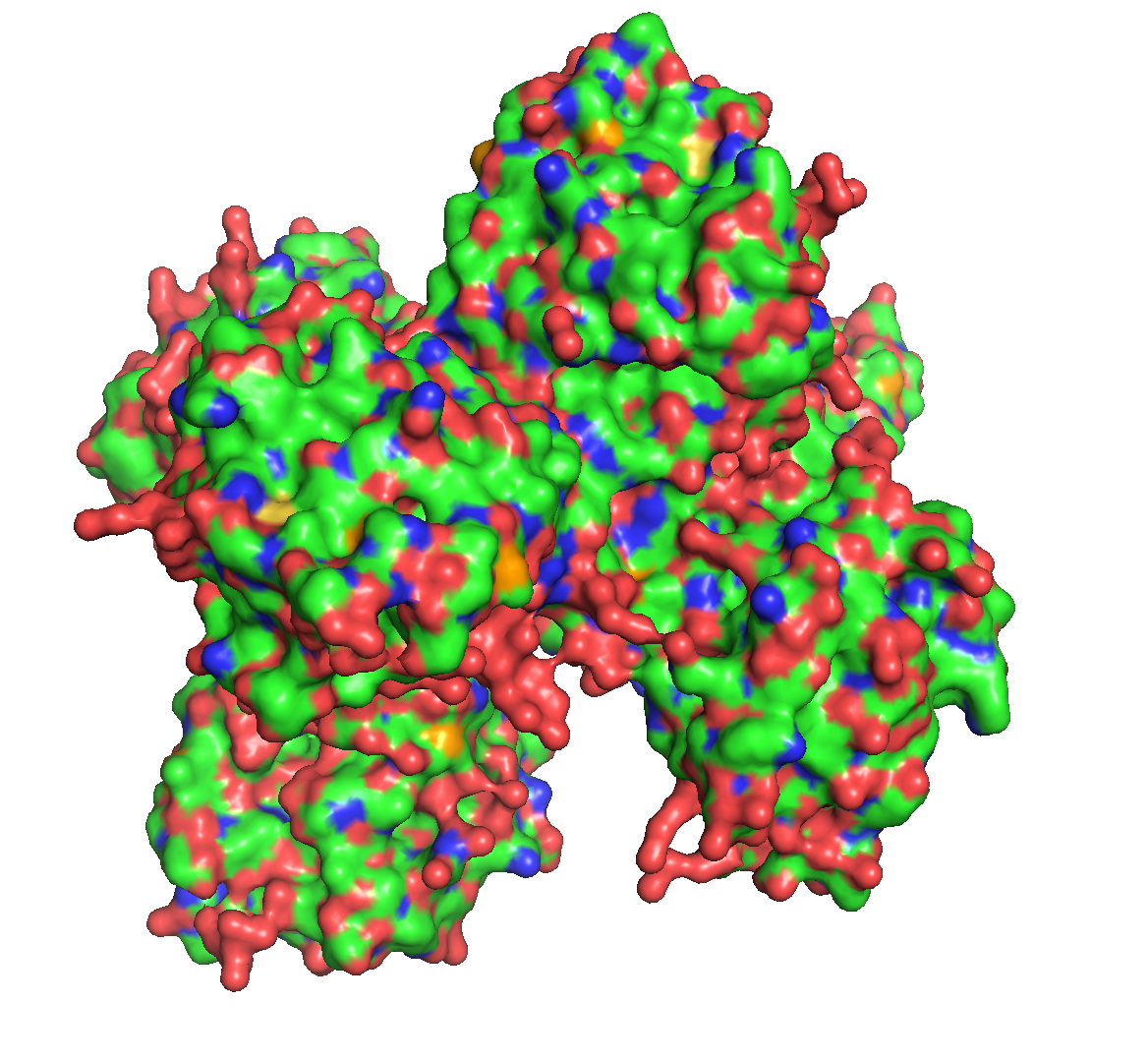
Отдельные цепи
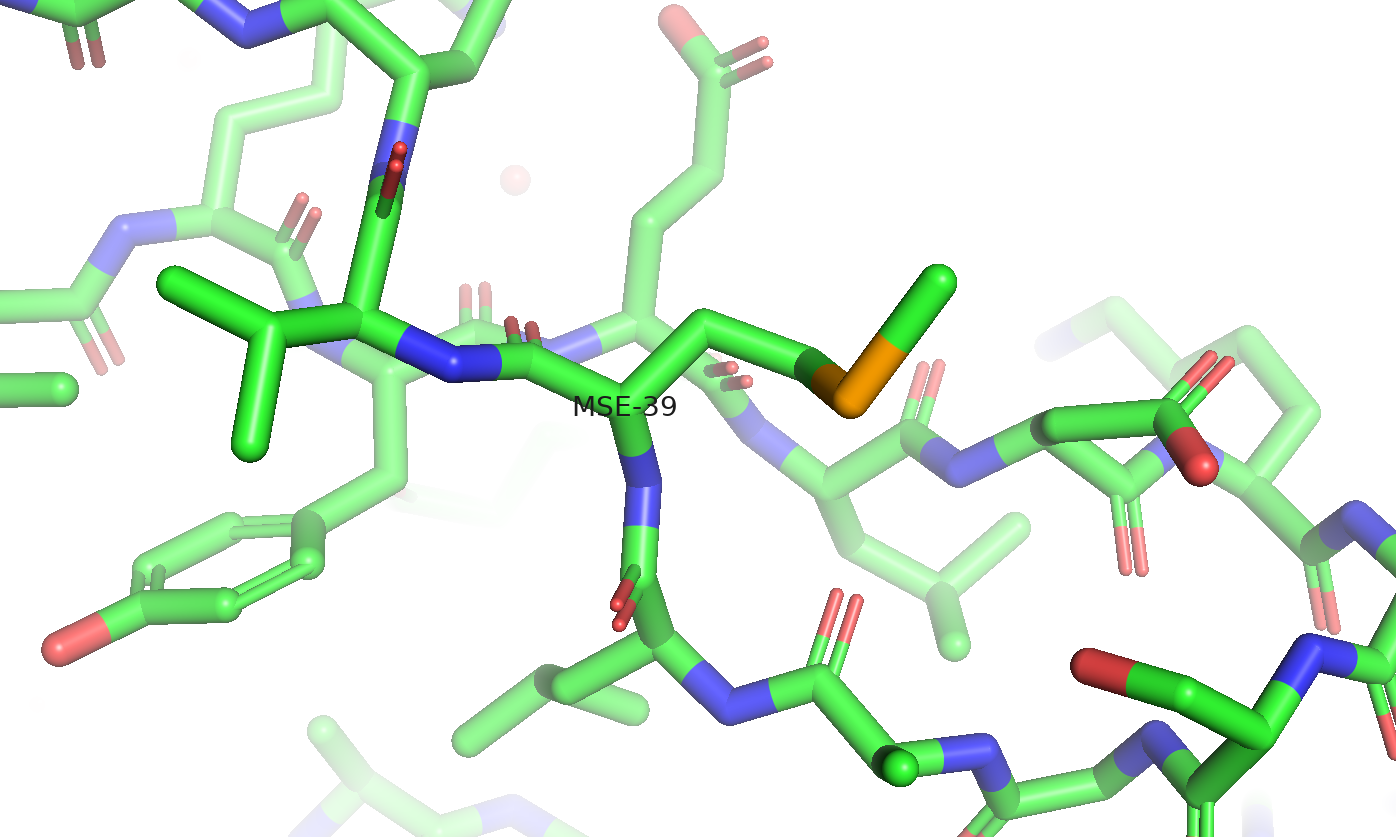
Субъединица состоит из двух альфа-спиралей, а также антипараллельных бета-листов. Есть ещё один небольшой виток спирали, но он завершает только один оборот. Цепь состоит из 173 аминокислот и представляет собой гексамер. Видим, что в цепи присутствуют 4 мутантных остатка - селенометионина (SELENOMETHIONINE). Это метионины, у которых сера заменена на селен. Они располагаются на 1, 39, 94, 100 позициях.
Модифицированные аминокислоты
Водородные связи
Водородные связи между атомами основной цепи: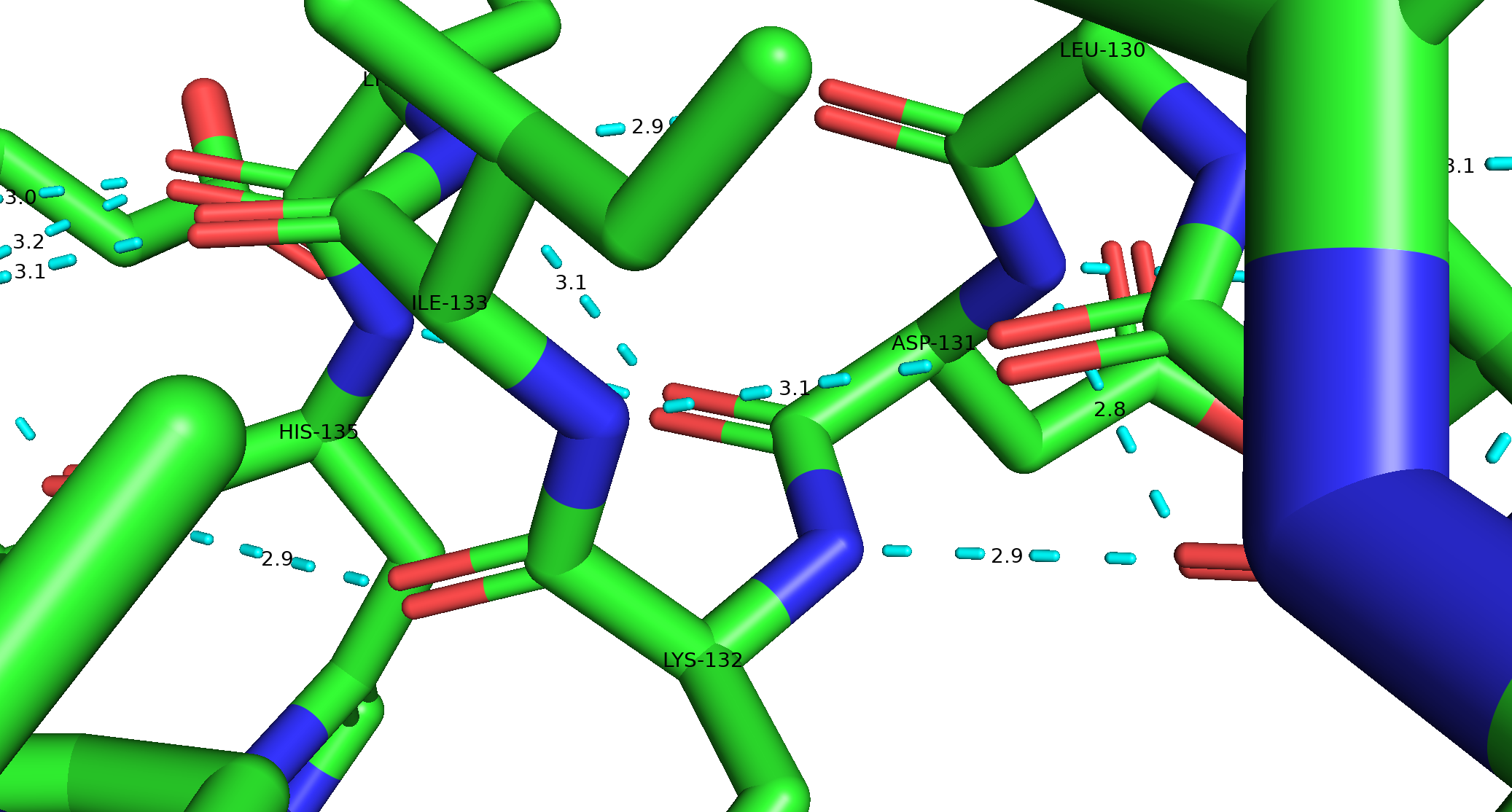

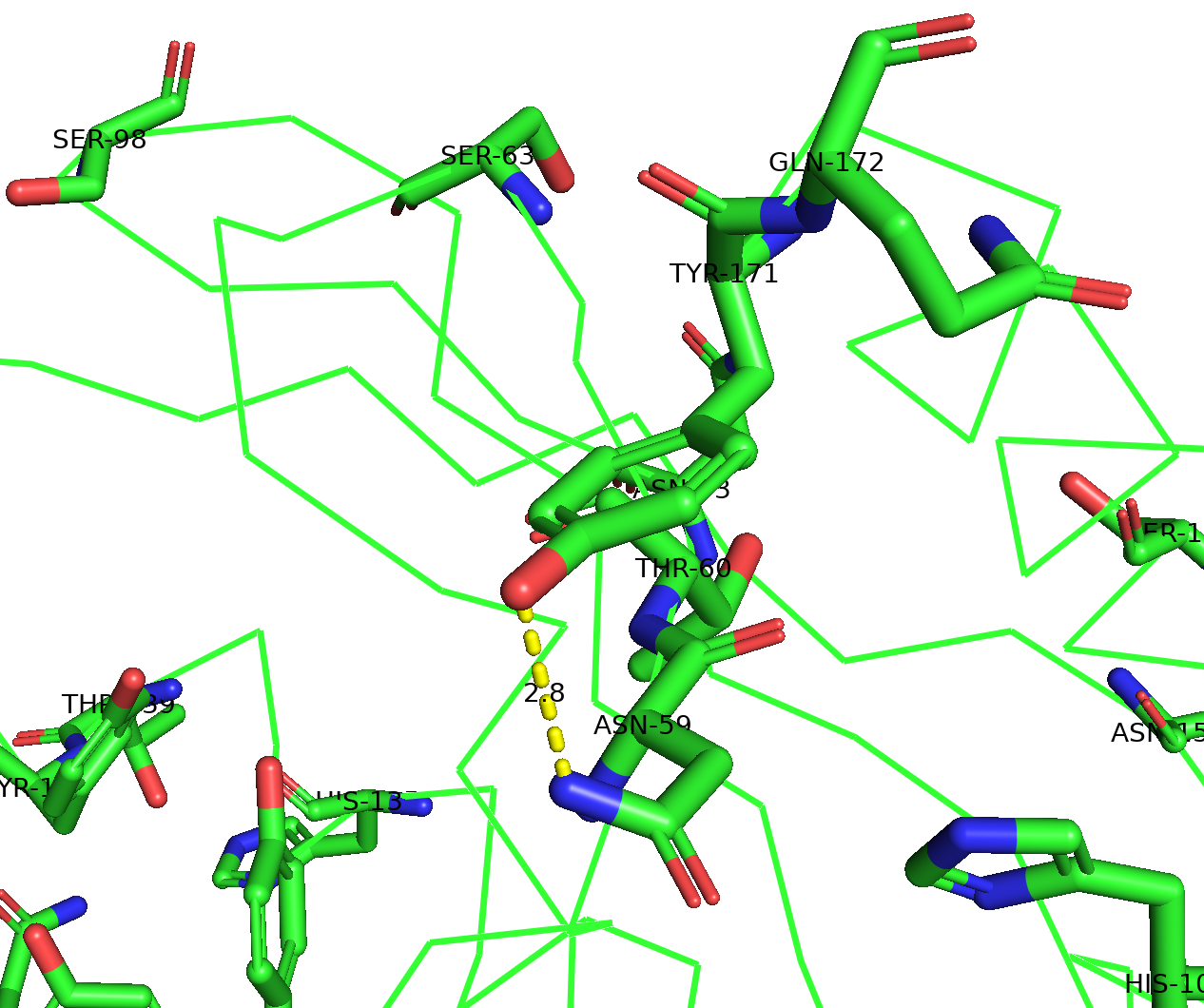
Связи между цепями
Цепи связываются посредством водородных связей между кослородами и водородами главной цепи и радикалами глутаминовой кислоты и гистидина, а также с помощью гидрофобных взаимодействий между ароматическими радикалами.
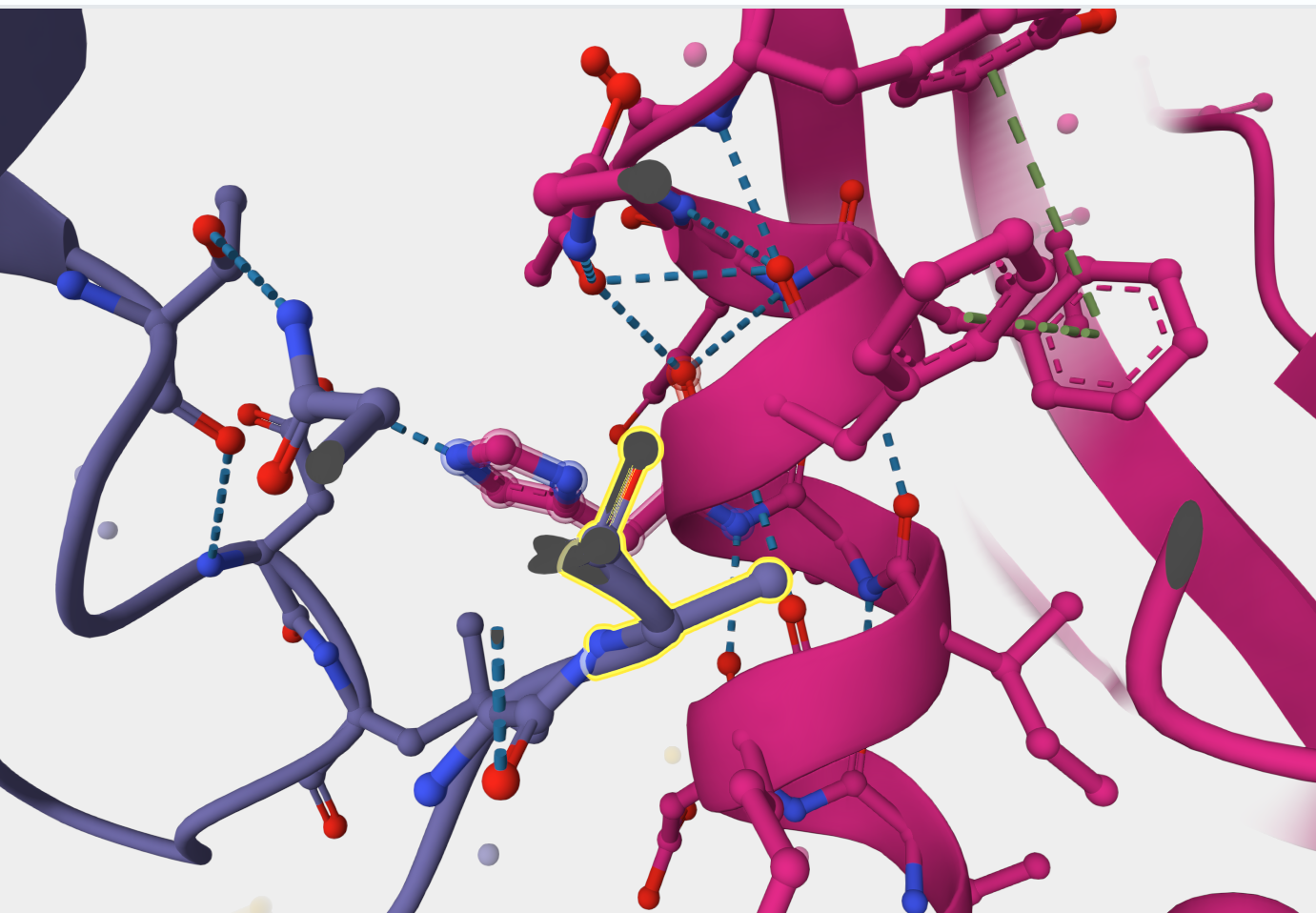
Дисульфидных мостиков обнаружено не было, цистеины разнесены в пространстве друг от друга:

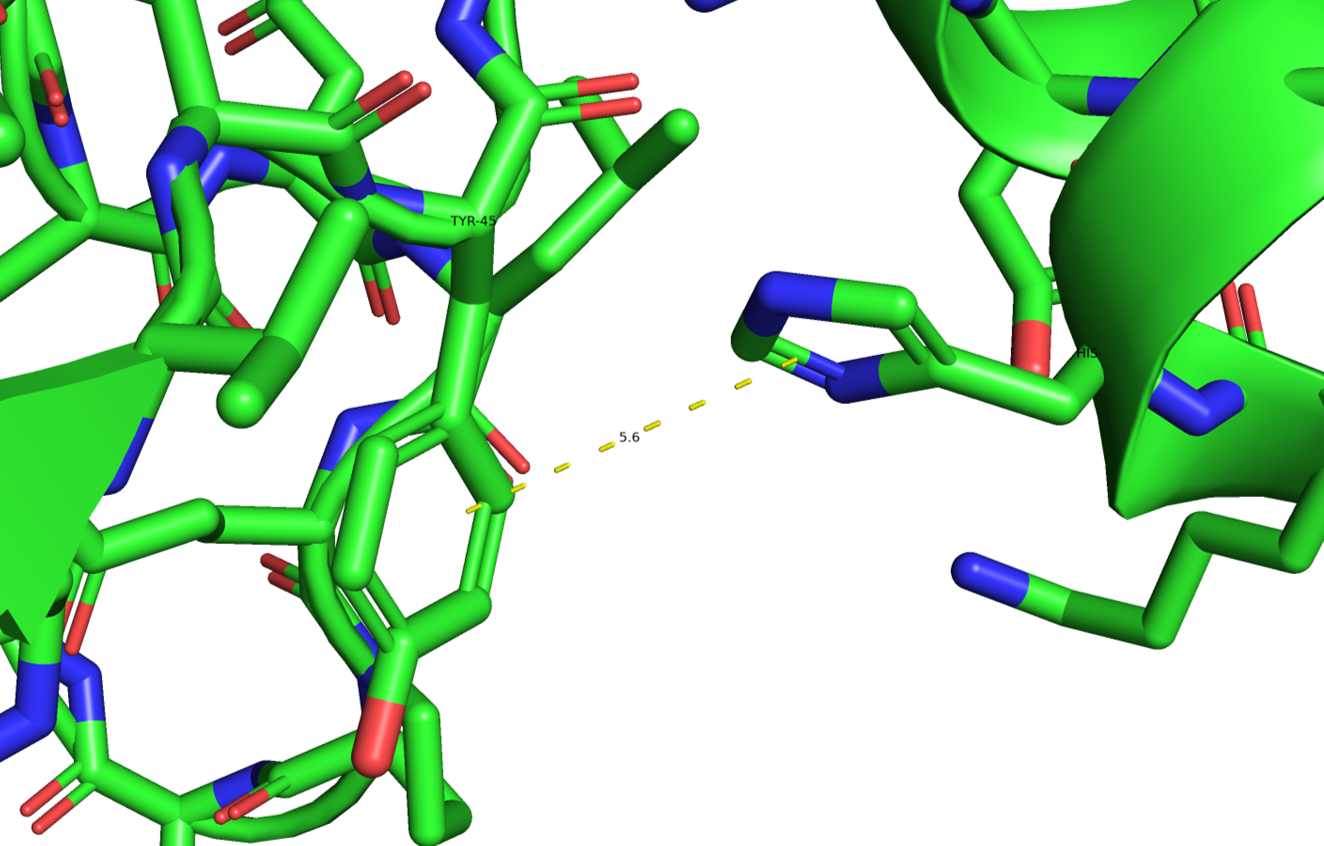
Между цепями есть стеккинговые взаимодействия между ароматическими кольцами (обычно это связи длиной 5-7 ангстрем):
Данные из Uniprot
Uniprot id: P56153
Название белка: Inorganic pyrophosphatase
Функция: Катализирует гидролиз неорганического пирофосфата (PPi) с образованием двух фосфат-ионов.
С полной структурой можно ознакомиться в PDB.
pdb файлМалые молекулы
В каждой из 6 цепей содержится селенометионин (C5H11NO2Se) MSE L-PEPTIDE LINKING (производное Met):