Альтернативные положения, B-фактор, кристалл
Задание 1. Альтернативные положения
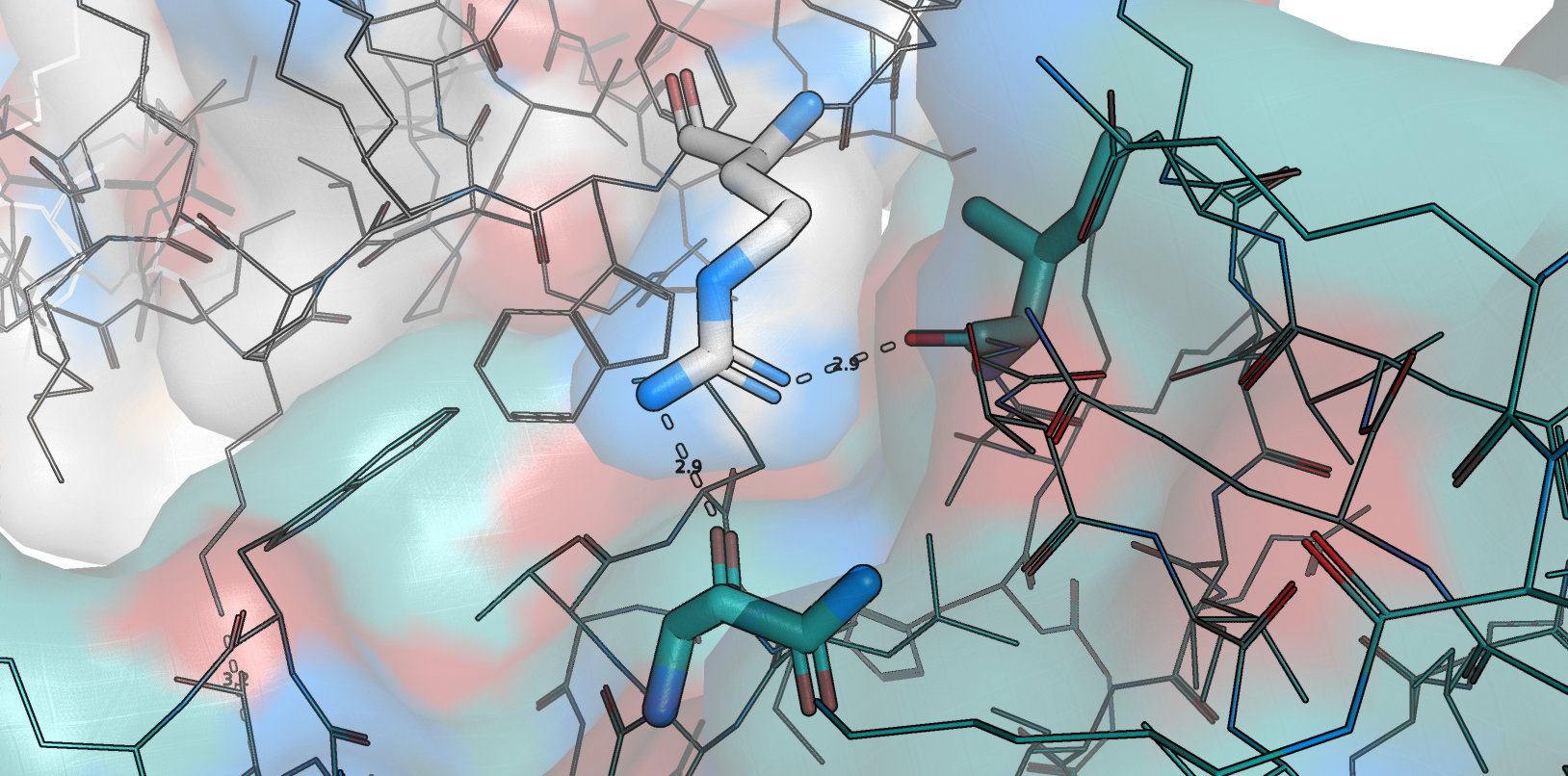
В задании 1 нам было интересно посмотреть, какие взаимодействия стабилизируют тот или иной альтлок заданного остатка (в нашем случае
это Glu134, цепь B структуры 3PWR. Для начала обратим внимание на альтлок А (рис. 1).
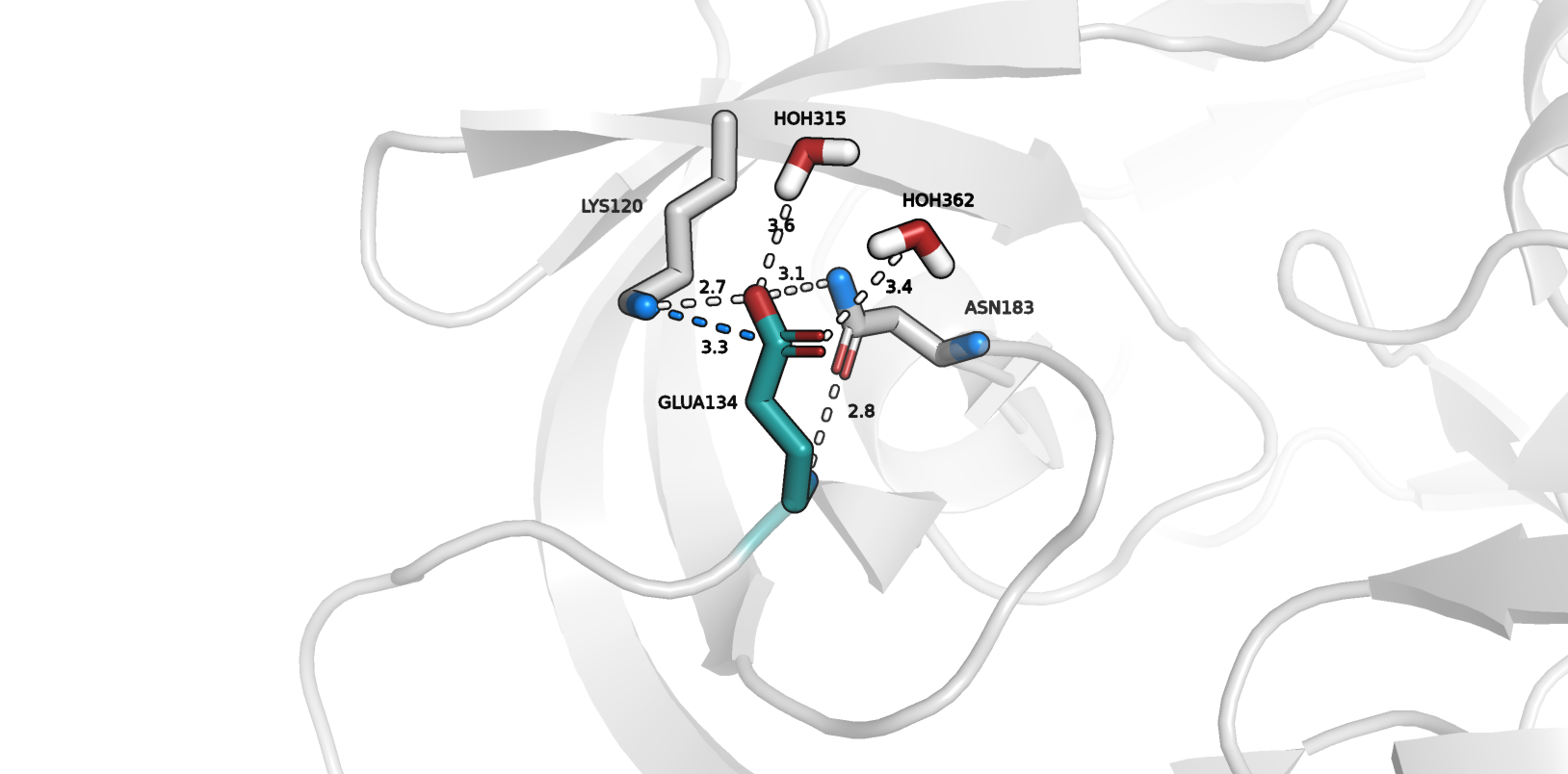
Предполагаю, что он может быть стабилизирован следующими взаимодействиями:
1) солевой мостик с Lys120 (dist=3.3, color="marine")
2) водородная связь с Lys120 (dist=2.7, color="white")
3) водородная связь с HOH315 (dist=3.6, color="white")
4) водородная связь с HOH362 (dist=3.4, color="white")
5) водородная связь с Asn183 (dist=3.1, color="white"); по-видимому, угол O-H-N здесь не представляет собой пример
идеальной геометрии для формирования такого взаимодействия как водородная связь, но в данном случае это значение не кажется критичным
6) водородная связь с Asn183 (dist=2.8, color="white"); данная водородная связь характерна для обоих альтлоков, но я считаю
нужным ее здесь изобразить, так как она, вероятно, вносит вклад в стабилизацию остатка Glu 134
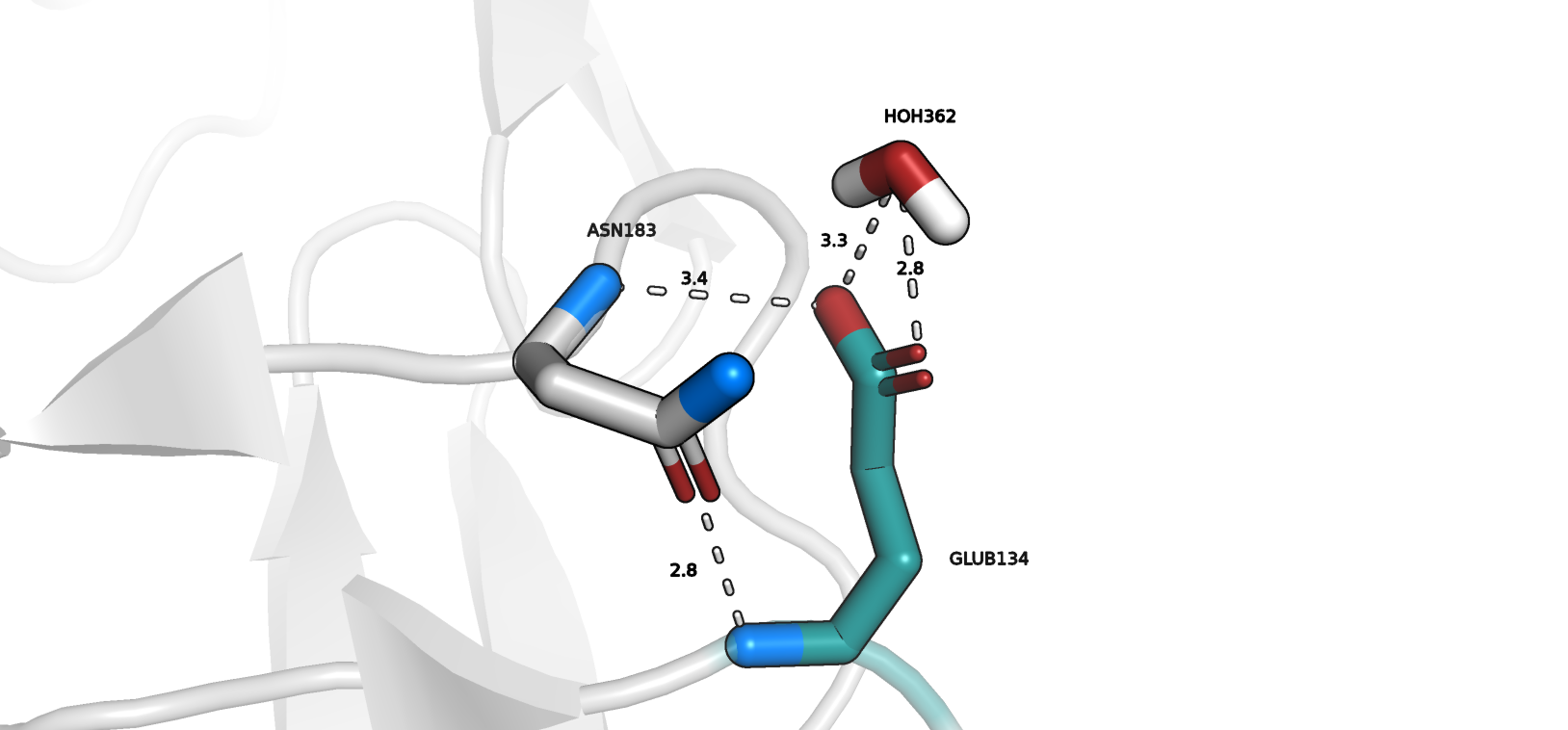
Теперь посмотрим на альтлок 2 интересующего нас остатка (рис. 2). Перечислим "предполагаемые" стабилизирующие взаимодействия:
1) водородная связь с HOH362 (dist=3.3, color="white")
2) водородная связь с HOH362 (dist=2.8, color="white"); хочется отметить, что на рисунках 1 и 2 молекулы могут быть
расположены недостаточно правильно для формирования оптимальных взаимодействий с окружающими их аминокислотными остатками и друг с другом - они были
"сориентированы" вручную после навешивания на кислород кристаллической воды атомов водорода с использованием PyMol (они навешиваются весьма случайным образом)
3) водородная связь с Asn183 (dist=2.8, color="white")
4) водородная связь с Asn183 (dist=3.4, color="white")
Как мы видим, альтлок А стабилизируется 6 взаимодействиями, а альтлок В - 4. Кроме того, альтлок А стабилизируется ионный взаимодействием (Glu134-Lys120), а связь этого типа "сильнее" водородной. Таким образом, мы можем предположить, что альтлок А более стабильный благодаря тому, что он вступает в большее количество взаимодействий. Если мы откроем pdb файл и посмотрим на колонку occupancy, то увидим, что атомы альтлока А имеют значение occupancy 0.7, а альтлока В - 0.3, что вполне соответствует нашим предположениям. На уровне кристалла это число может быть соотнесено с долей ячеек кристалла с таким положением этого атома. Так, мы предполагаем, что атомы альтлока А встречаются в большем % ячеек (чаще) и, по-видимому, он действительно более стабильный.
Задание 2. B-фактор
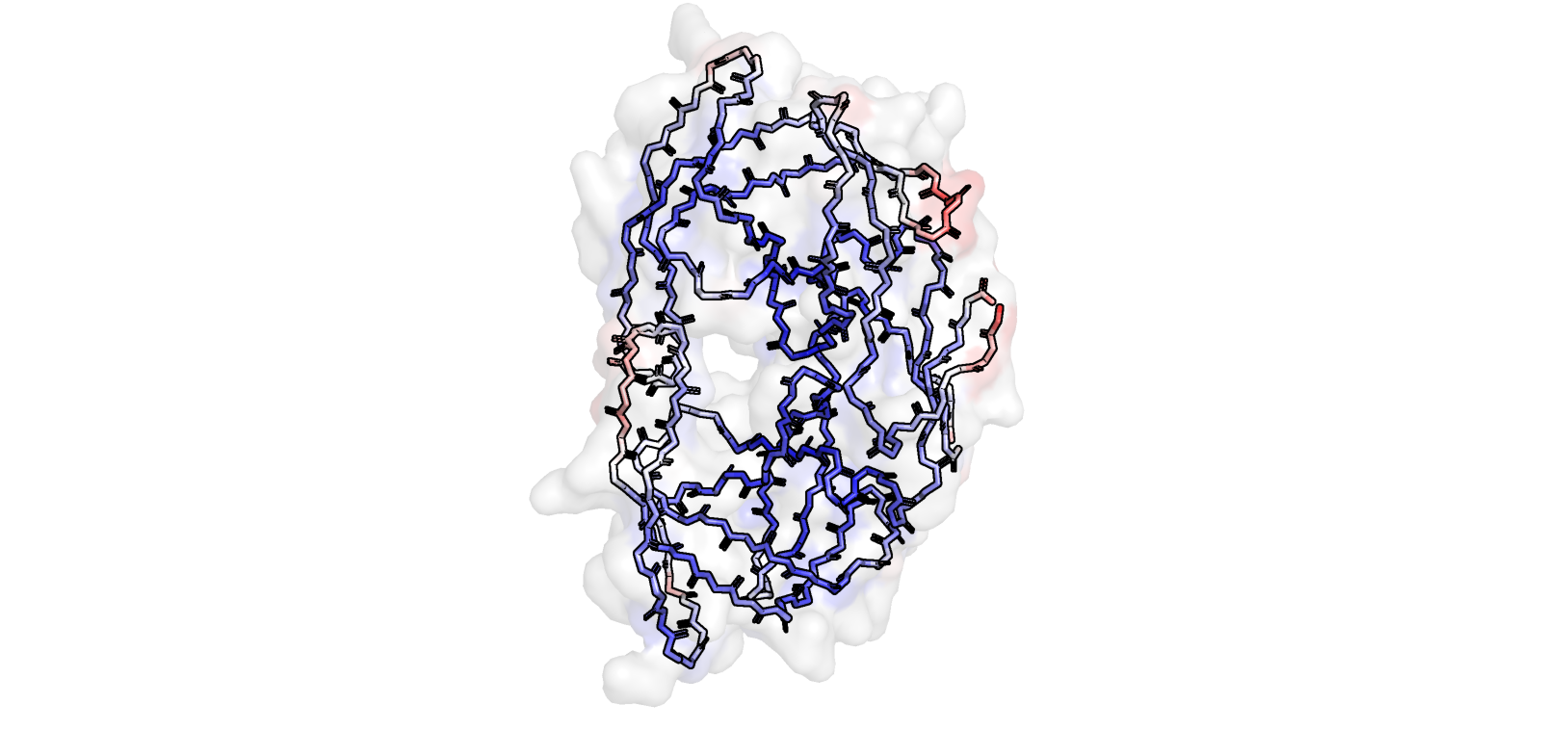
В грубом обосновании, В-фактор характеризует подвижность атома (мы с некоторой точностью указываем на одно его определенное положение). Чем больше значение В-фактора, тем более красный остаток (при использовании нашей цветовой палетки), тем более он подвижный (в рассматриваемом нами приближении). В нашей структуре, остов которой покрашен по значению В-фактора (рис. 3), более "тепло-окрашенные" остатки расположены ближе к поверхности белковой глобулы (поверхность показана почти прозрачной на том же рис. 3). Более высокое значение В-фактора у таких остатков вполне обоснованно - они, будучи обращенными в раствор, более подвижны, так как не связаны взаимодействиями со своими аминокислотными соседями (тем не менее, они могут взаимодействовать с молекулами растворителя).
На рис. 4 представлен остаток Arg41, который имеет достаточно высокое значение В-фактора, и, по-видимому, достаточно подвижен. В таком случае мы предполагаем достаточно плохое покрытие подвижного радикала рассматриваемого нами аминокислотного остатка, в особенности при высоких значениях уровня подрезки. При рассмотрении нескольких уровней подрезки (1, 2 и 3) мы видим, что "концевые" части радикала аргинина (те, что окрашены в более красные оттенки) особенно плохо покрыты ЭП при высоких значениях уровня подрезки. При уменьшении значения уровня подрезки покрытие ЭП "распространяется" от остова - к радикалу (как и градиент окраски по В-фактору). То-есть, чем подвижнее остаток, тем меньшее количество времени электронная плотность его атомов локализована в каком-то определенном положении и тем меньшее значение уровня подрезки (значение z-score) нам нужно, чтобы увидеть хоть какое-то его покрытие (если оно, конечно, вообще существует в рассматриваемой человеком структуре).
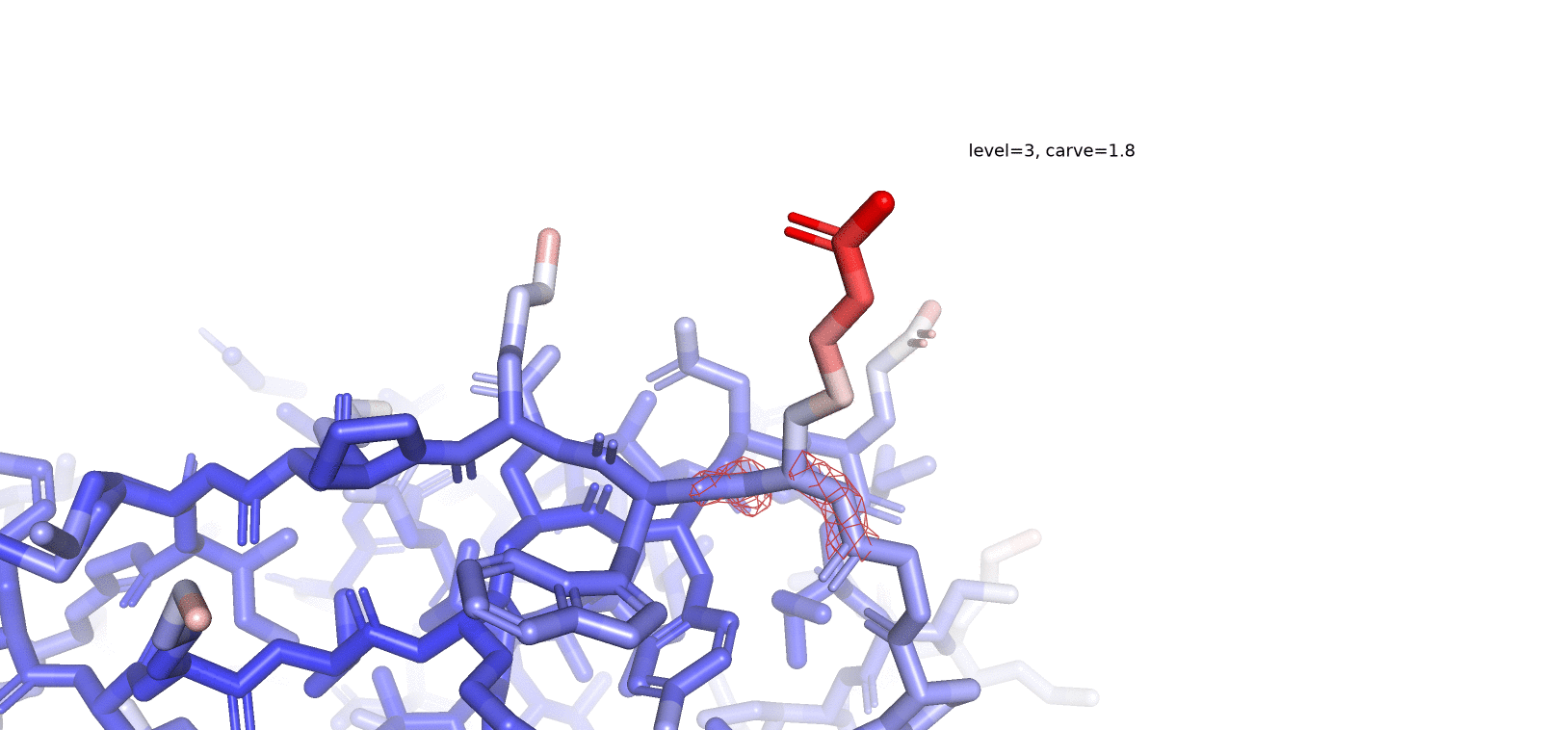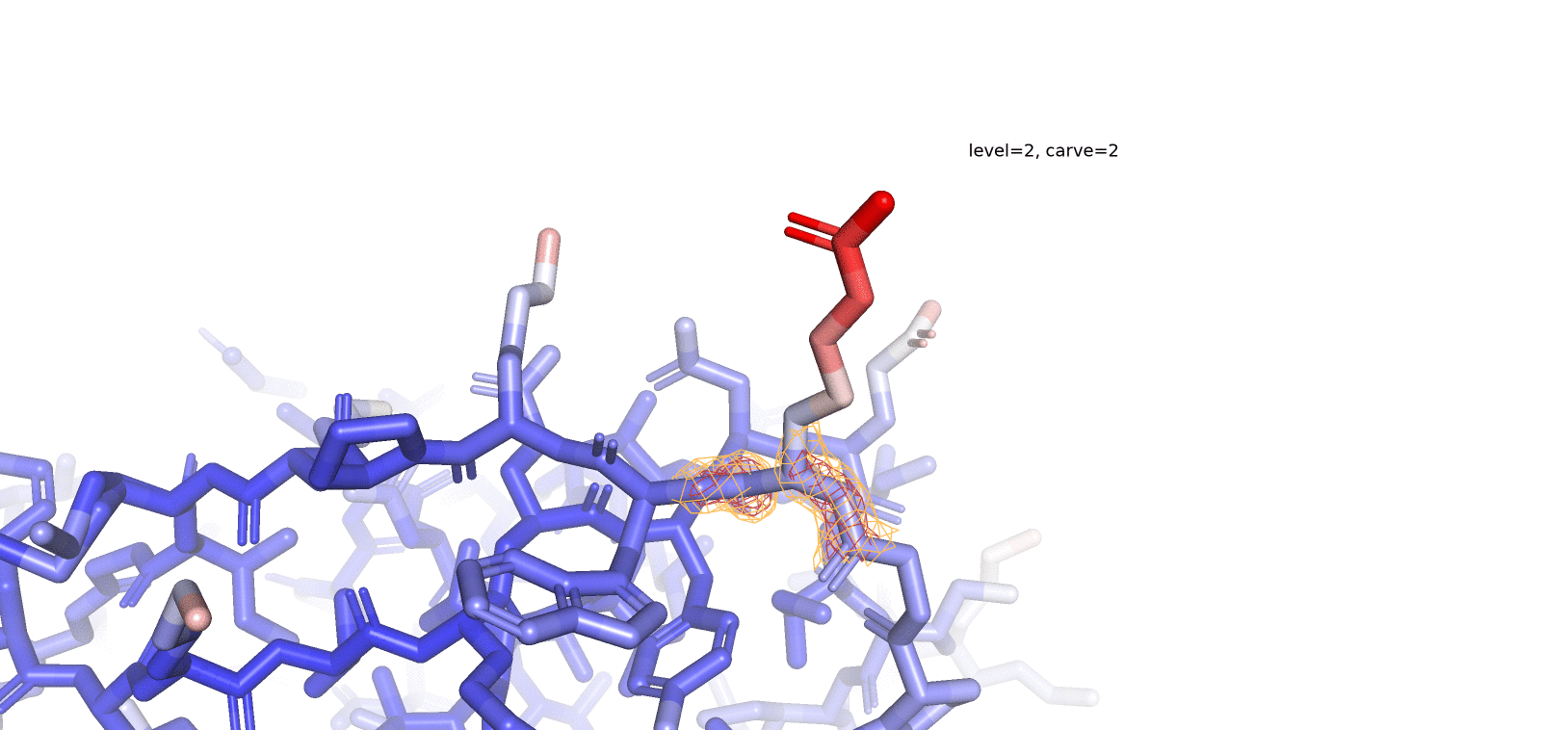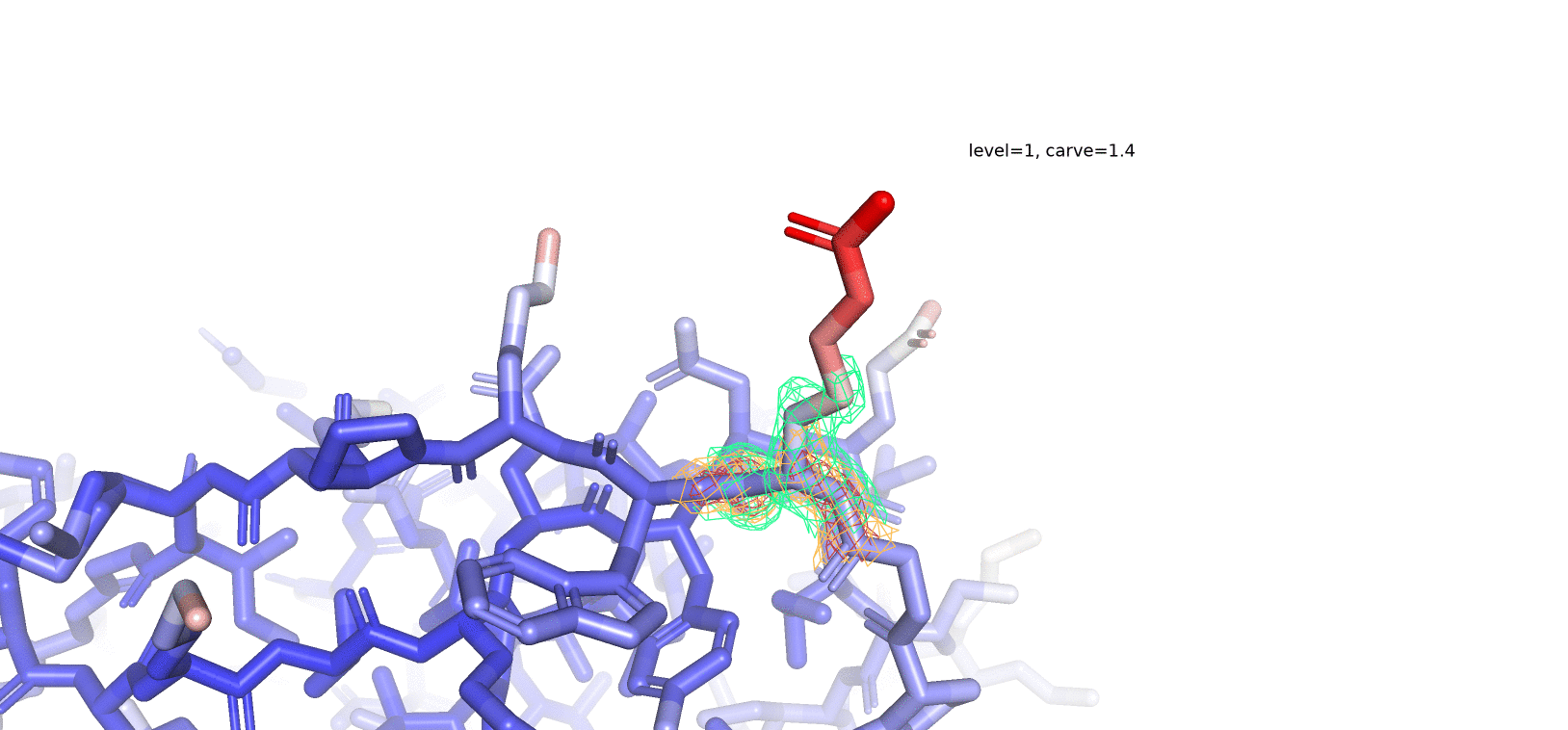
Задание 3. Соседи
Молекулы в восстановленном с помощью инструментария PyMol кристалле имеют упорядоченную, регулярную структуру (рис. 5).
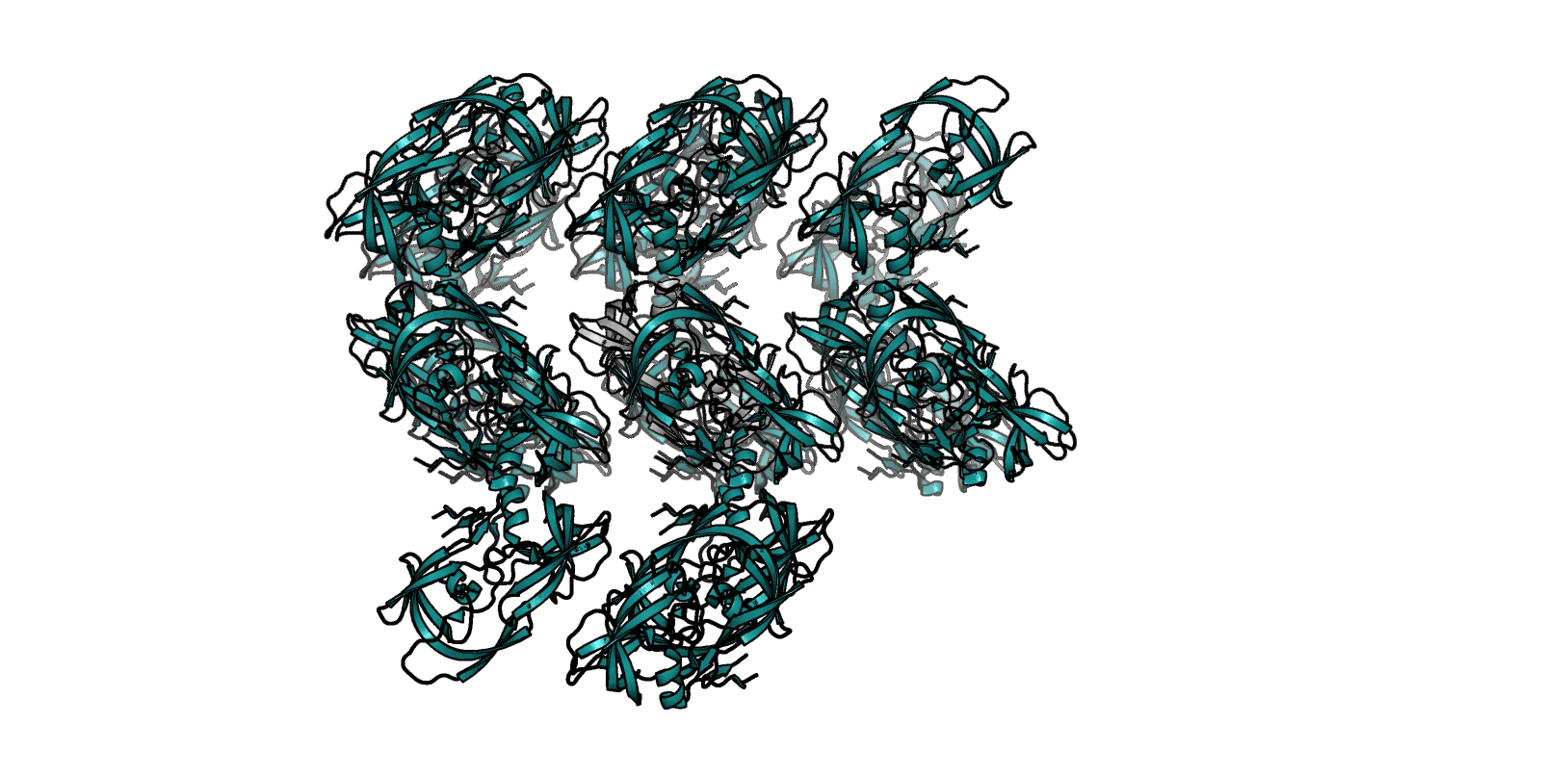
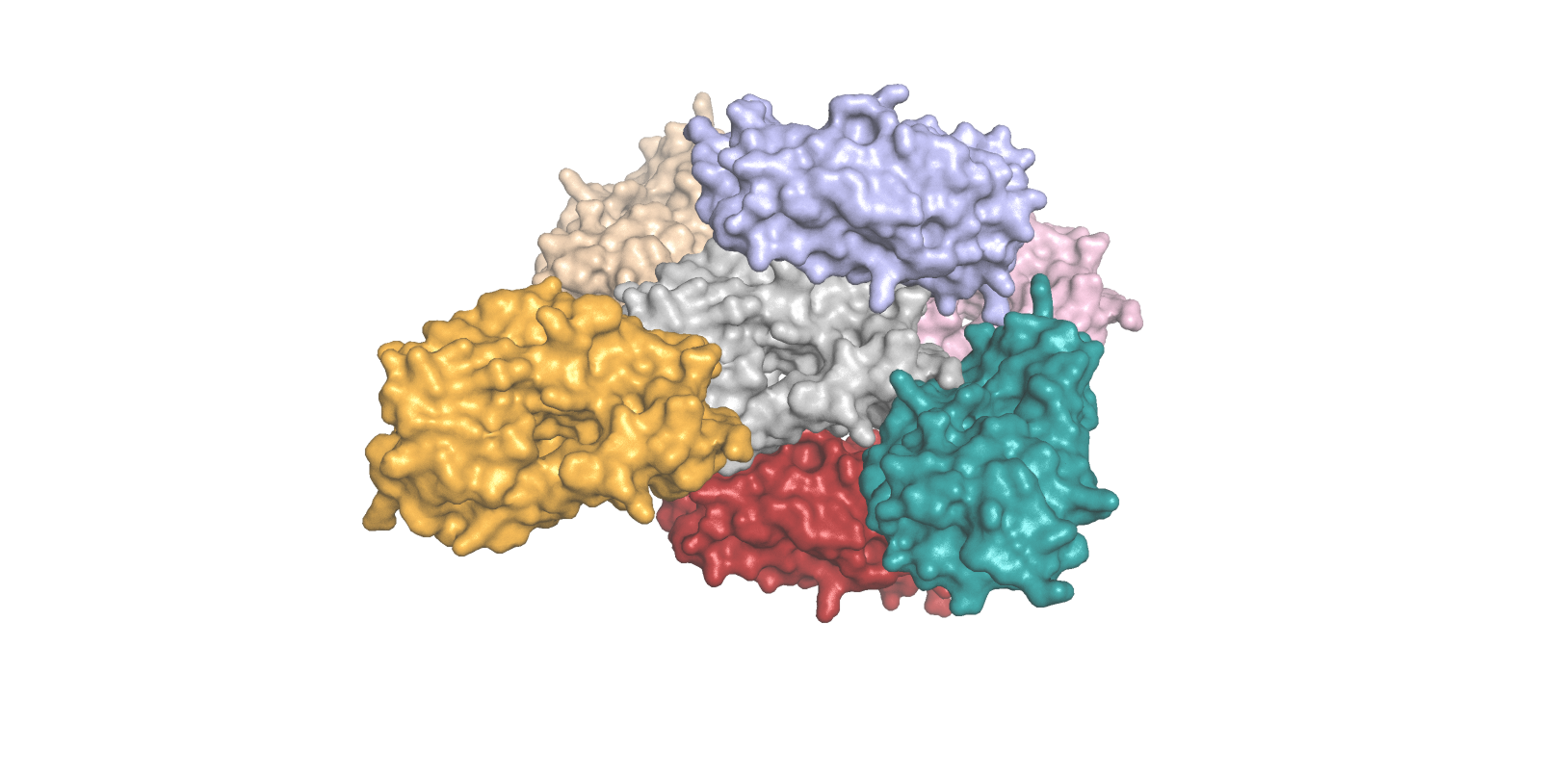
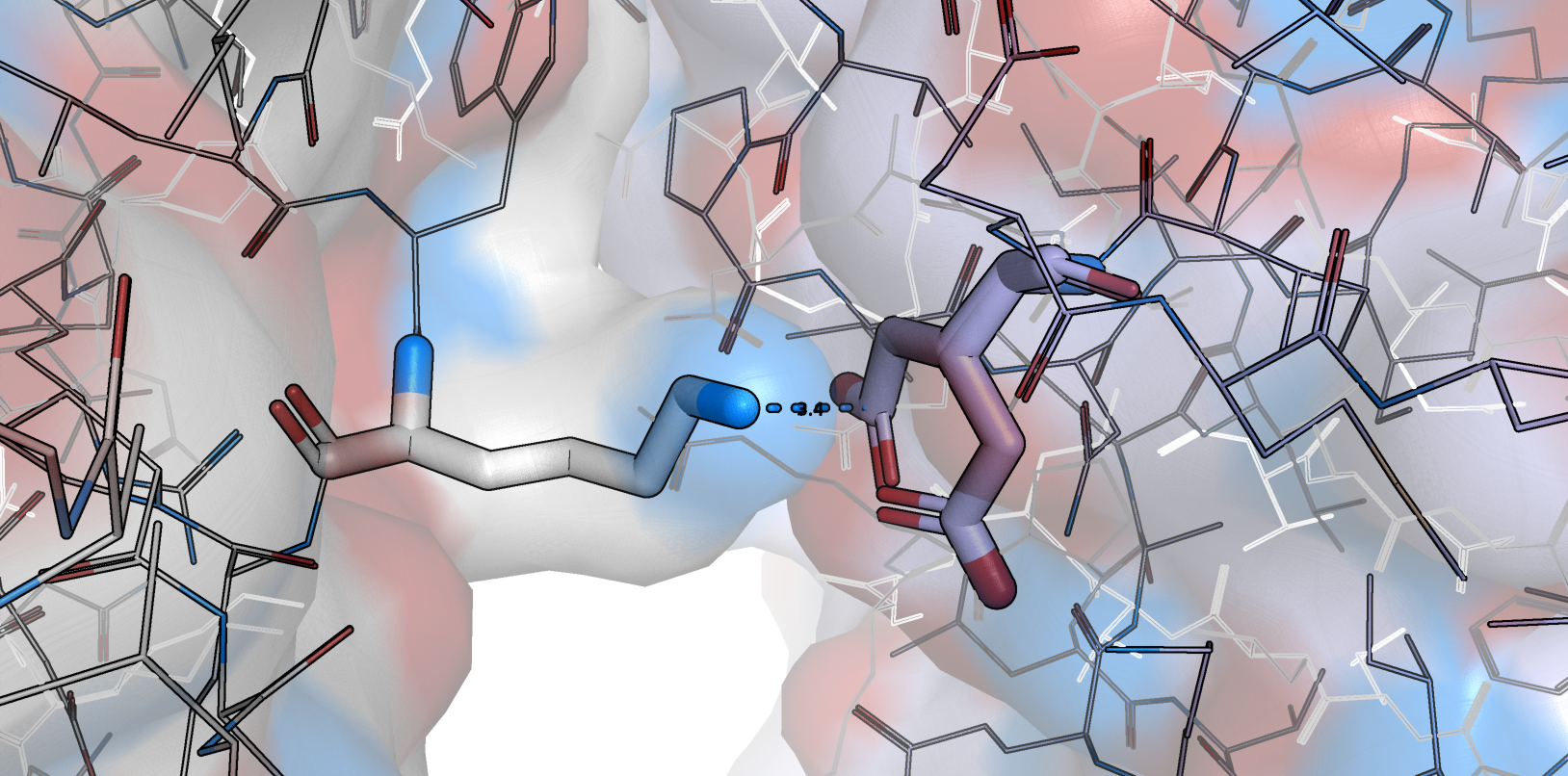
Приведем примеры зон контакта. Одна из показавшихся примечательной - солевой мостик между Lys7 (цепь А) и Glu134 (цепь В - как раз тот, что обсуждался в задании 1, с альтлоками) - представлена на рис. 6.
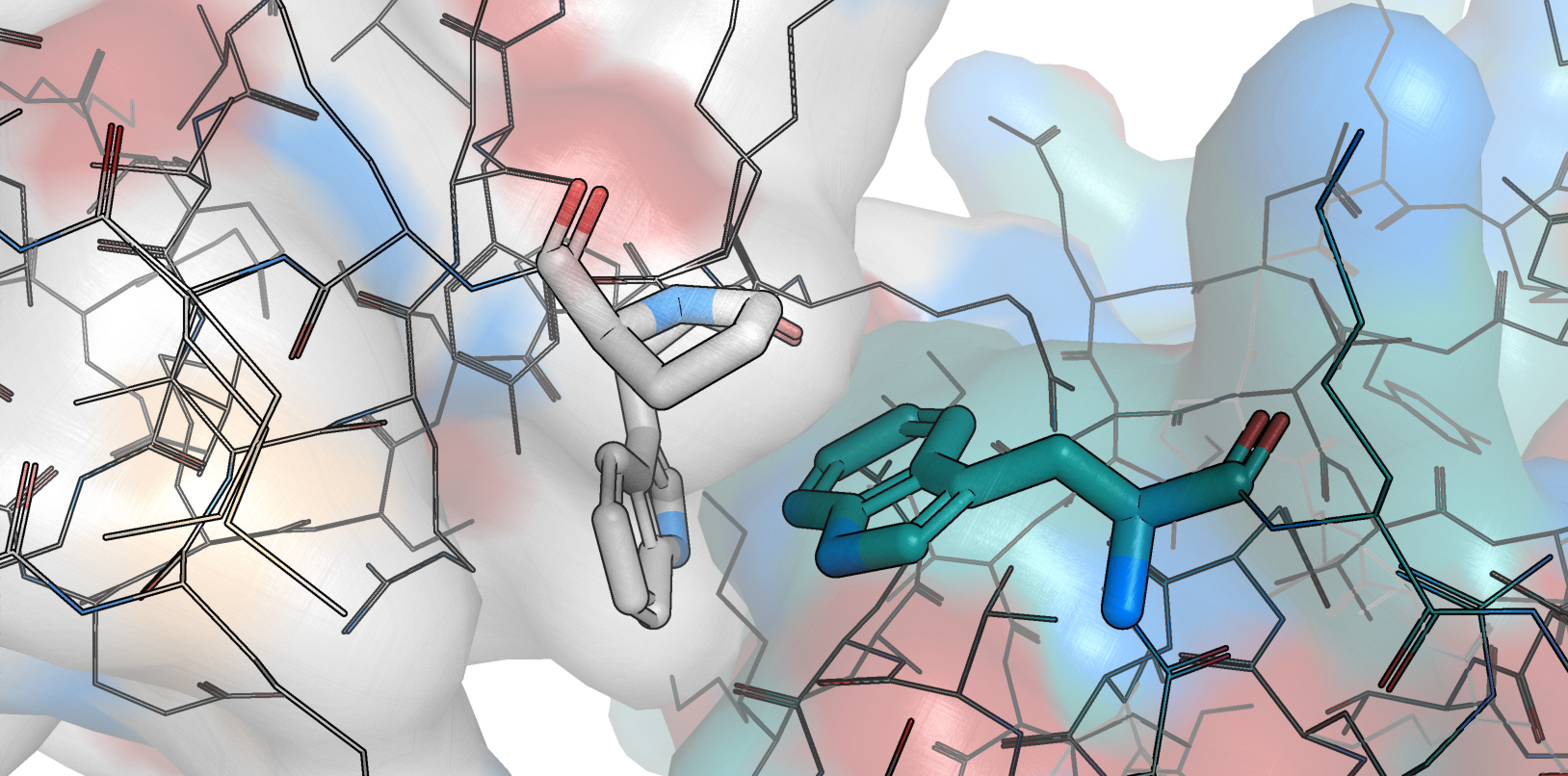
Также показалось интересным гидрофобное взаимодействие крупных боковых радикалов двух триптофанов (Trp106, Trp142) и одного пролина (Pro144, рис. 8).
Можно увидеть различные примеры водородных связей, способствующих взаимной стабилизации белковых глобул друг относительно друга. Одним из примеров является взаимодействие Arg141 (в составе исходного белка) - Ile72, Asn88 (в составе соседней белковой молекулы, "deepteal-сосед", рис. 9).