Python для структур и не только
Задание 1. Вводное
PDB-коды: 2KFB (ЯМР), 4JGF (РСА)
Название белка: Гамма-кристаллин D
Разрешение РСА: 2.50 Å
Число моделей ЯМР: 20
Прежде всего попробуем сопоставить все ЯМР-структуры (gray80, 20 штук) с той, что была получена посредством РСА (deepteal), рис. 1. Как мы видим, сопоставление достаточно хорошее, элементы вторичной структуры соответствуют друг другу по форме и ориентации в пространстве (можно заметить, что есть некоторые отклонения в расположении петлевых участков). Примечание: при подготовке рисунка 1 из структуры 4JGF была удалена цепь В и вода.
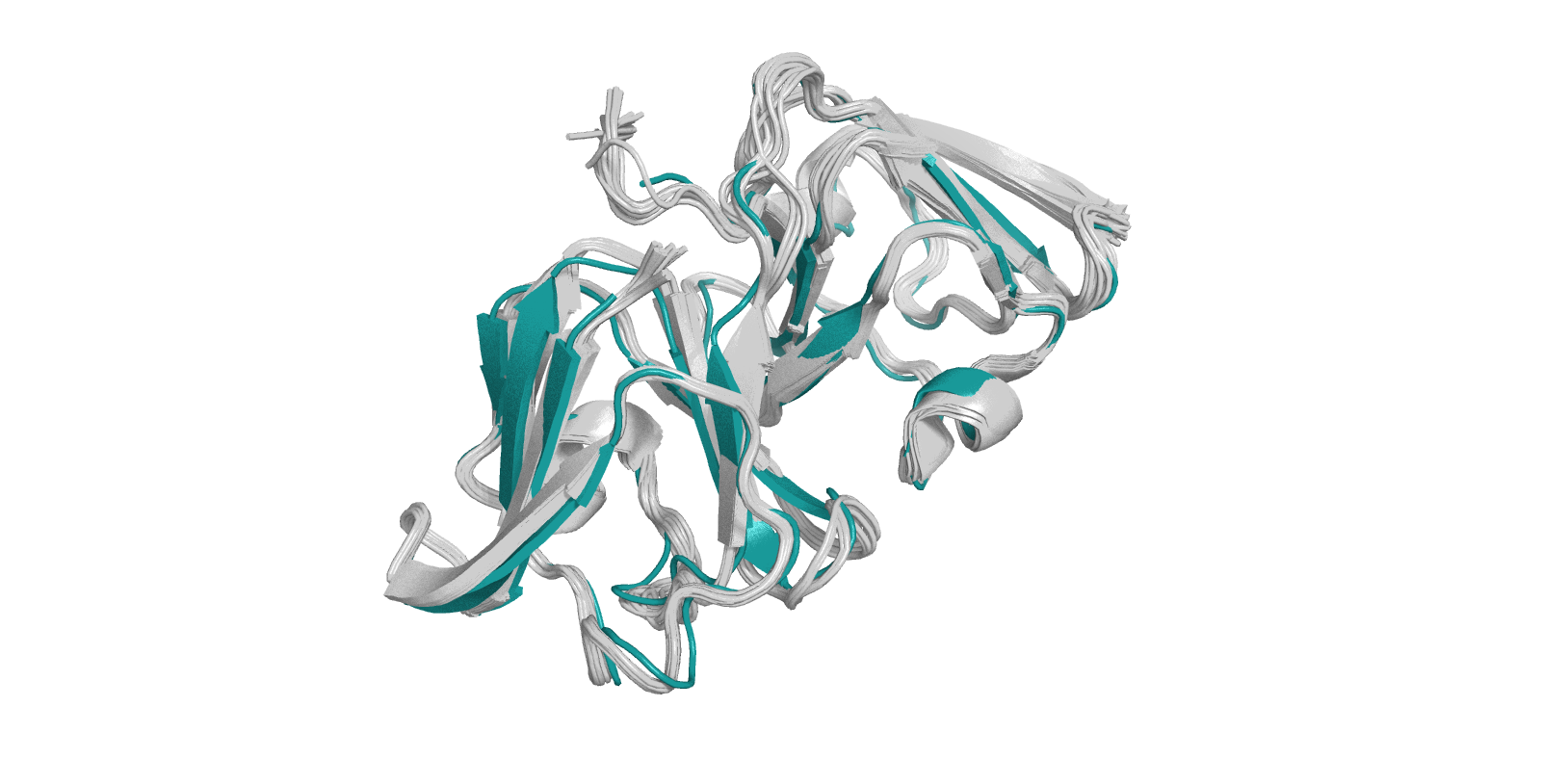
На первый взгляд кажется, что все хорошо. Рассмотрим некоторые различия рассматриваемых нами объектов на макро- и микро-уровне.
Отметим, что в структуре, полученной методом РСА присутствует кристаллическая вода (пусть даже и в небольшом количестве) и две цепи
гамма-кристаллина D (рис. 2), между которыми можно найти межмолекулярные взаимодействия. Также хочется отметить, что в структуре, полученной
посредством РСА нет водородов (разрешение недостаточно хорошее). Также в структуре РСА присутствует альтлок, который мы более подробно рассмотрим ниже
(в структуре, полученной методом ЯМР для данного остатка мы просто увидим набор расположений, характерных для каждой отдельной конформации семейства).
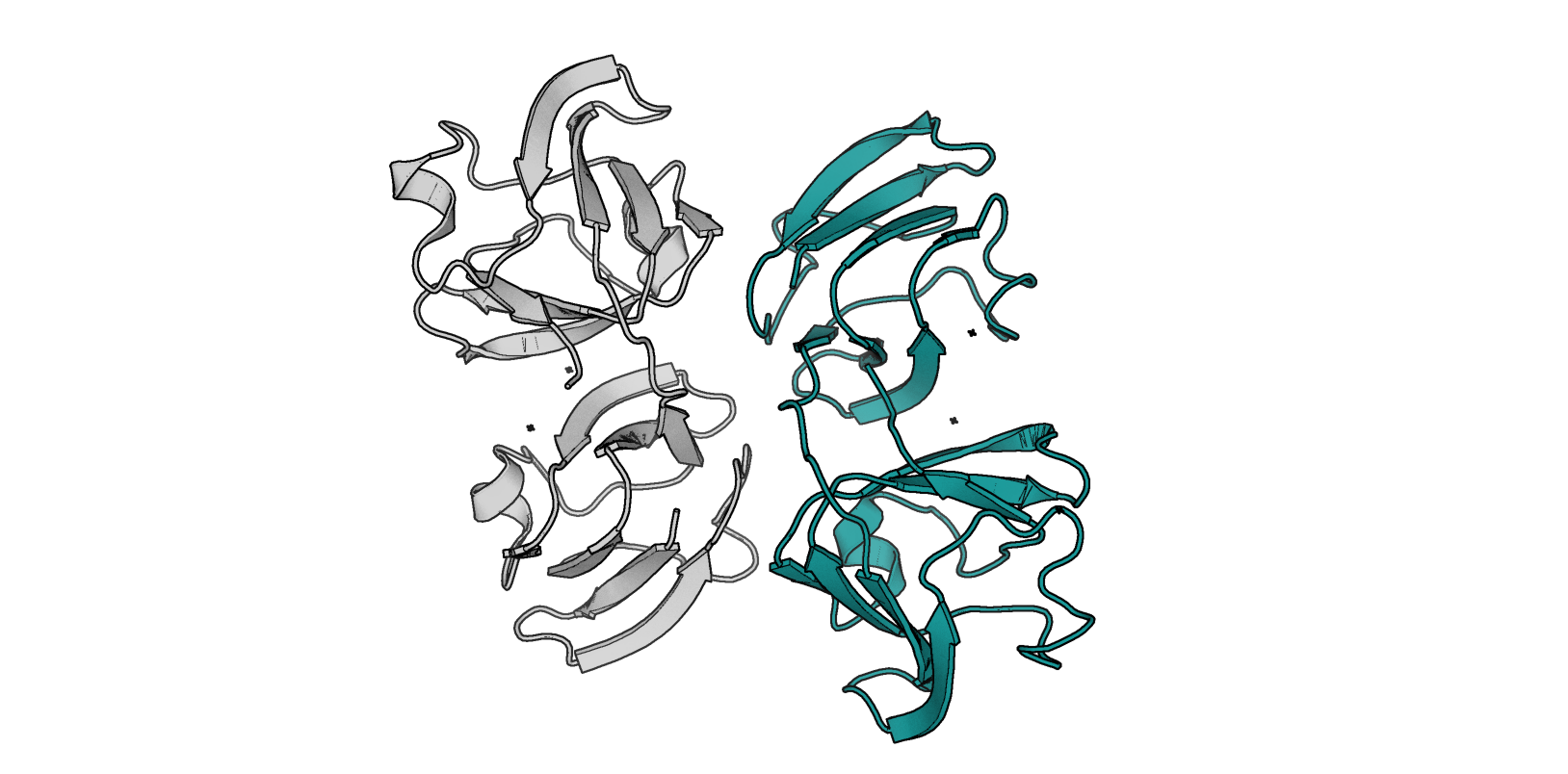
Перечислим некоторые межцепочечные взаимодействия в структуре 4JGF (РСА):
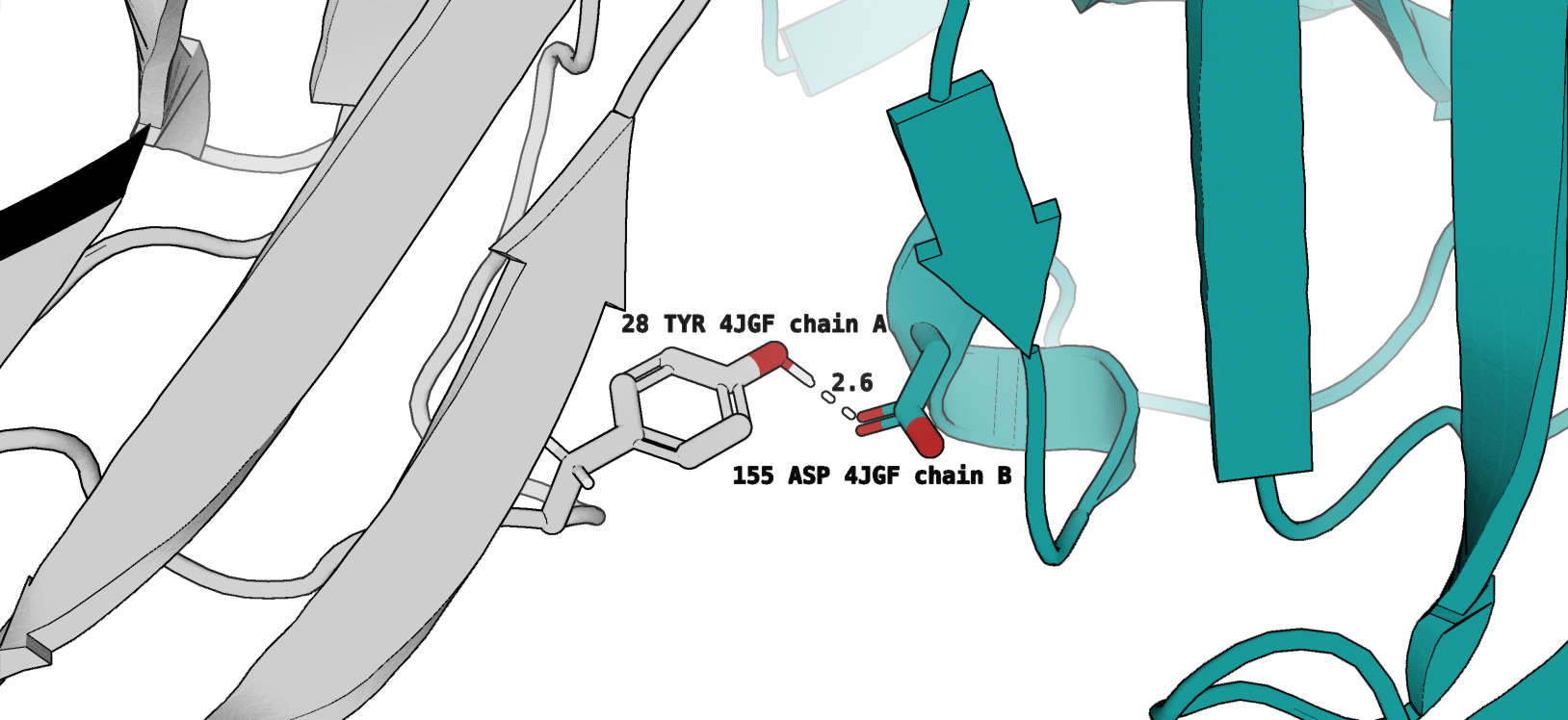
- Водородная связь между Tyr28 цепи А и Asp155 цепи В (рис. 3)
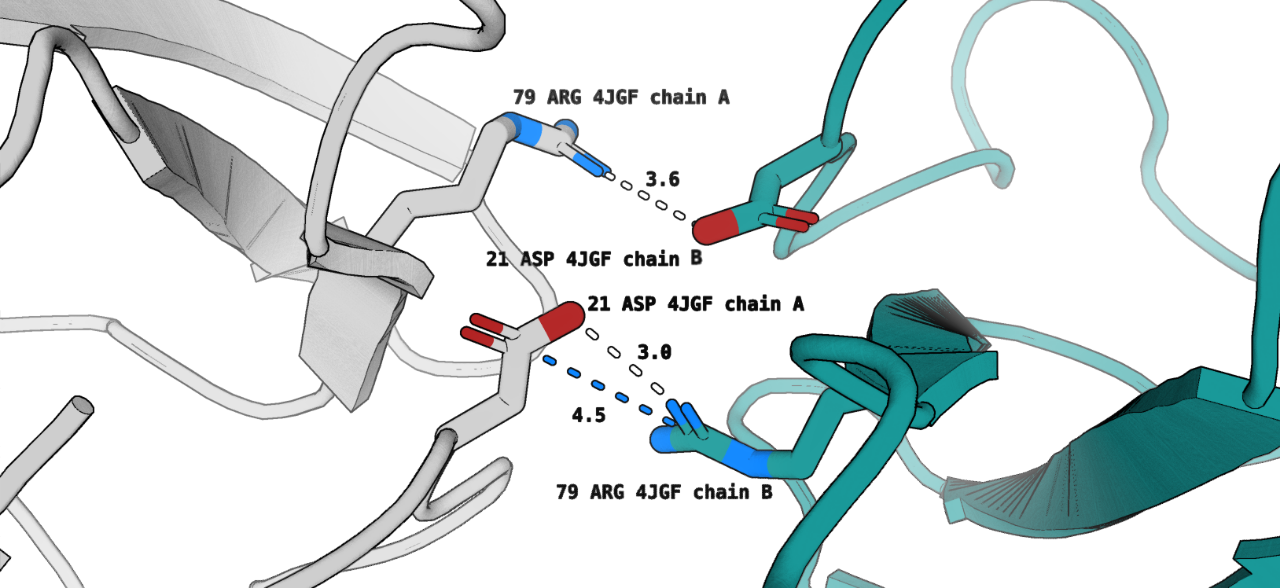
- Солевой мостик между Asp21 цепи А и Arg79 цепи В (рис. 4)
- Водородная связь между Asp21 цепи А и Arg79 цепи В (рис. 4)
- Водородная связь между Arg79 цепи А и Asp21 цепи В (рис. 4)
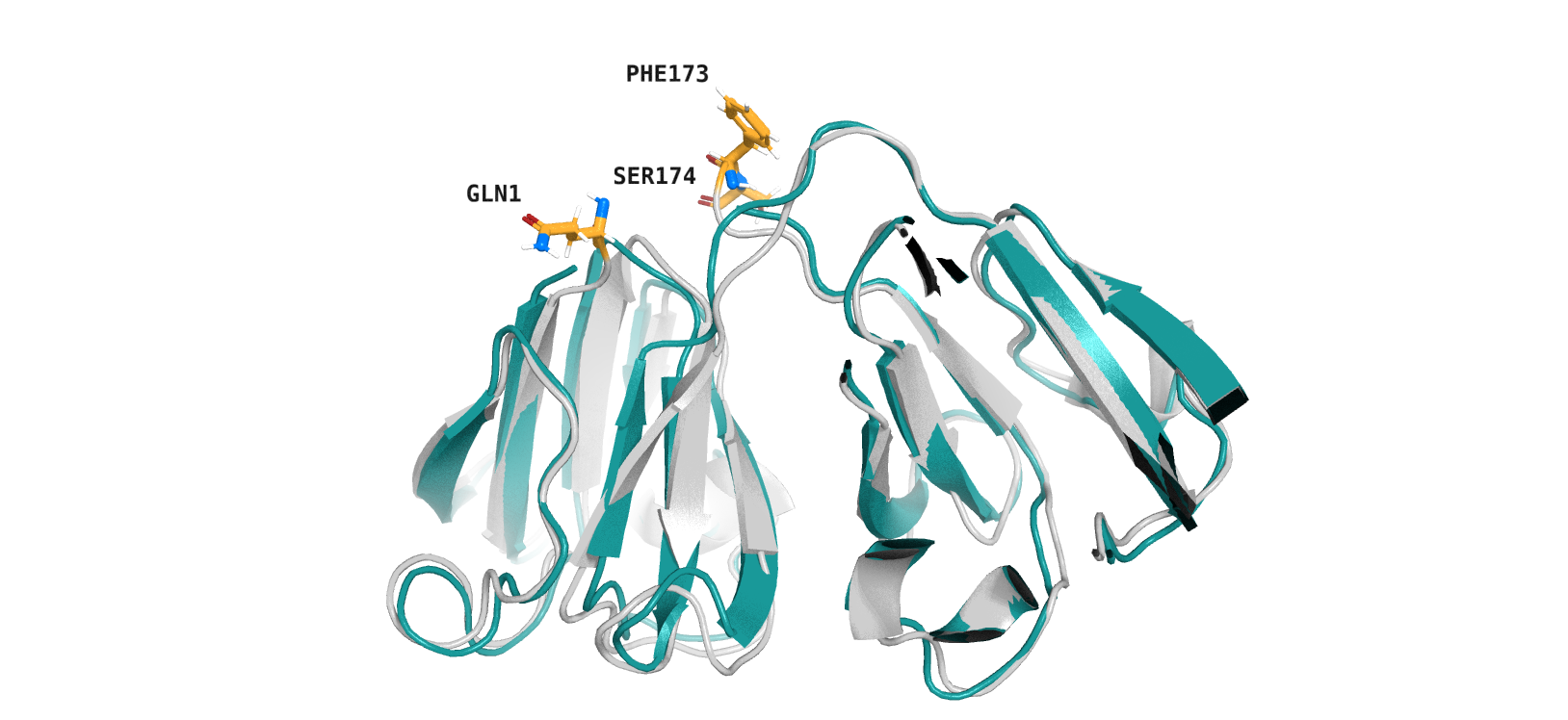
Продолжим разговор о различии РСА и ЯМР структур. Примечательно, что 2KFB (ЯМР) длиннее, чем 4JGF (РСА) на три аминокислотных остатка (в самом начале белковой цепи - Gln1 и в конце - Phe173, Ser174, рис. 5). Возможно, это связано с тем, что концевые остатки в РСА имели плохое покрытие электронное плотностью и их не удалось разрешить.
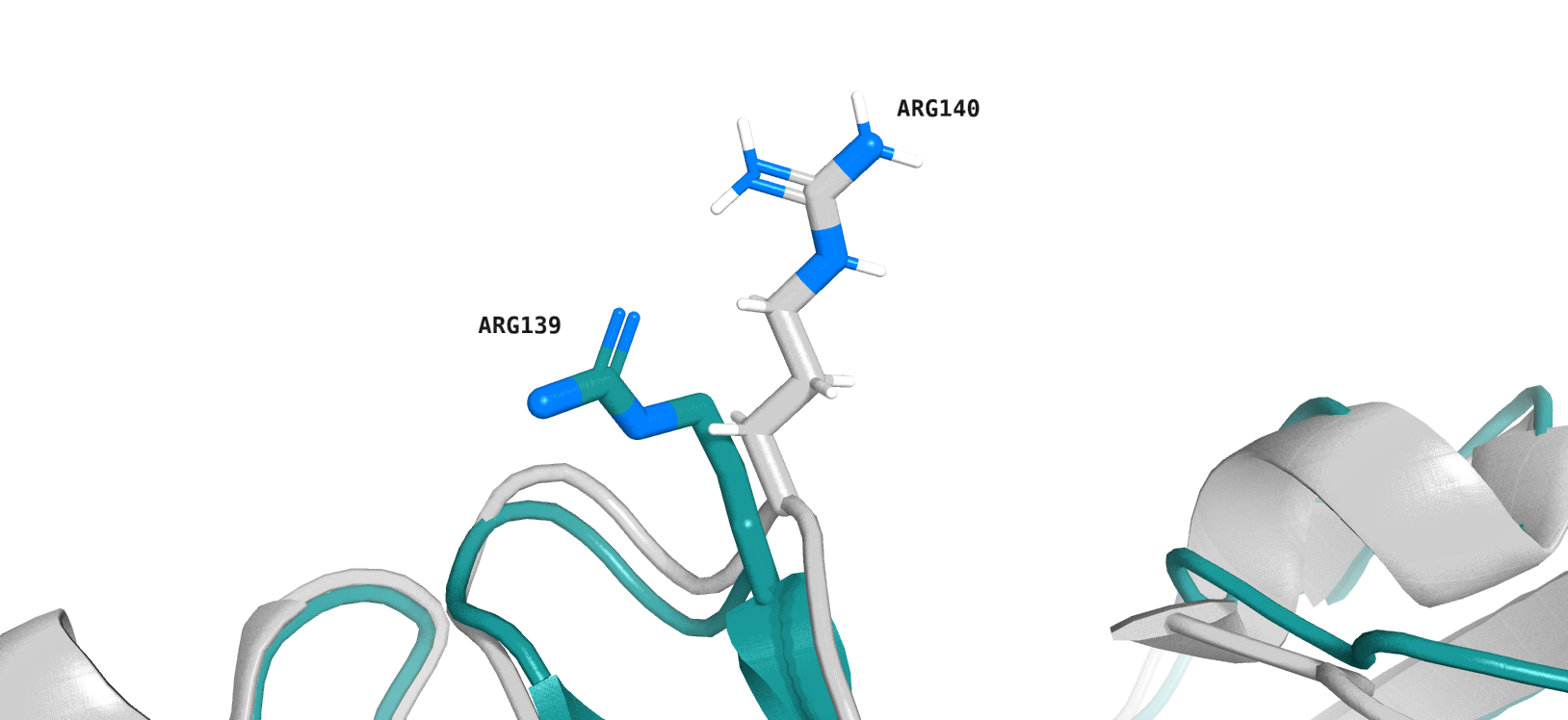
Стоит также отметить, что боковые цепи аминокислот из РСА далеко не всегда сопоставляются с их "близнецами" из конформаций ЯМР (пример - боковая цепь одного из аргининов, сопоставление РСА и одной из конформаций в ЯМР, рис. 6).
Многие аргинины в структуре 4JGF, расположенные близко к поверхности, достаточно плохо покрыты электронной плотностью (рис. 7), вероятно, это связано с их повышенной подвижностью. Тут встает вопрос о том, какое расположение радикалов аминокислотных остатков можно считать более правильным - тому, что что в РСА (а некоторые покрыты ЭП плохо, в связи с чем сложно говорить о правильном их разрешении), или тому, что в ЯМР (казалось бы - структура в растворе более нативна, нежели в кристалле; но ЯМР также достаточно чувствителен к высокой подвижности остатка, а усреднение положения группы атомов по нескольким конформациям из семейства может оказаться биологически неправильным).

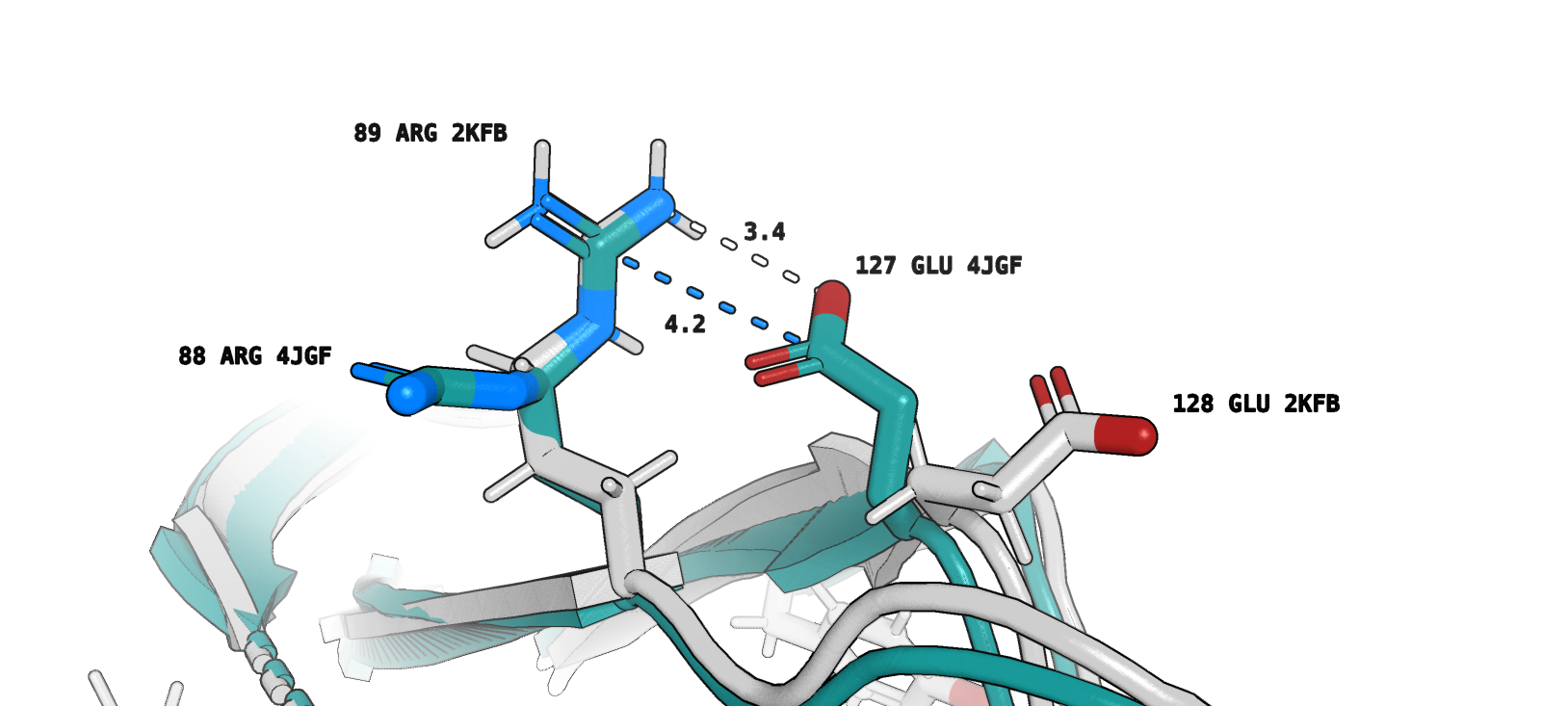
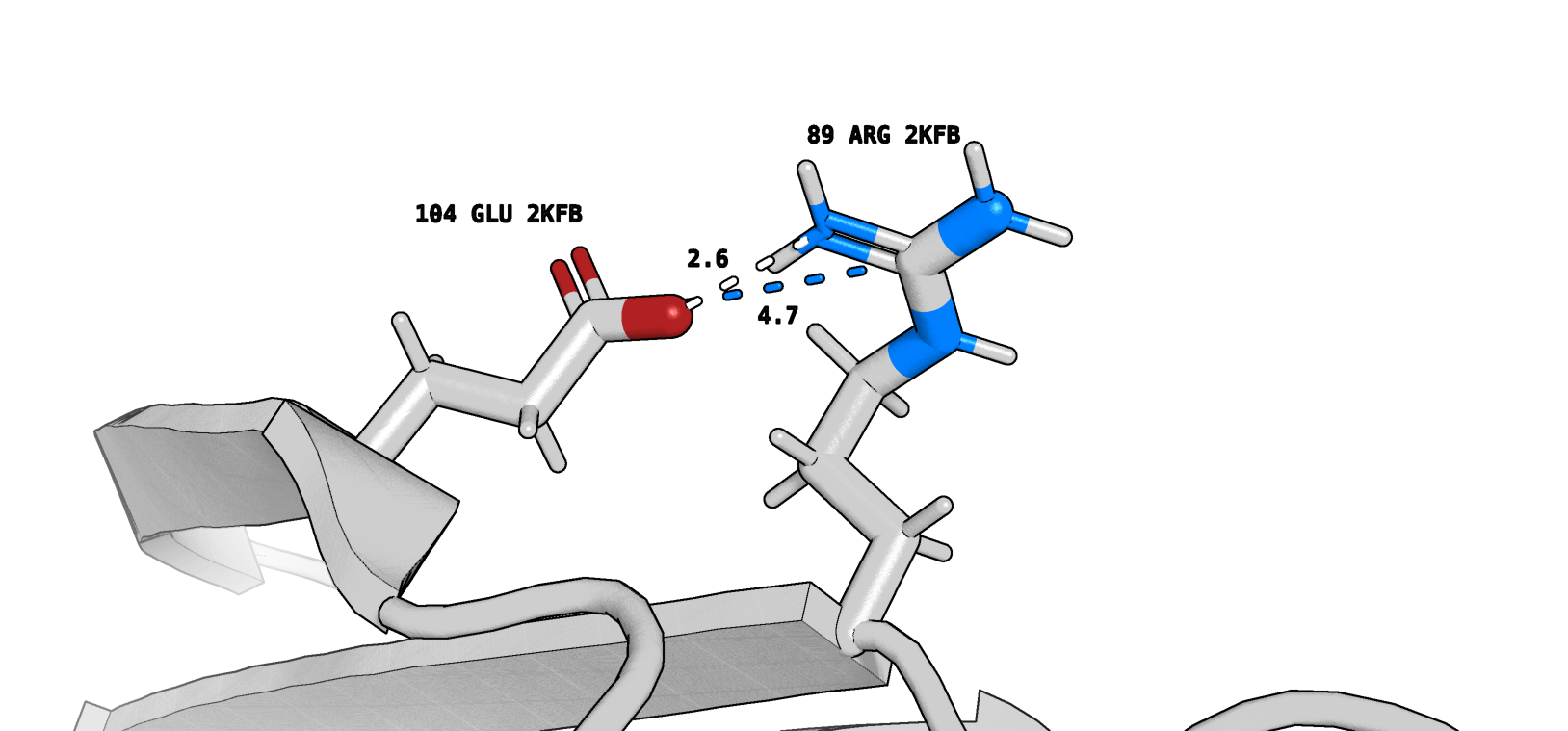
Рассмотрим альтлоки, о которых упоминалось ранее. Речь идет об Arg88 (4JGF) и соответствующем ему Arg89 (2KFB). Обратимся к рисунку 8 - на нем видно, что один из альтлоков аргинина (структура РСА, deepteal) образует солевой мостик (marine) и водородную связь (white) с Glu127 (можно предположить, что это взаимодействие остатков достаточно прочное). Отмечу также, что этот альтлок "более вероятный" согласно записи pdb (0.55 против 0.45). Тем не менее, в 2KFB (ЯМР) не наблюдается взаимодействия аргинина, по расположению соответствующего рассматриваемому нами альтлоку, и Glu128.
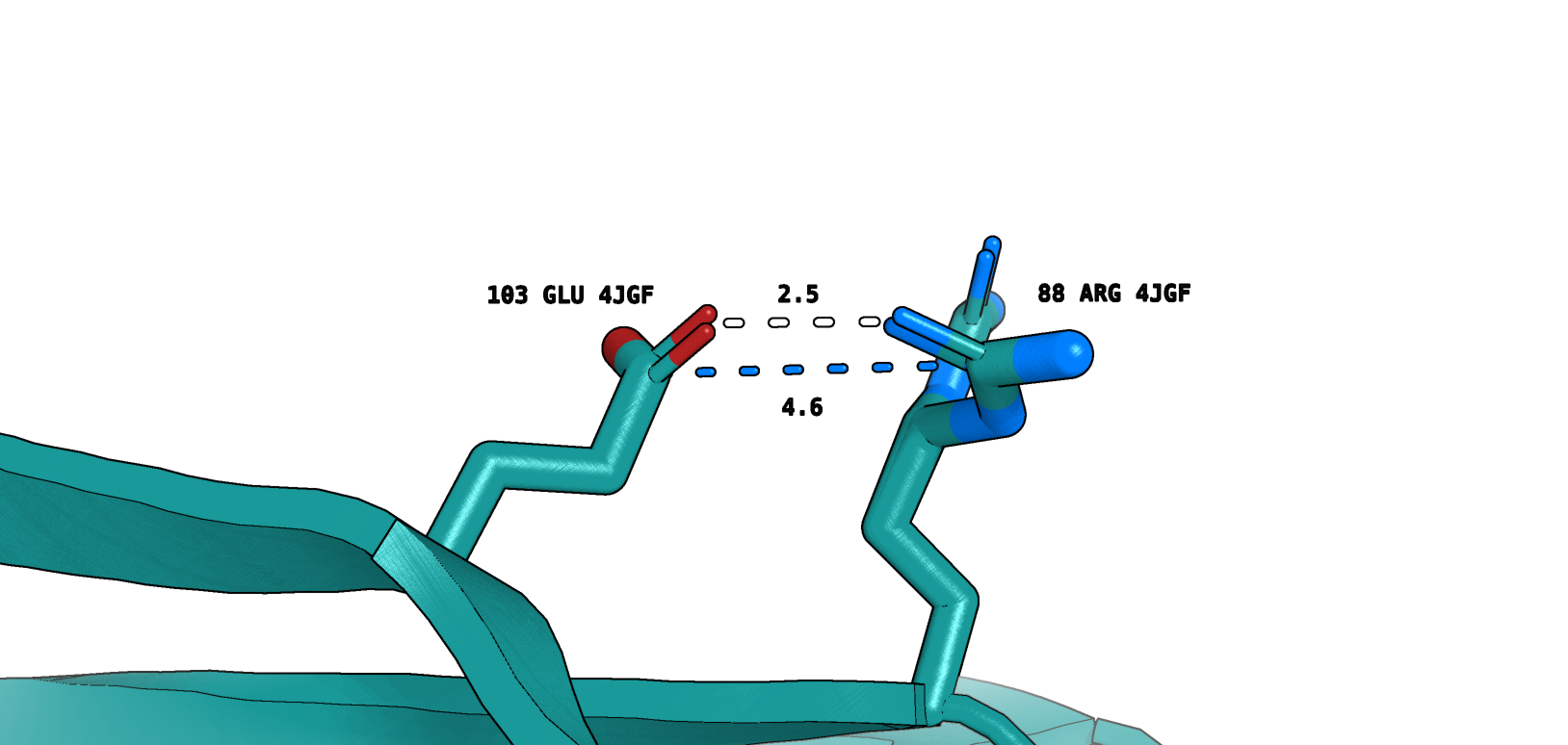
Второй альтлок Arg88 образует солевой мостик (marine) и водородную связь (white) с Glu103 (рис. 9). Arg89 в одной из конформаций (ЯМР) образует похожие взаимодействия с Glu104 (рис. 10). Можно сказать, что мы нашли некоторое сходство на микро-уровне.
Задание 2. RMSF
Задание выполнено в jupyter-notebook, его можно открыть, перейдя по следующей ссылке.
Задание 3
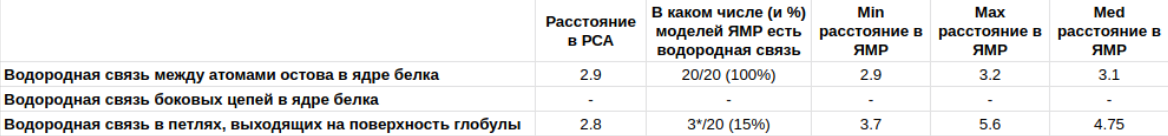
Для каждой из предложенных категорий водородных связей были выбраны следующие (в РСА-структуре):
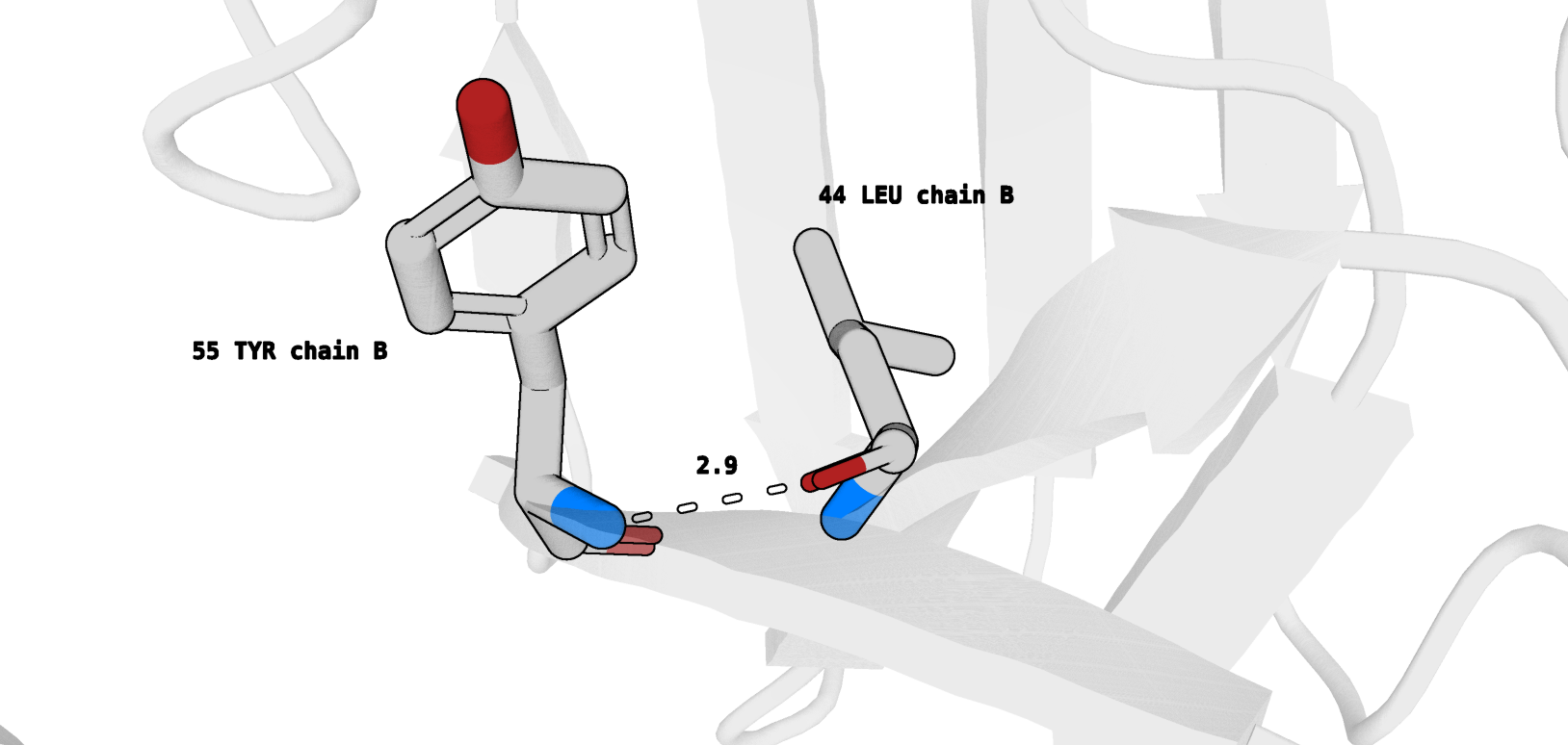
- Водородная связь между атомами остова в ядре белка (в альфа-спирали или бета-листе):
Tyr55 (цепь В)/Leu44 (цепь В) (рис. 11)
- Водородная связь боковых цепей в ядре белка:
в рассматриваемой РСА-стуктуре гамма-кристаллина D (4JGF) данный тип водородной связи не найден
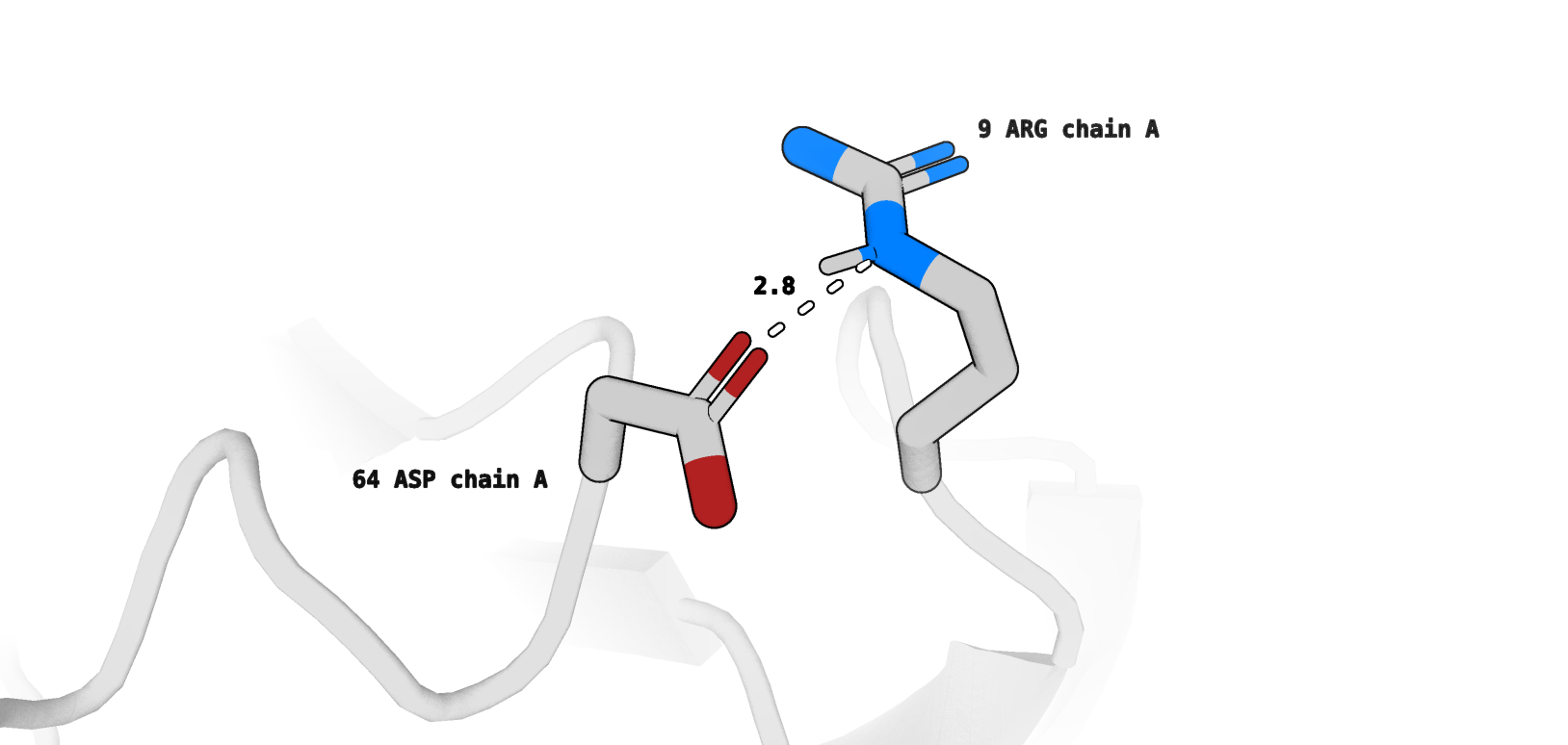
- Водородная связь в петлях, выходящих на поверхность глобулы:
Asp64 (цепь А)/Arg9 (цепь А) (рис. 12)
Была составлена следующая таблица:
Наличие (или отсутствие) водородной связи в каждой модели ЯМР показано на рисунках 13 и 14.
Хочется отметить, что для типа водородной связи, который изображен на рис. 14 сложно утверждать о точном наличии данного типа
взаимодействия в одной из конформаций, полученных посредством ЯМР (отмеченные водородные связи характеризуются достаточно
неоптимальной геометрией и достаточно большим расстоянием между атомами, вступающими во взщаимодействие). То-есть, можно сказать,
что скорее сделано предположение о некоторой возможности наличия данного типа водородной связи в одной из конформаций - 4, 11, 17.
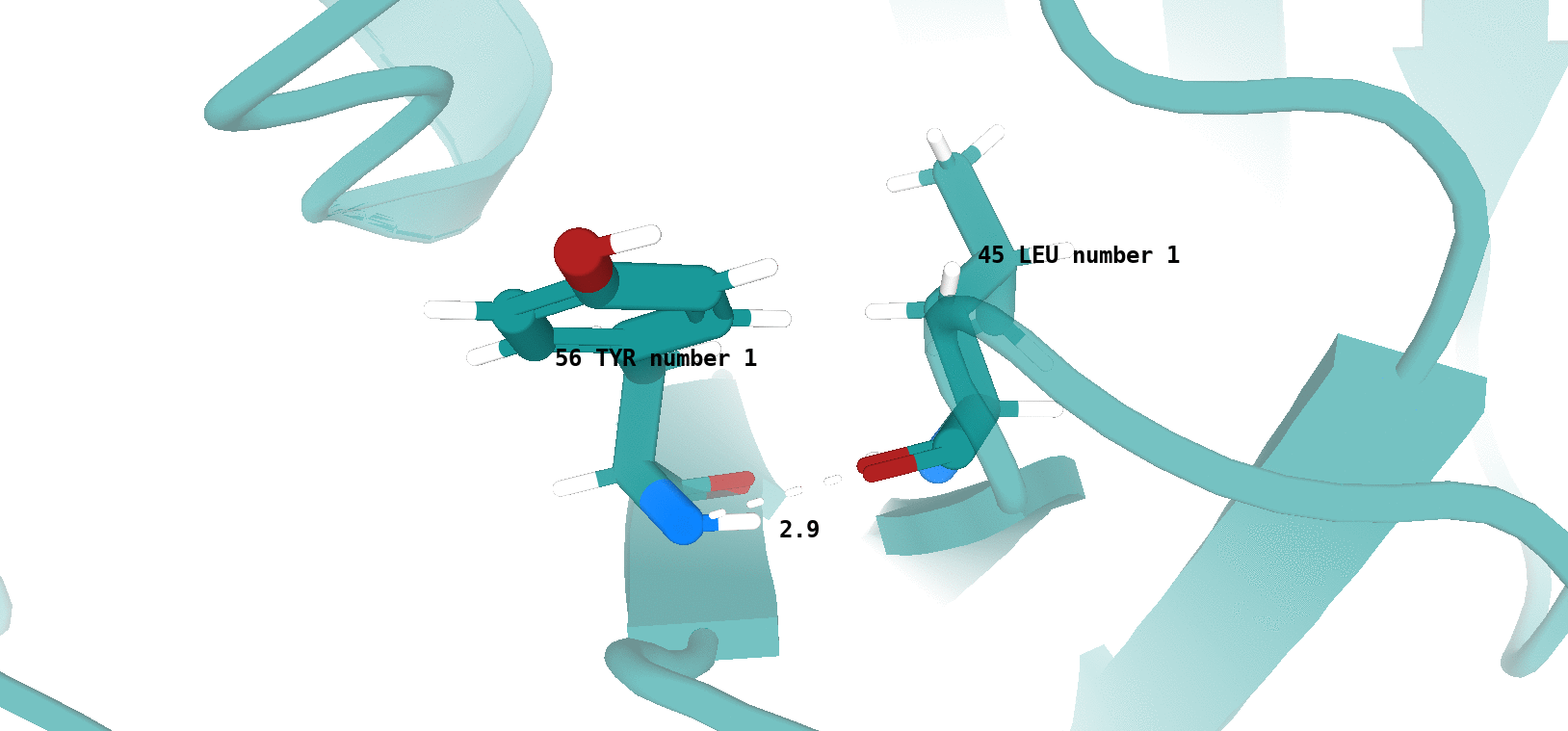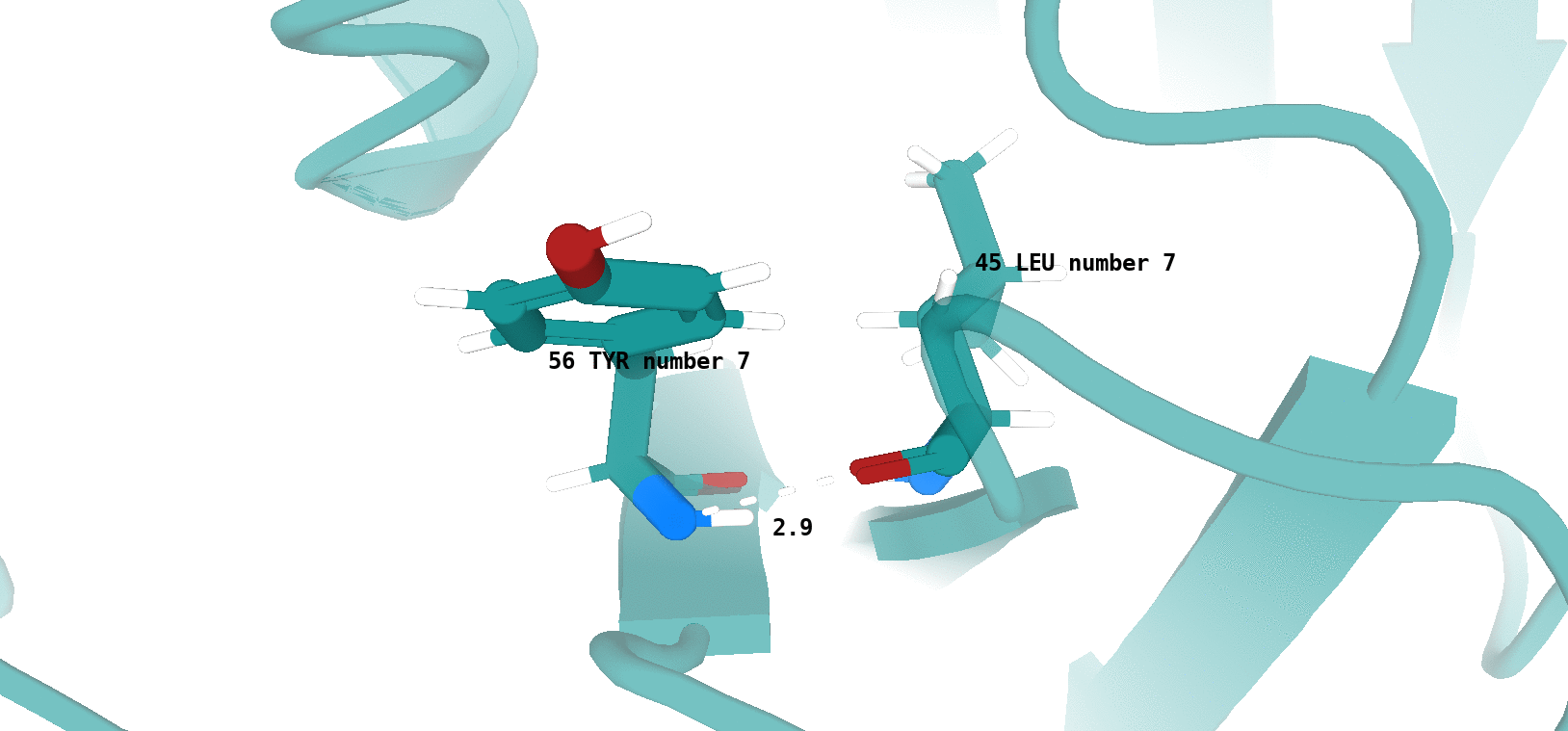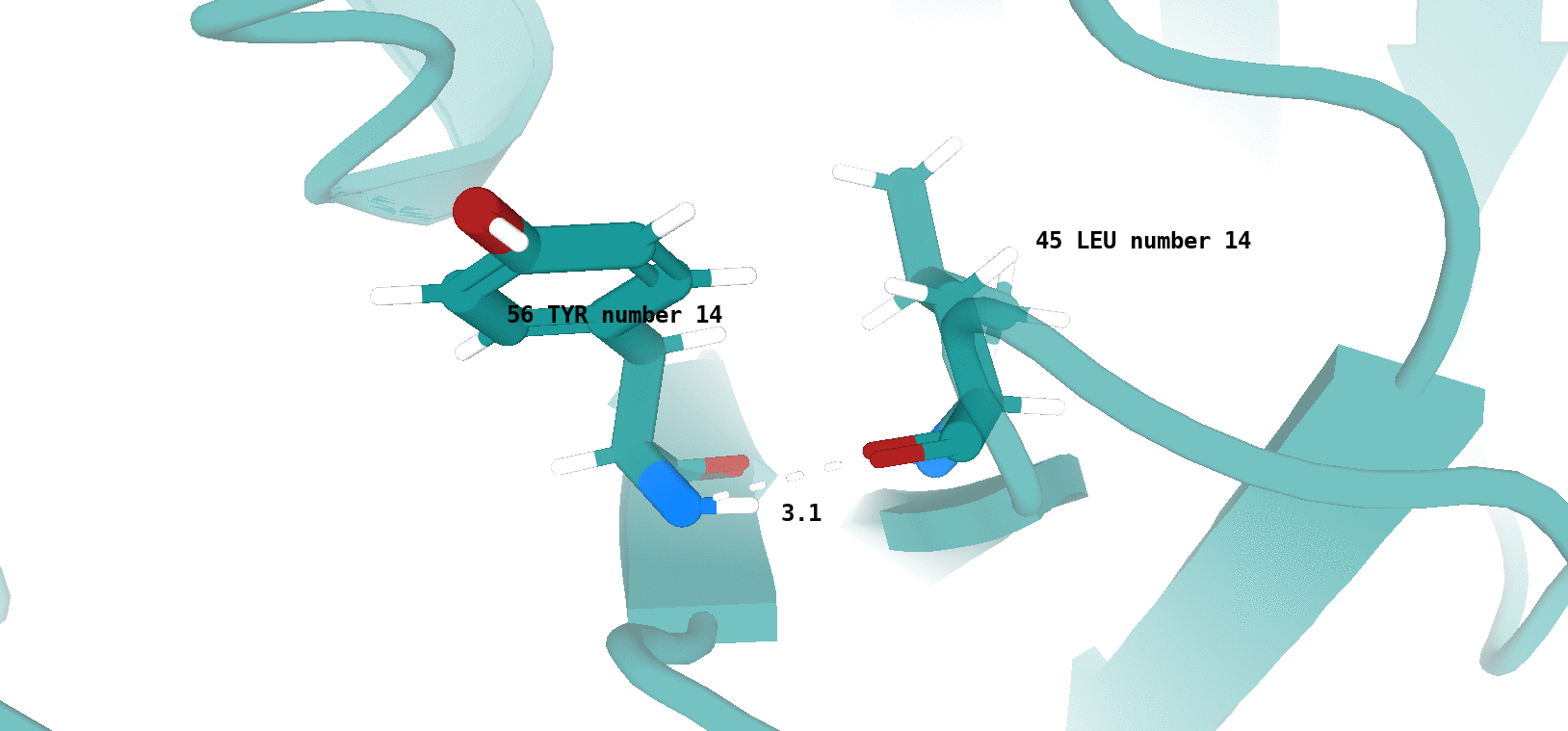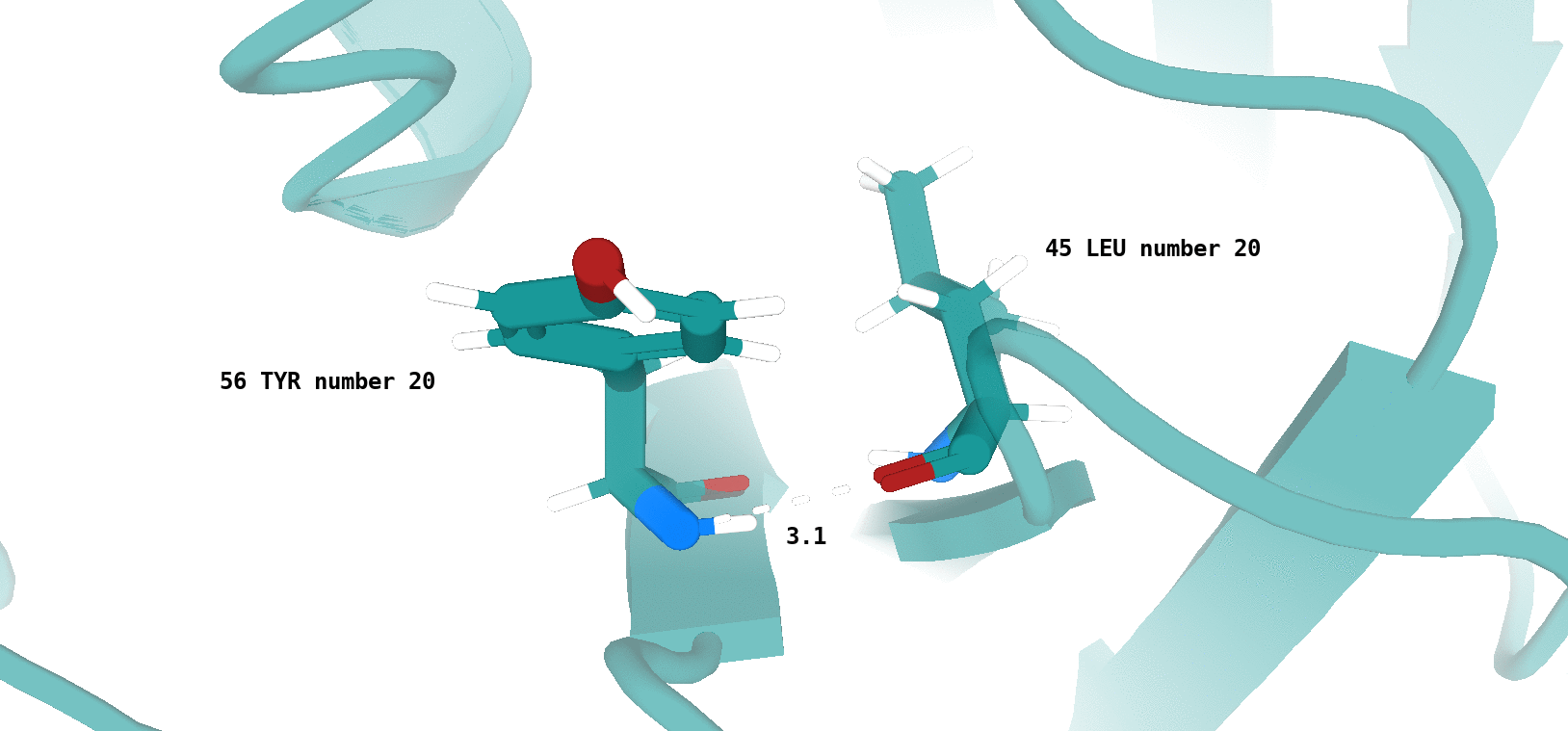
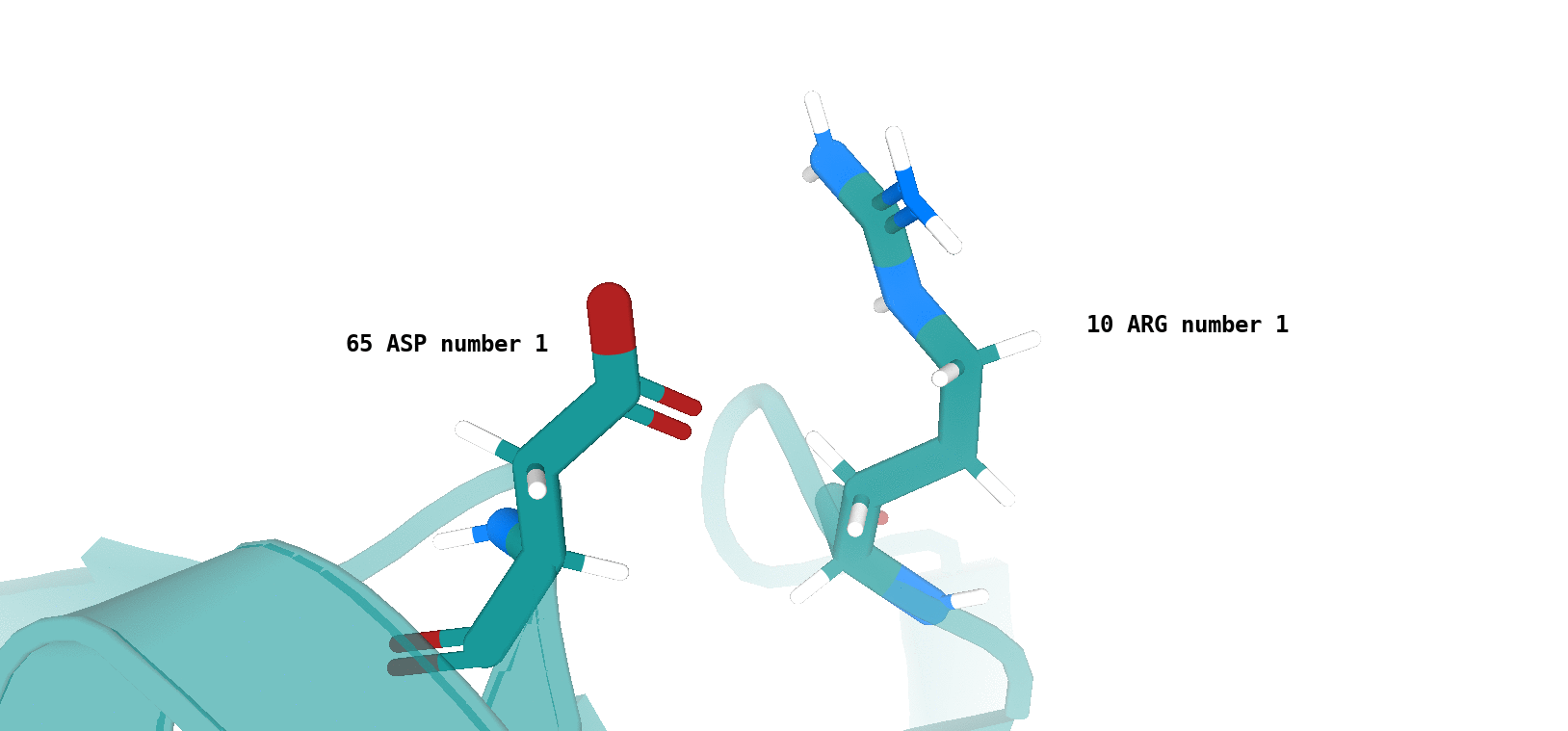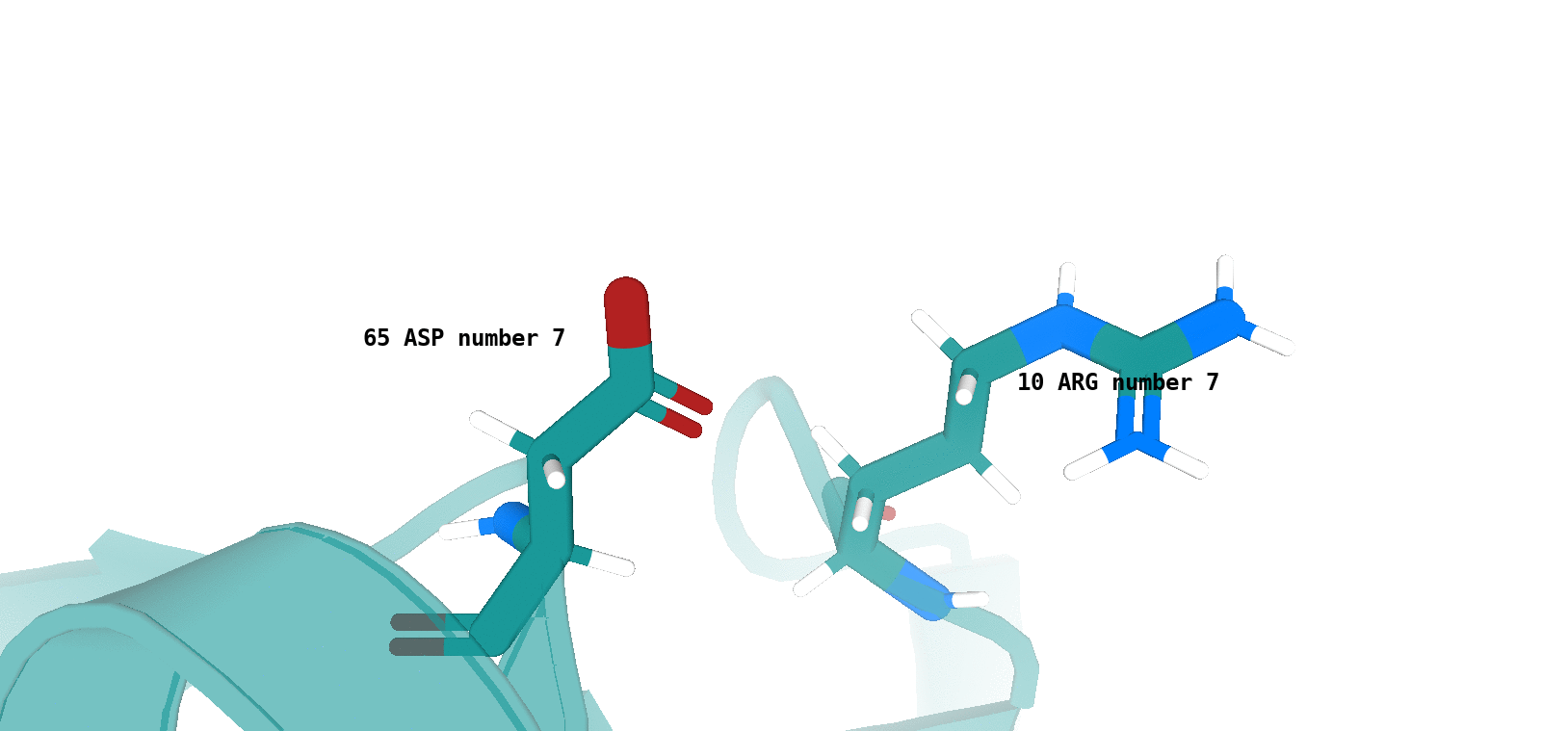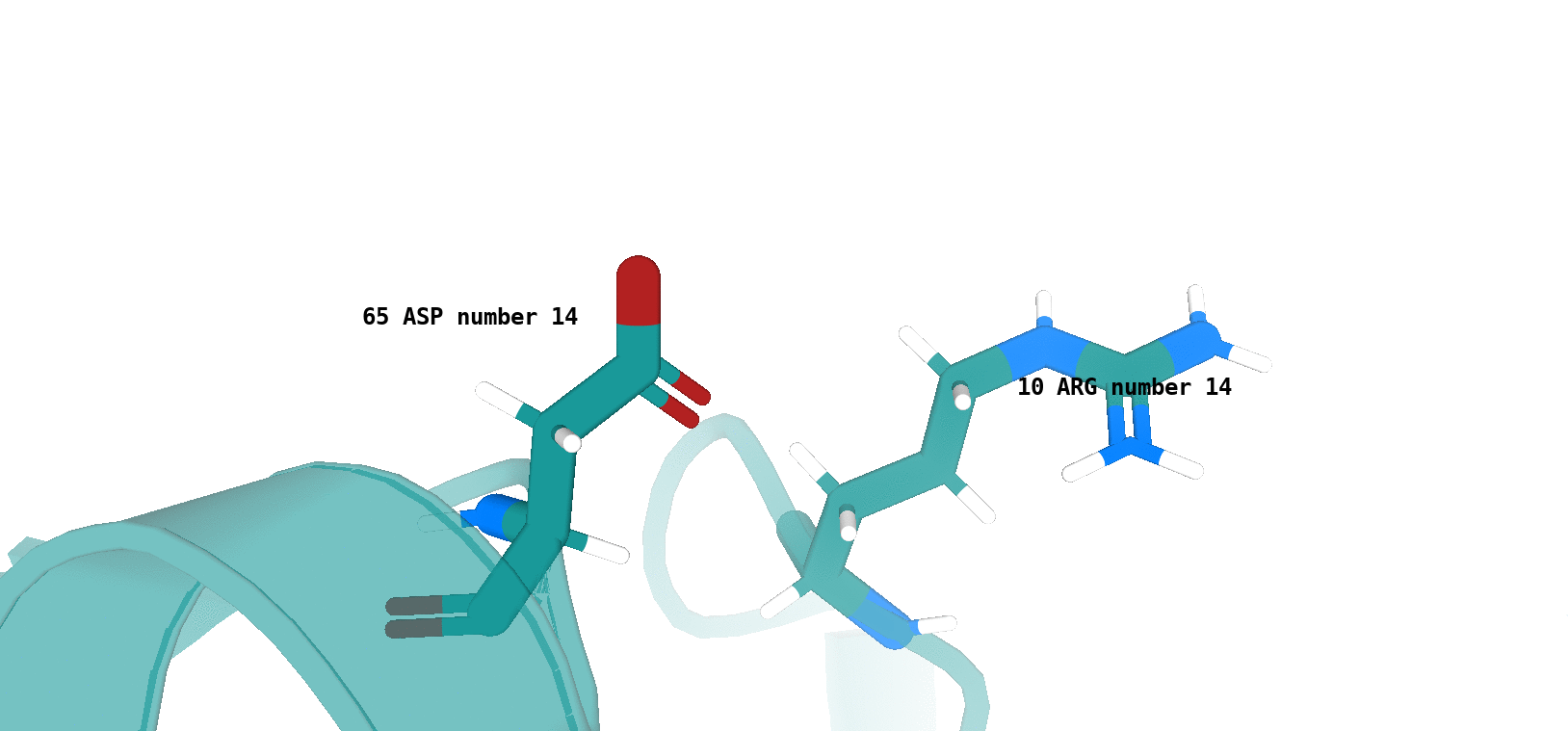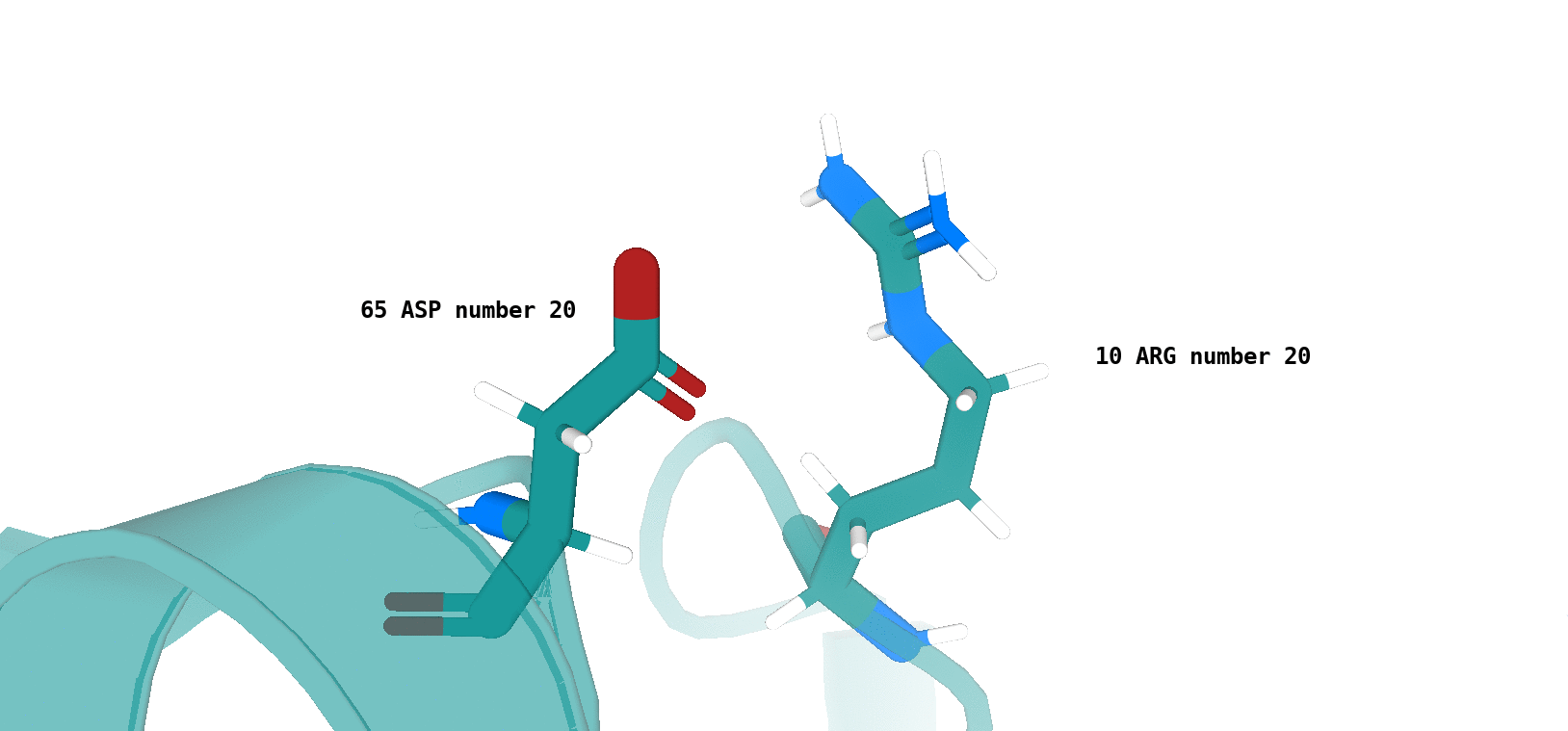
По итогу, можно сказать, что водородная связь между остовными атомами в ядре белка (в бета-листе), обнаруженная в структуре РСА, достаточно хорошо "воспроизводится" в каждой конформации ЯМР. Водородная связь между боковыми радикалами аминокислот (в петле, выходящей на поверхность белковой глобулы), напротив, "воспроизводится" достаточно плохо. Вероятно, это связано с повышенной подвижностью петлевых участков, расположенных на поверхности молекулы белка. Элементы вторичной структуры, наоборот, - более строго организованные компоненты, и вполне логично было бы ожидать присутствия водородной связи между атомами остова в составе бета-слоя в каждой конформации ЯМР.