Взаимодействия. Субстратная специфичность
Задание 1. PoseView
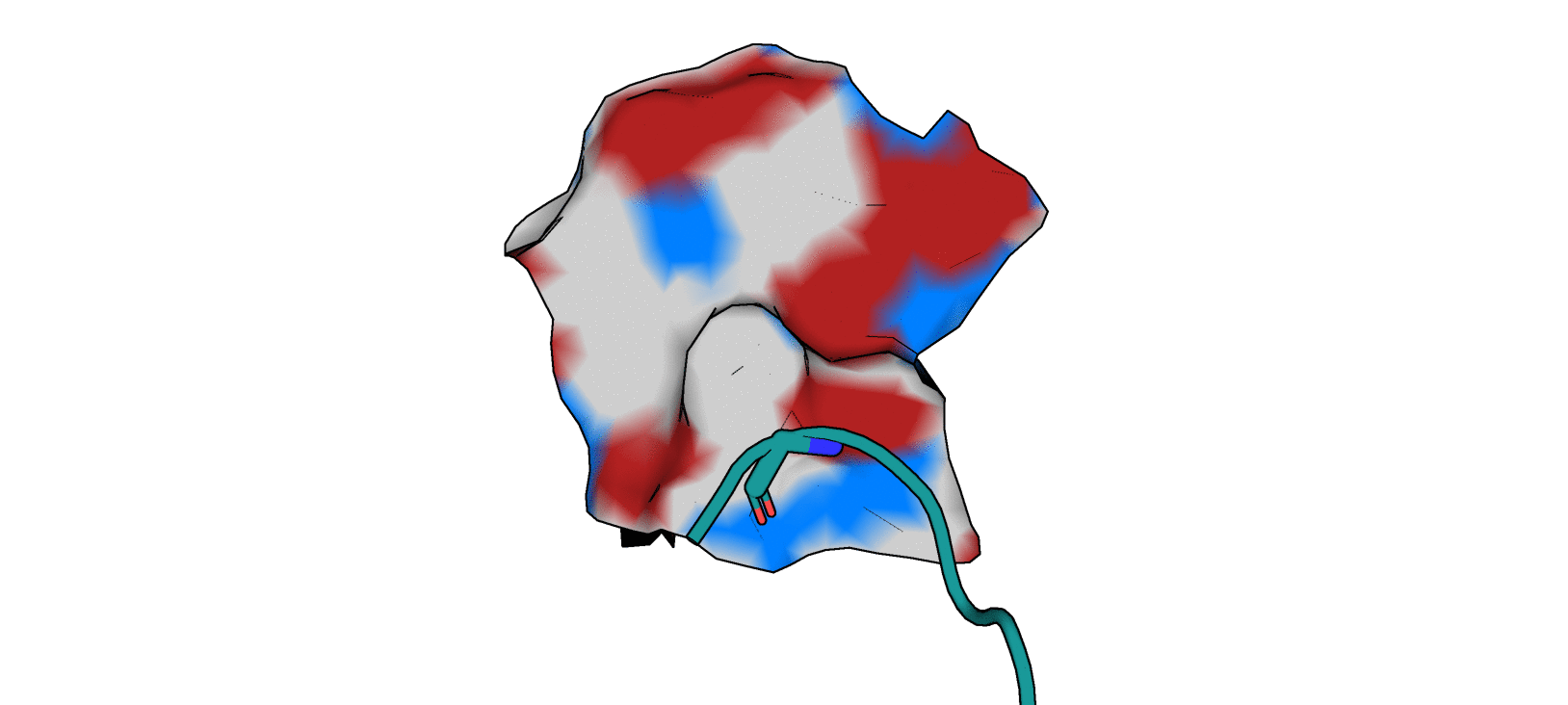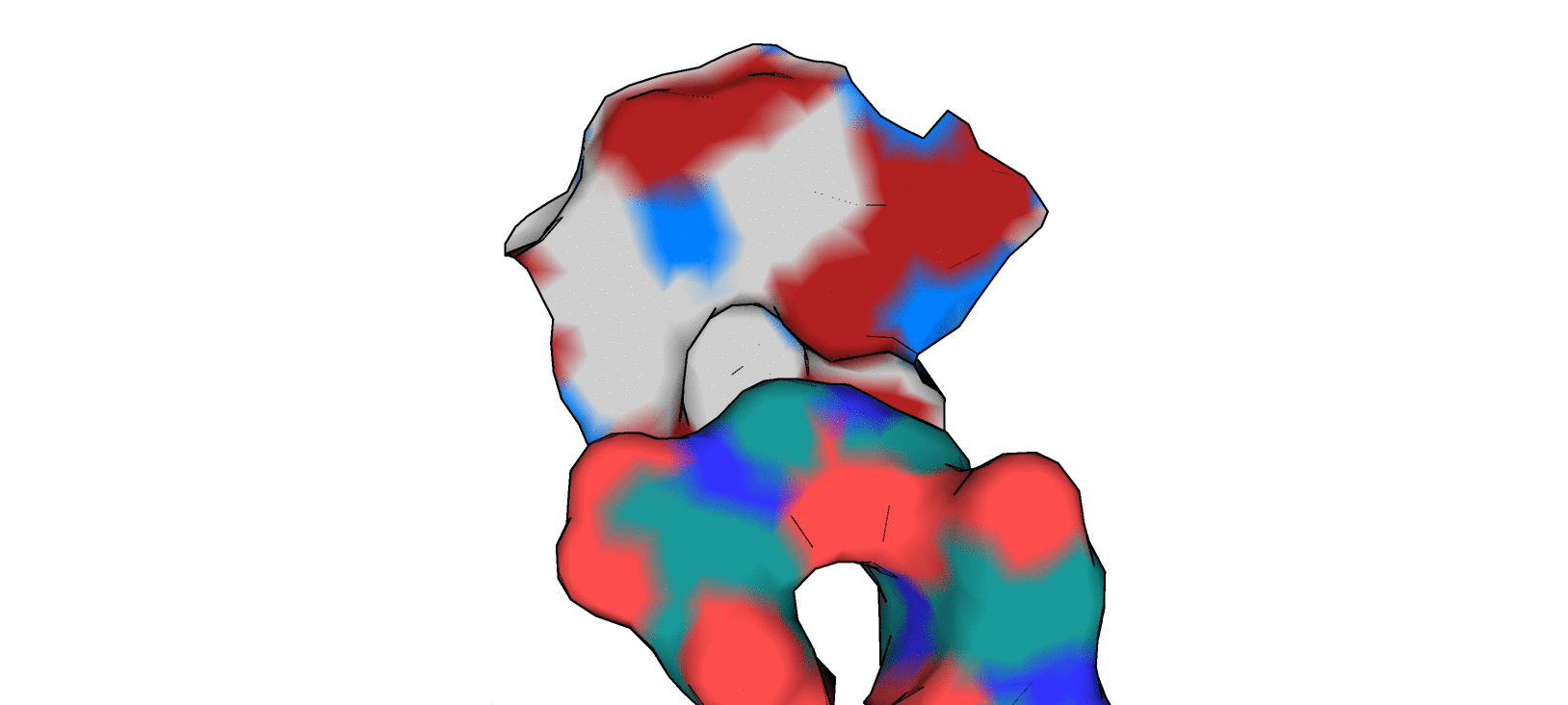
Рассматриваемая структура: 5REP. Для нее с помощью с помощью Poseview на сайте Proteins.Plus была построена двухмерная диаграмма взаимодействия протеазы с лигандом T3G (ее можно увидеть на рис. 1).
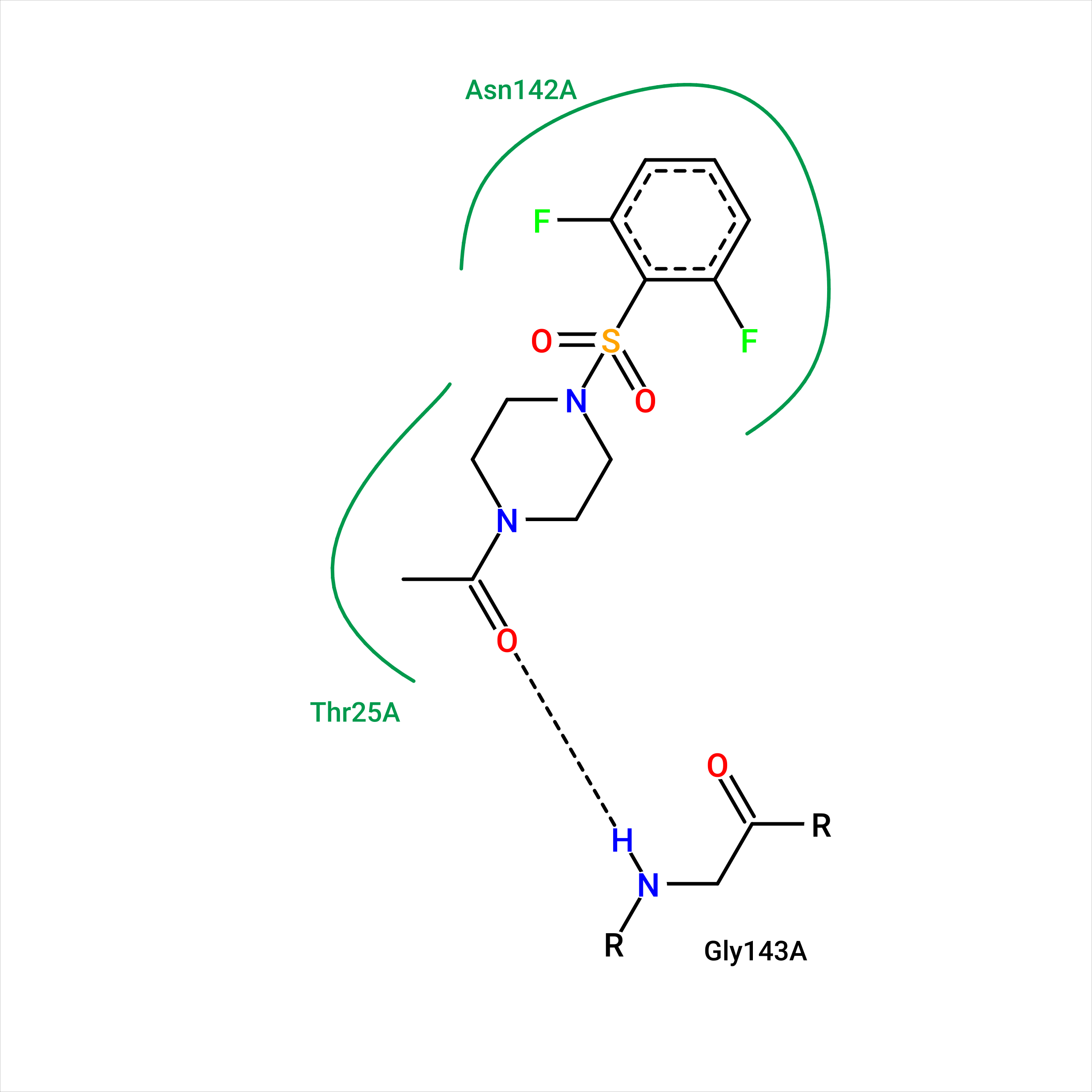
Взаимодействия, выведенные программой на диаграмму:
1) T3G - Gly 143 A (водородная связь)
2) T3G - Asn 142 A (гидрофобное взаимодействие)
3) T3G - Thr 25 A (гидрофобное взаимодействия)
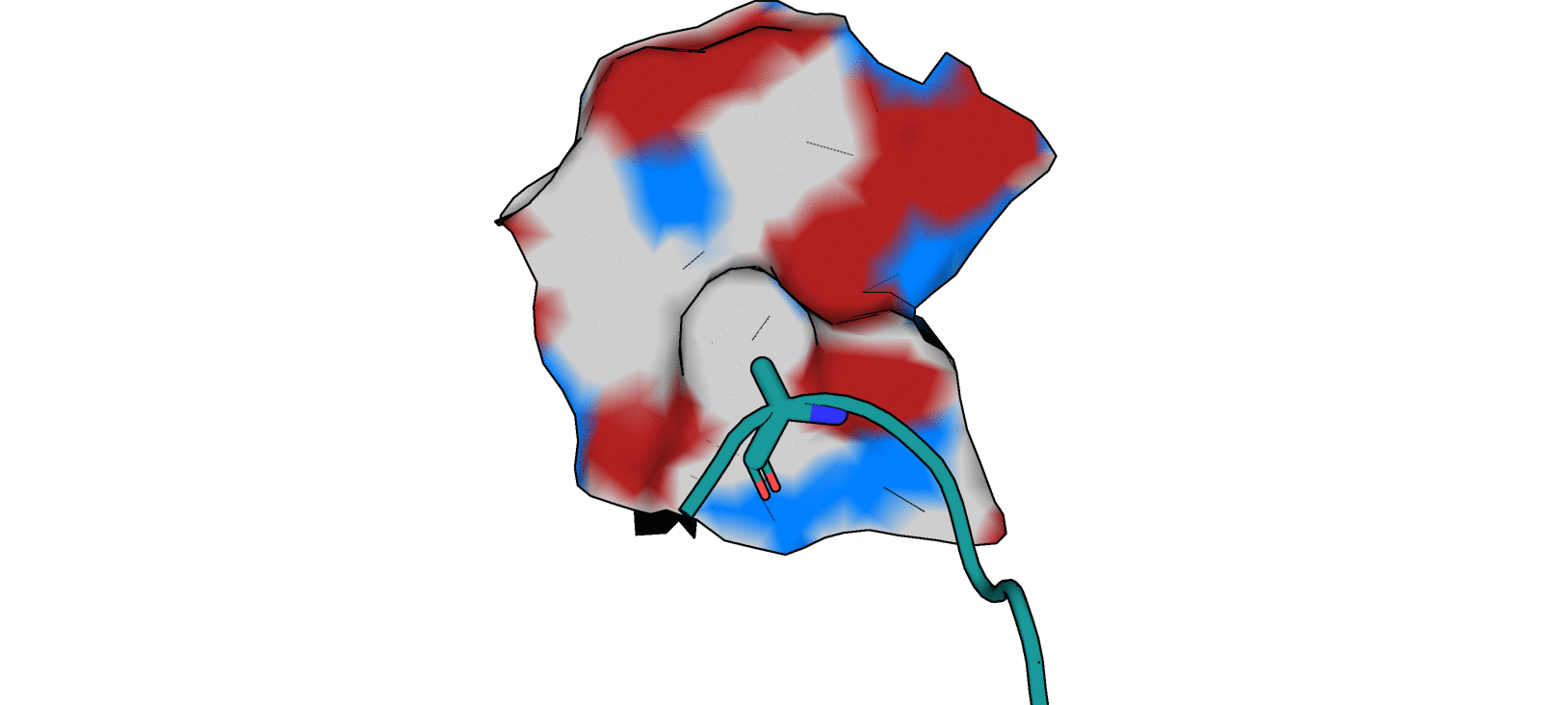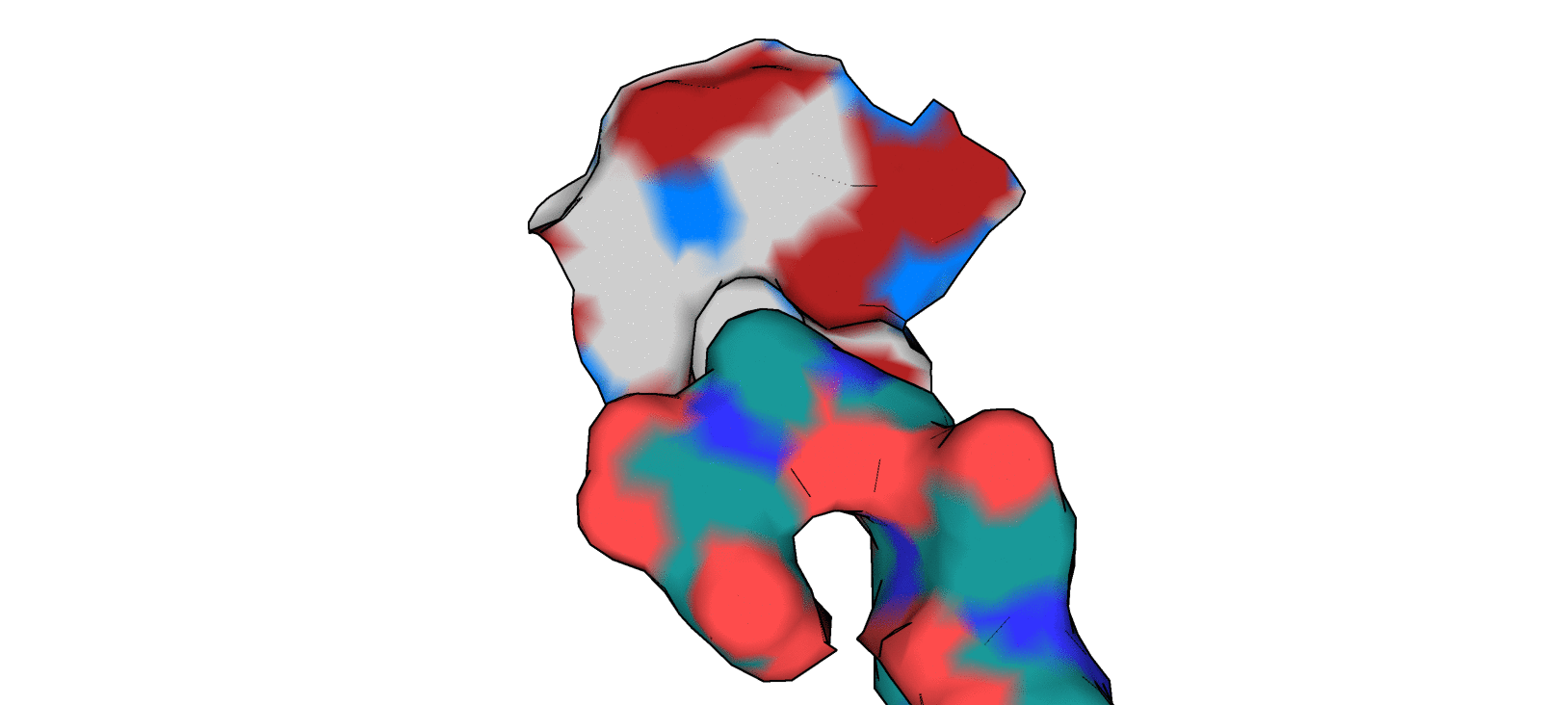
Взаимодействия, определенные мной в практикуме 1 (рис. 2):
1) T3G - Gly 143 A (водородная связь)
2) T3G - Cys 145 A (водородная связь)
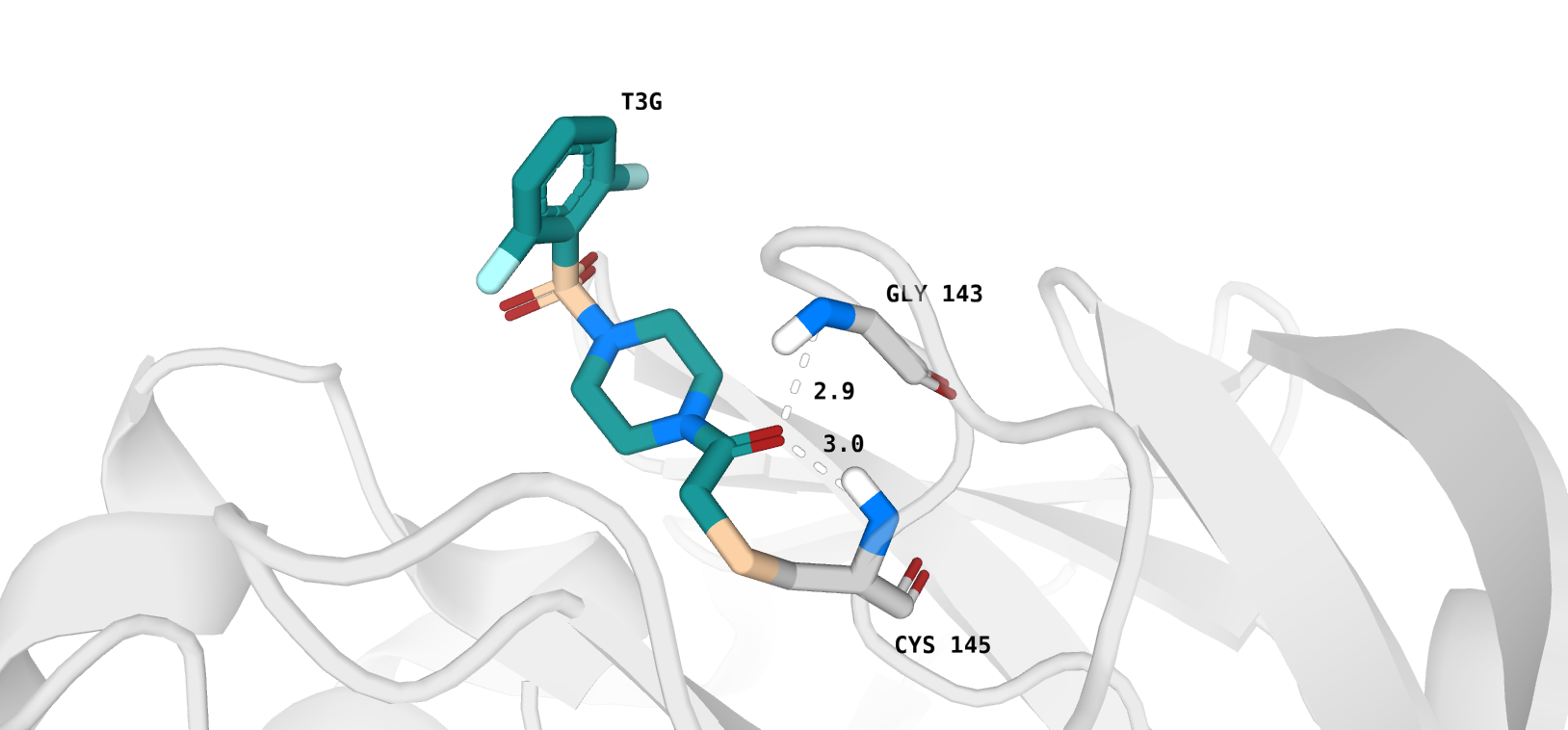
Взаимодействие, встречающееся в обоих "вариантах поиска" - водородная связь с Gly 143 цепи А. В целом, можно сказать, что гидрофобные взаимодействия
лиганда T3G и белка не были рассмотрены в ходе практикума 1 (они будут рассмотрены далее). Также стоит упомянуть, что Proteins.Plus не отобразил водородную
связь между лигандом и Cys 145 A.
Остатки, для которых Proteins.Plus определил наличие гидрофобных взаимодействий с лигандом, показаны на рис. 3.
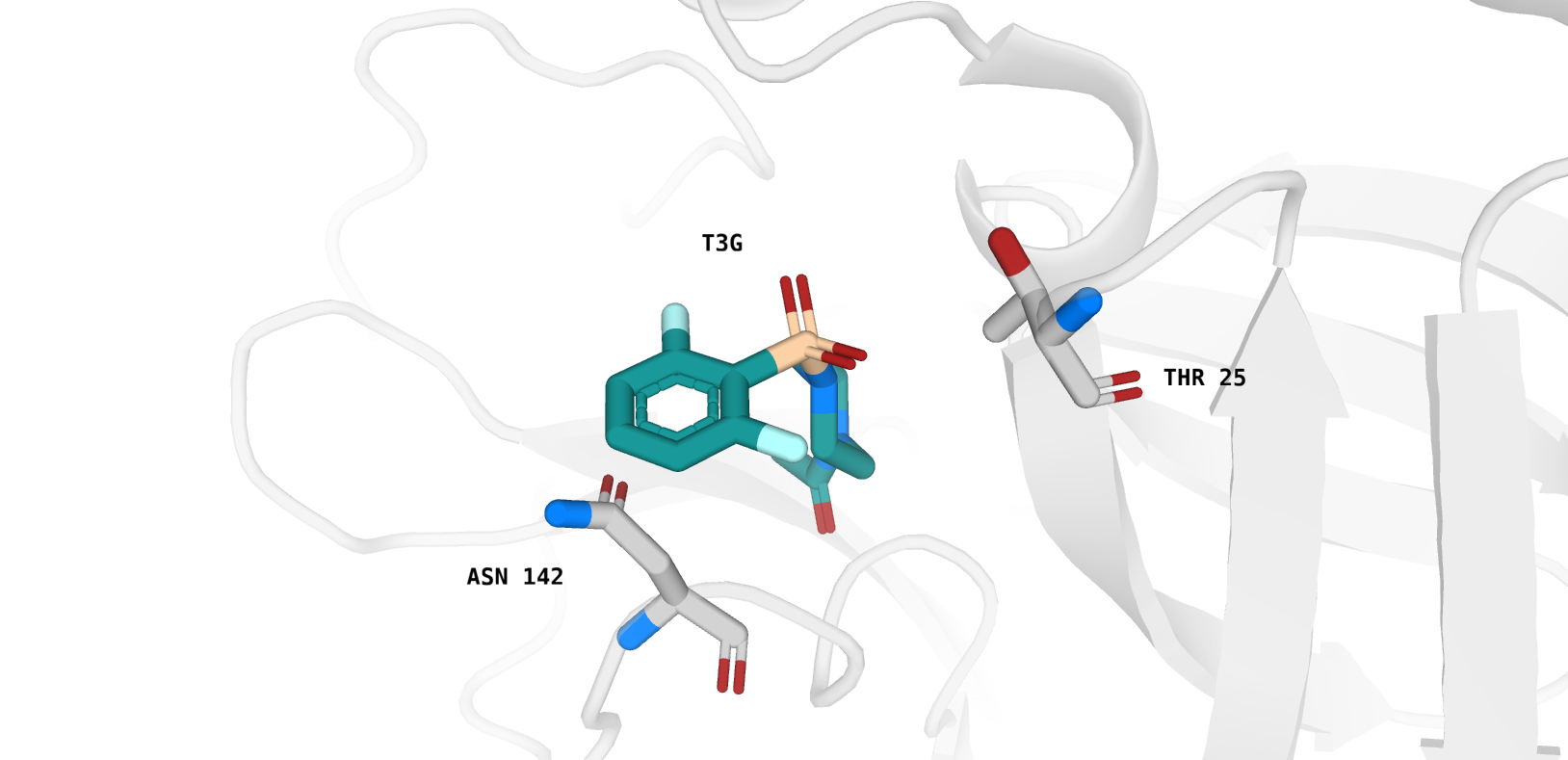
Можно сказать, что между ароматическим кольцом T3G и "углеродным" участком бокового радикала Asn 142 действительно можно предположить наличие гидрофобного взаимодействия. Между участком CA-CB-CG2 (Thr 25) и пиперазиновым кольцом лиганда T3G также можно предположить возможность реализации гидрофобного взаимодействия, но, как мне кажется, непосредственно в структуре 5REP они находятся достаточно далеко друг от друга. В качестве иллюстрации к вышесказанному приведу рисунок 4.
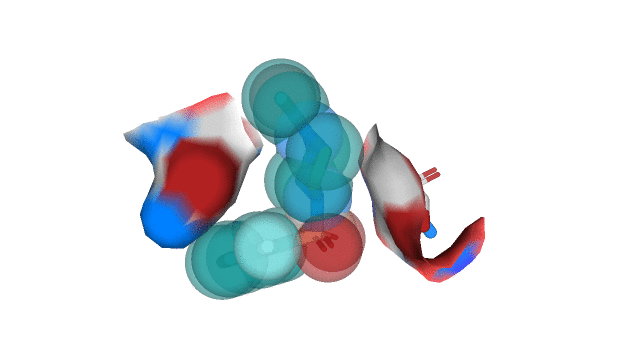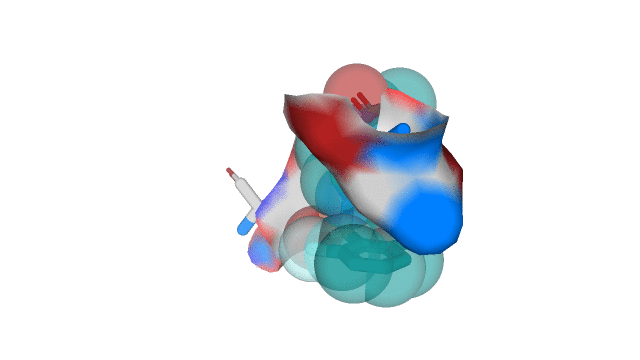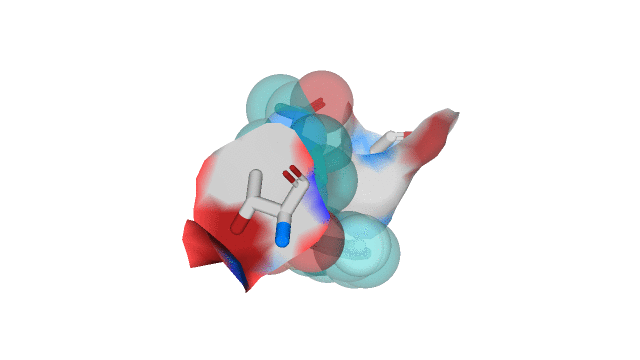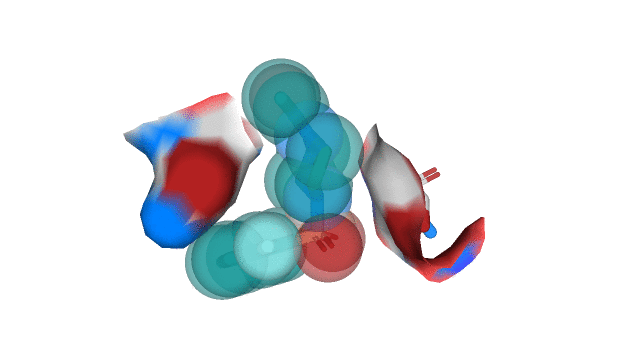
Задание 2. PyMol mutagenesis
Первая рассматриваемая нами структура - 0035 (цепь Р, позиция 6). Открываем структуру и замечаем, что в "ближайшем окружении" рассатриваемого нами глицина присутствует Arg 50 (цепь L) и Tyr 32 (цепь L). На первый взгляд кажется, что сюда хорошо было бы поместить нечто, обладающее способностью быть акцептором водородной связи (от упомянутых аргинина и тирозина), а также несущее на боковом радикале отрицательный заряд (для формирования солевого мостика с положительно заряженным аргинином). Под эту характеристику подходят аспартат и глутамат. Посмотрим на аспартат - нас предлагается 9 ротамеров. Некоторые из них своим радикалом формируют водородную связь с Tyr 34 - 1, 2, с Arg 50 - 3, 4, 5, 6, 7. Для многих ротамеров аспартата характерно наличие клэшей кислородов его бокового радикала и остовным кислородом Gly 2 (цепь P), остовным кислородом Ser 97 (цепь H). В связи с тем, что аспартат не был выбран в качестве варианта для замены глицина, мы не будем приводить здесь иллюстрации для описанных взаимодействий его ротамеров.Посмотрим теперь на глутамат, быть может, его более длинный радикал будет способствовать вынесению карбоксильной группы ближе к уже упомянутым нам остаткам Arg 50 L, Tyr 32 L, Tyr 34 L. Глутамат имеет 27 ротамеров. Наиболее правильными в нашей системе кажутся следующие варианты:
1) ротамер 1/27, strain=18.98 (19.1%)
2) ротамер 3/27, strain=18.53 (9.1%).
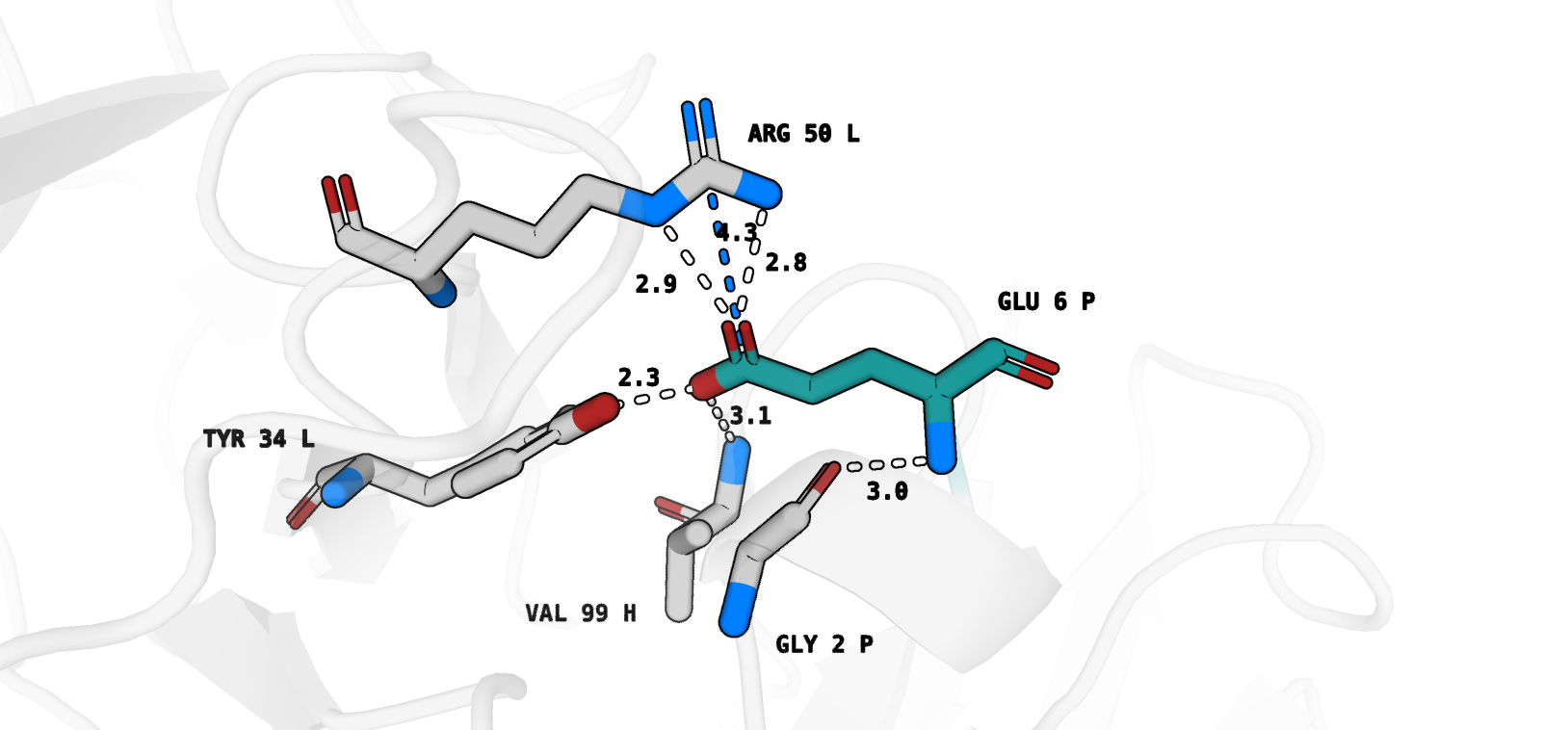
Для ротамера 1/27 (рис. 5) было найдено 6 взаимодействий (отмечу, что пока мы не говорим про гидрофобику):
1) Glu 6 P - Arg 50 L (водородная связь, длина=2.8, отмечена white)
2) Glu 6 P - Arg 50 L (водородная связь, длина=2.9, отмечена white)
3) Glu 6 P - Arg 50 L (солевой мостик, отмечен marine)
4) Glu 6 P - Tyr 34 L (водородная связь, отмечена white)
5) Glu 6 P - Val 99 H (водородная связь, отмечена white)
6) Glu 6 P - Gly 2 P (водородная связь, отмечена white, внутримолекулярное взаимодействие - остаток также принадлежит антигену).
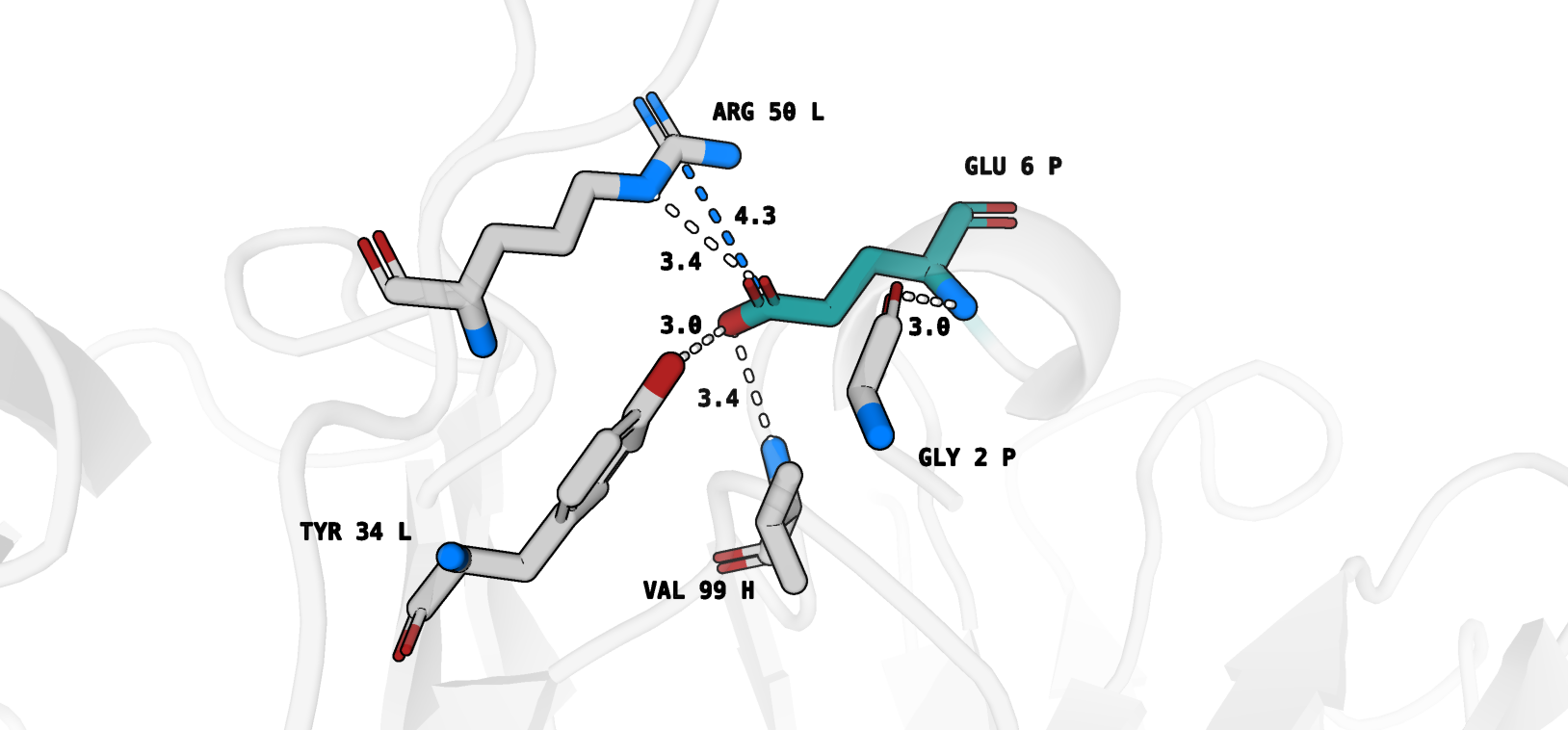
Ротамер 3/27 (рис. 6) формирует уже 5 взаимодействий (одна из водородных связей с аргинином "теряется" в виду неоптимальной геометрии):
1) Glu 6 P - Arg 50 L (водородная связь, длина=3.4, отмечена white)
2) Glu 6 P - Arg 50 L (солевой мостик, отмечен marine)
3) Glu 6 P - Tyr 34 L (водородная связь, отмечена white)
4) Glu 6 P - Val 99 H (водородная связь, отмечена white)
5) Glu 6 P - Gly 2 P (водородная связь, отмечена white, внутримолекулярное взаимодействие - остаток также принадлежит антигену).
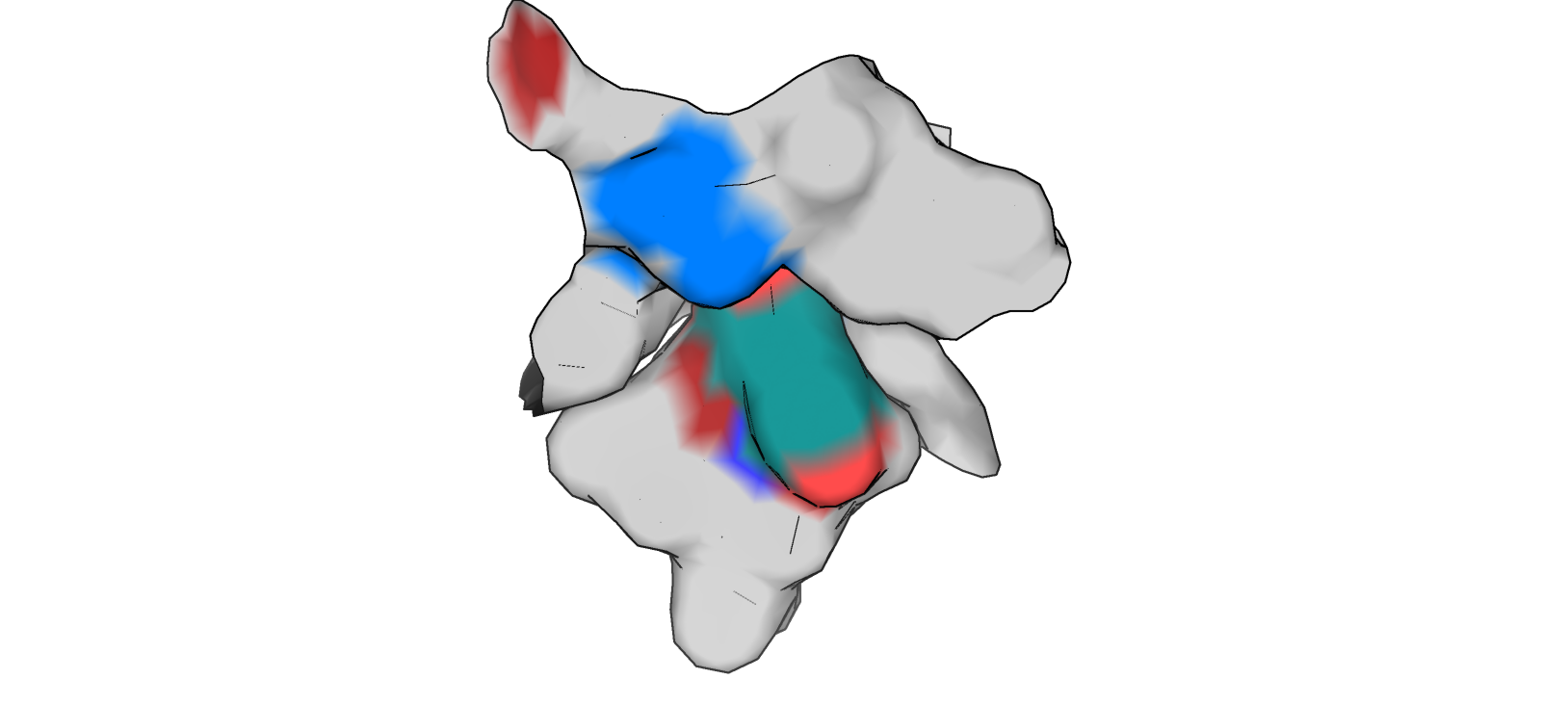
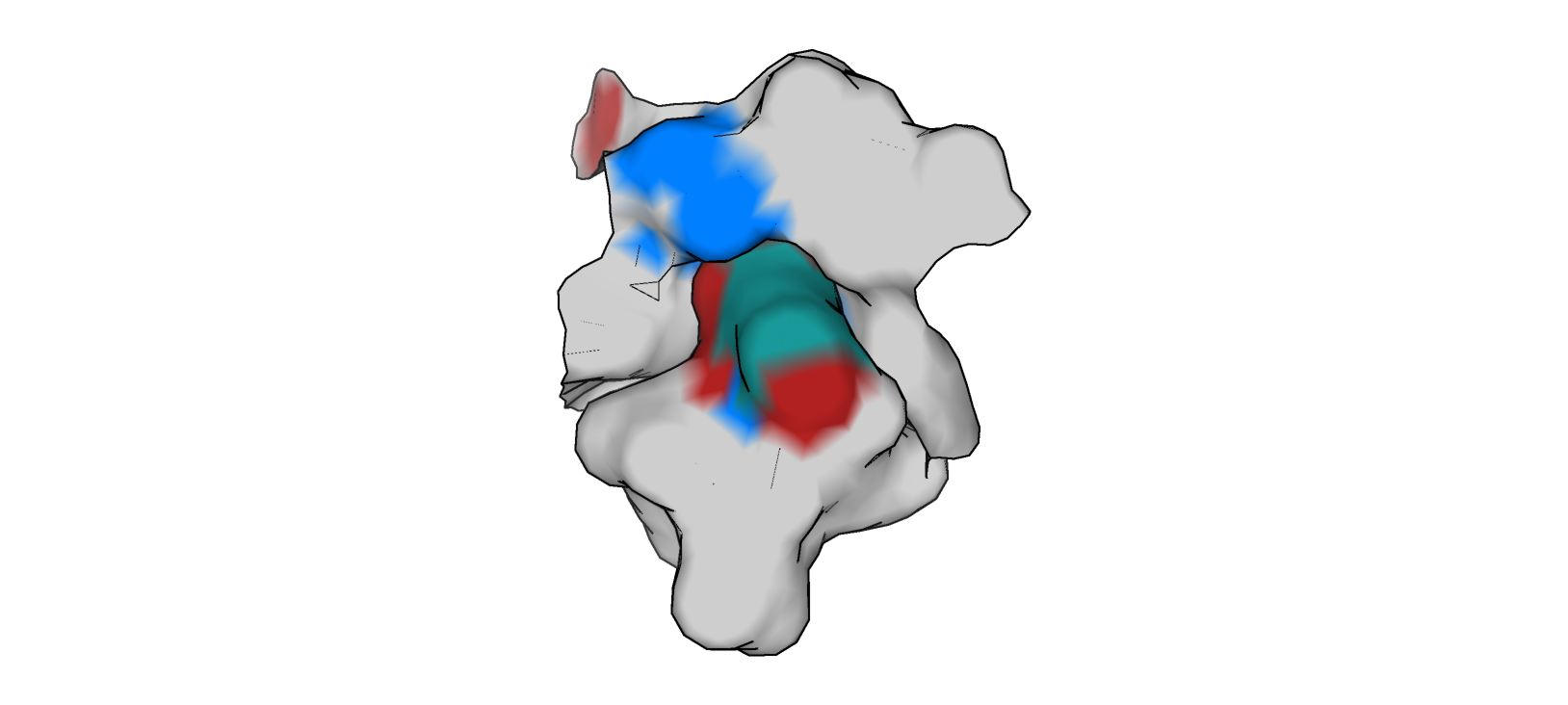
Оба ротамера, 1/27 (рис. 7) и 3/27 (рис. 8), формируют гидрофобные взаимодействия углеродным хвостом своего радикала с окружающими остатками (вероятно - Tyr 32 L, Tyr 98 H, Ser 97 H, Thr 95 H, Val 99 H).
Таким образом, опмтимальной заменой предложенного остатка (Gly 6 P) я считаю Glu 6 P (ротамер 1/27) .
Вторая структура - 0062 (Gly, позиция 390, цепь A).
При открытии структуры в PyMol и фокусировании на интересующем нам остатке глицина мы замечаем, что его альфа-углерод
обращен в достаточно небольшое пространство, ограниченное такими остатками как Tyr 94 L, Asp 93 L, Pro 95 L, Leu 96 L, Asn 92 L.
При отображении кармашка, в который обращен Gly 390 A в виде surface, получается следующее: рис. 9.
Таким образом, мы понимаем, что вероятно, исходно в рассматриваемой позиции был аминокислотный остаток с достаточно небольшим радикалом, например, серин или аланин.
При попытках мутировать глицин на серин были получены следующие ротамеры:
ротамер 1/3, strain=10.93 (35.5%)
ротамер 2/3, strain=15.56 (32.7%)
ротамер 3/3, strain=15.69 (32.0%)
Один из ротамеров формирует две водородные связи:
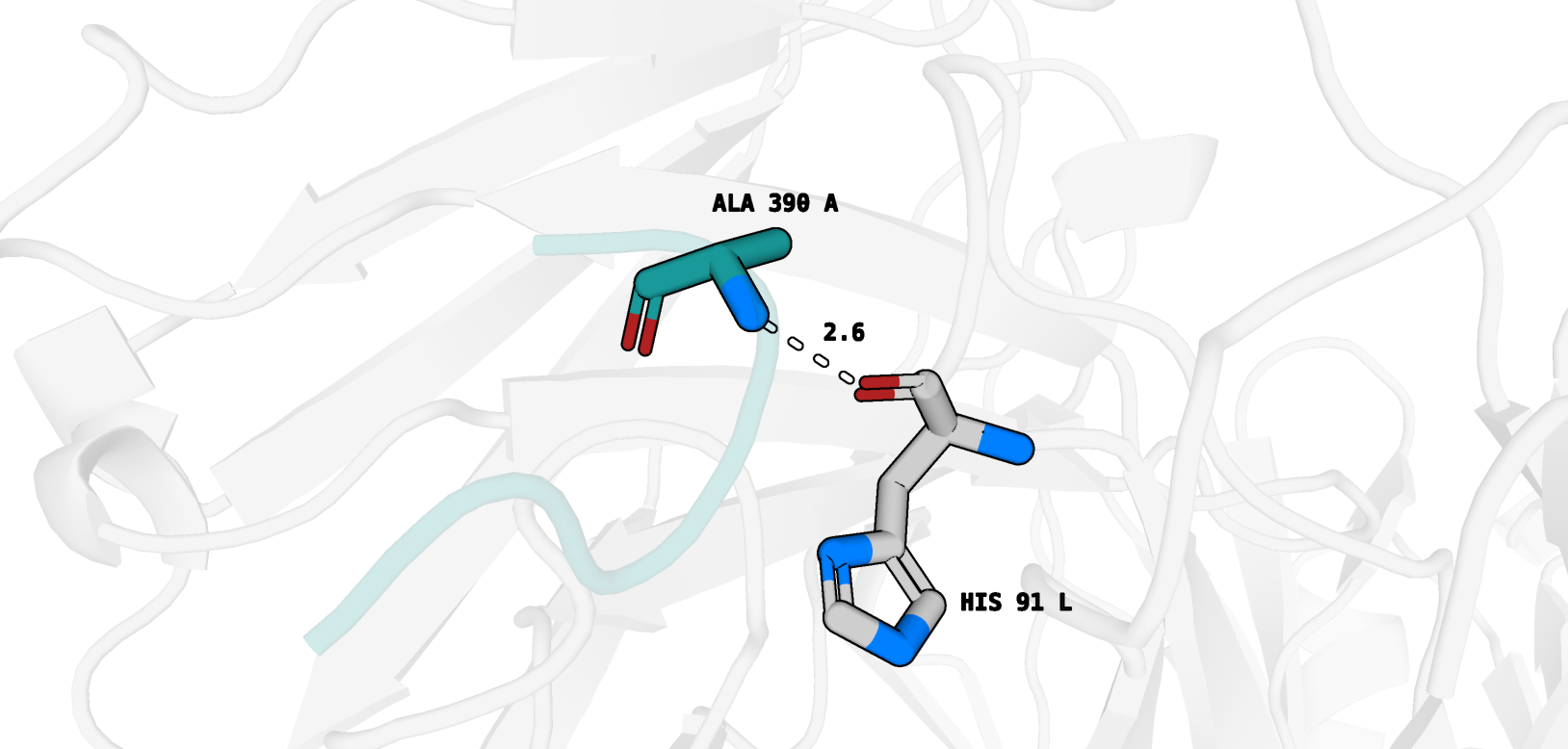
1) Ser 390 A (OG) - His 91 L (O), длина 3.1
2) Ser 390 A (N) - His 91 L (O), длина 2.9
Кроме того, для данного ротамера обнаруживается клэш с Ala 107 цепи H. В целом, вариант кажется неплохим, но аланин в данной позиции кажется более правильным,
так как не возникает клэшей. Также его небольшой метильный радикал достаточно хорошо помещается в уже показанный нами "кармашек" - рис. 10.
Стоит также отметить, что аланин не имеет ротамеров.
Таким образом, опмтимальной заменой предложенного остатка (Gly 390 A) я считаю Ala 390 A . Покажем также наличие водородной связи между остовным азотом нашего Ala 390 A и остовным кислородом His 91 L - рис. 11.