Поверхности, карманы, pKa
Задание 1. SASA, MSA
Для работы использовалась слежующая пара структур: 2BG1 (закрытая форма) и
2FFF (открытая форма). Наложение структур посредством super (рис. 1) показывает, что открытая и закрытая
формы достаточно хорошо соответствуют друг другу за исключением некоторых участков.
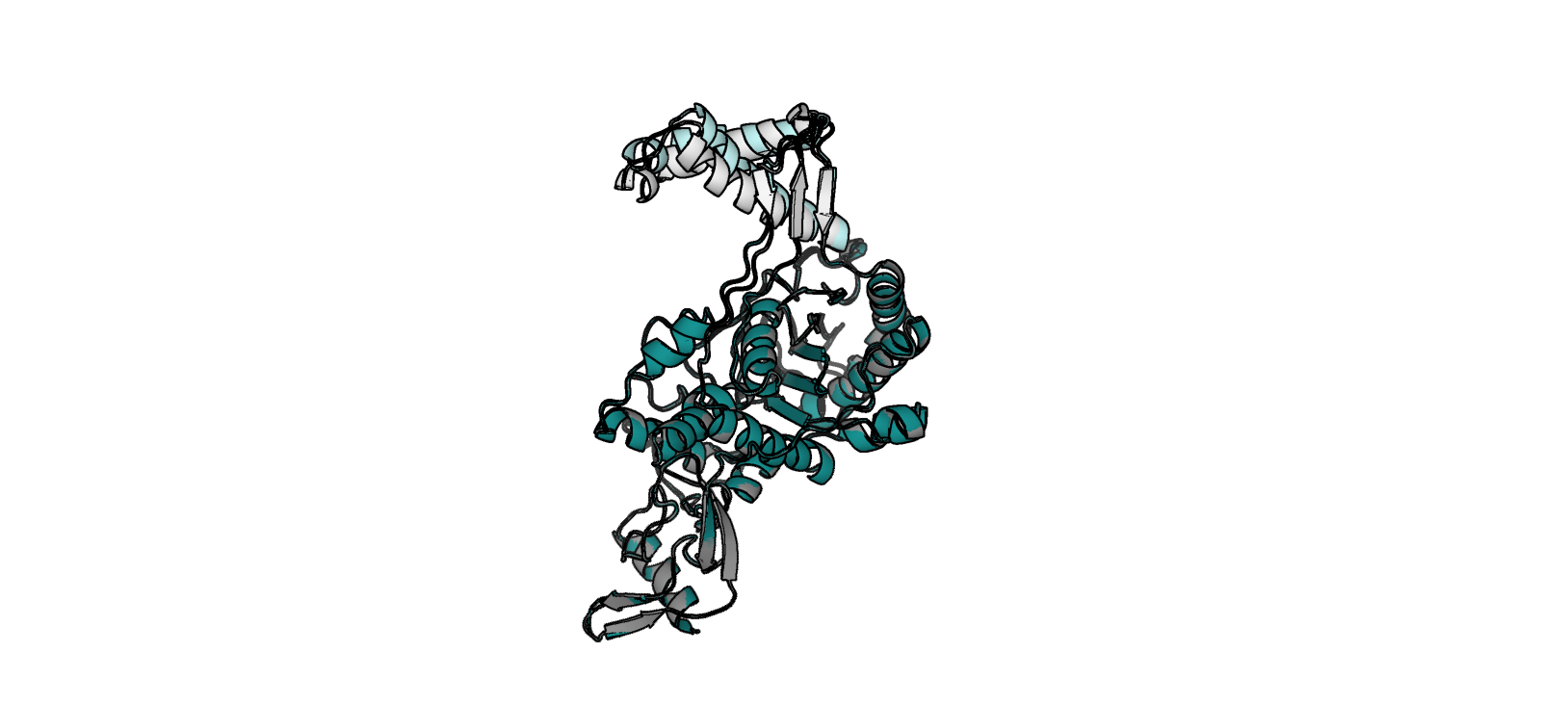
Компонента 1:
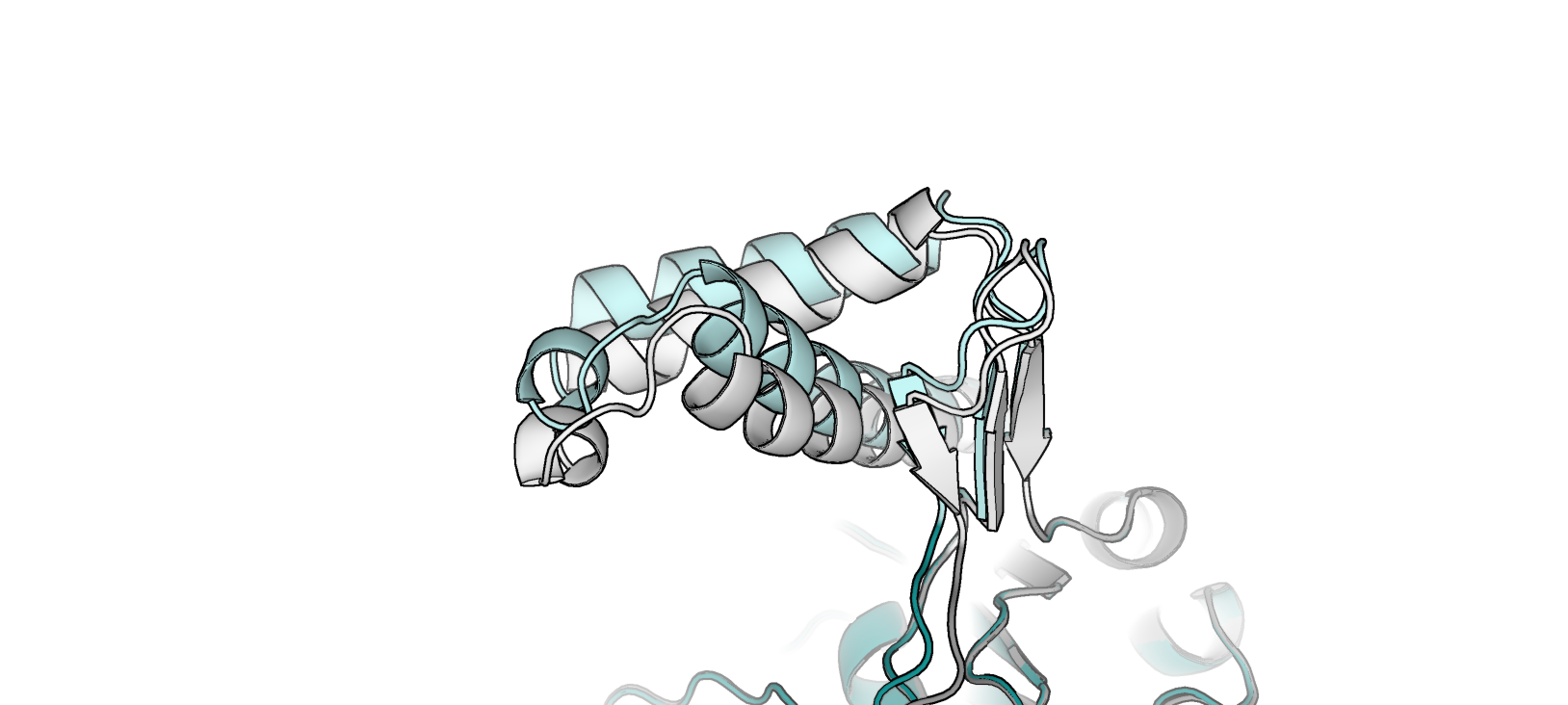
- Участок цепи B, остатки 338 - 392 (альфа-спираль - петля - участок бета-слоя), отмечен white в 2fff и palecyan в 2bg1 (рис. 2)
- Участок цепи B, остатки 585 - 599 (участок бета-слоя), отмечен white в 2fff и palecyan в 2bg1 (рис. 3)
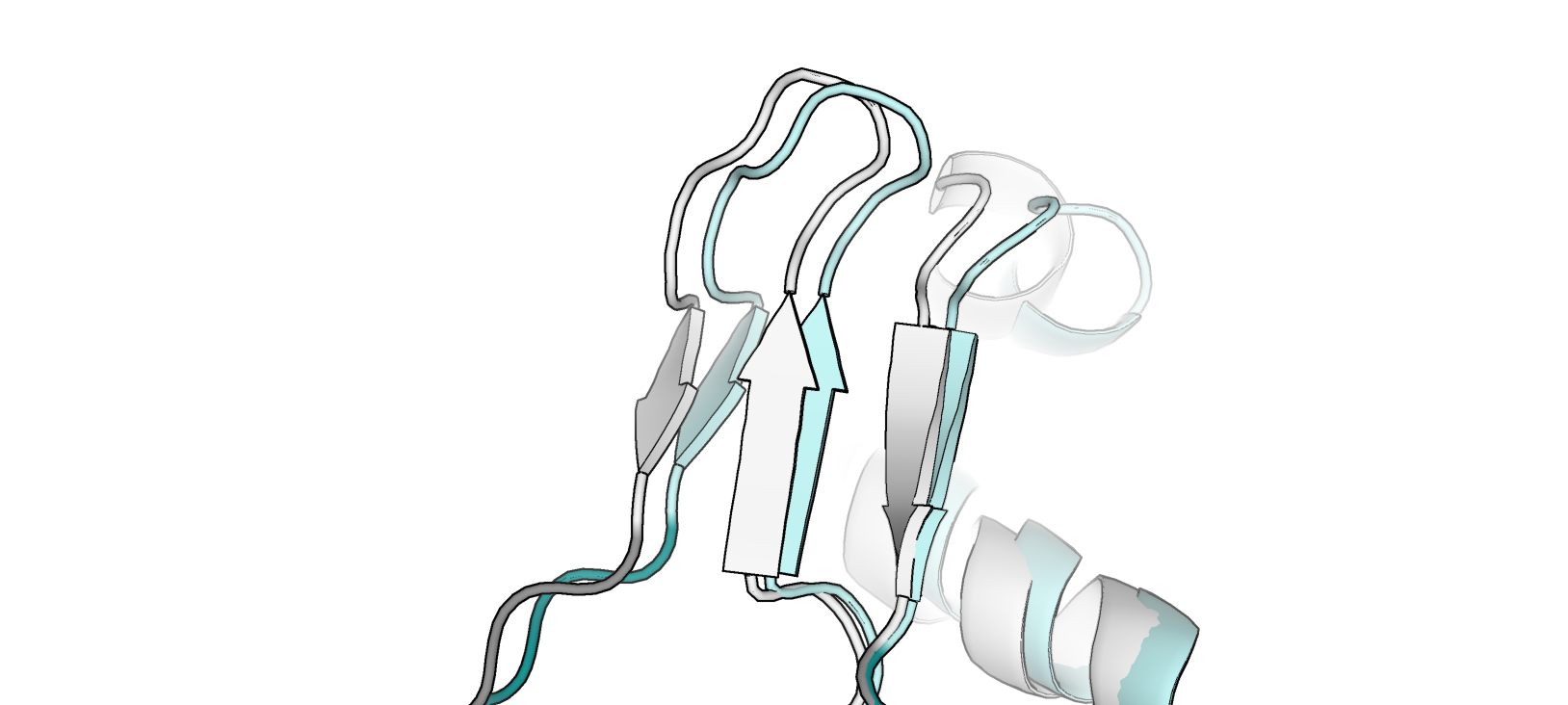
- Остатки 414–421 (петля)
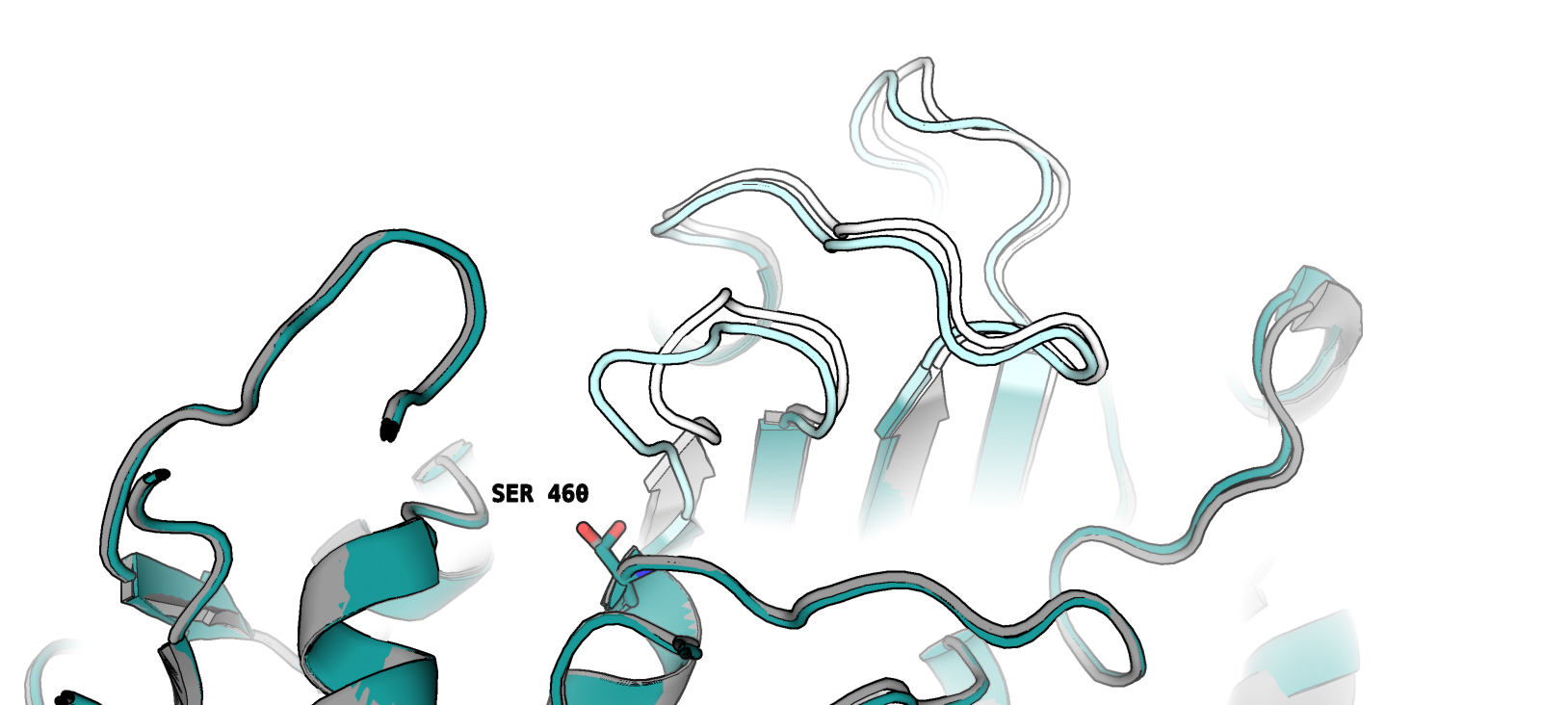
- Остатки 653–660 (петля)
- Остатки 677–687 (петля)
Примечательно, что эти участки упоминаются в одной статье как петли активного сайта рассматриваемого нами белка. Авторы пишут о том, что наибольшие различия в структуре открытой и закрытой форм выражены в положении этих петель. Также, в качестве важного для каталитической функции остатка, авторами статьи упоминается Ser460 (он также изображен на рисунке).
Вычислим для обеих форм площадь молекулярной поверхности и площадь поверхности, доступной растворителю. Получим следующие значения:
Открытая форма:
MS: 45060.945 Angstroms^2
SAS: 20039.553 Angstroms^2
Закрытая форма:
MS: 44713.090 Angstroms^2
SAS: 19618.199 Angstroms^2
Результат кажется вполне себе обоснованным - 2FFF представляет собой открытую форму транспептидазного домена трансферазы, и
мы видим, что ее рассчитанные значения площадей - и MS (площадь молекулярной поверхности), и SAS (площадь поверхности,
доступной растворителю) больше, чем рассчитанные площади закрытой формы (2BG1). То-есть, по-видимому, в закрытой форме действительно происходит
"заслонение" некоторого участка поверхности белка, без возникновения экспонированности (либо эта экспонированность не столь значительна) каких-либо частей рассматриваемой нами молекулы.
Задание 2. Карманы, объем
В этом задании нам было интересно определить возможные карманы связывания посредством сервиса fpocket, предположить, какие варианты из предложенных в выдаче могут иметь под собой биологическое обоснование. Для 2BG1 сервис выделил 32 кармана, для 2FFF - 26. Рассмотрим один из карманов, который визуально достаточно хорошо соответствует определенному участку в обеих формах белка (отметим, что в каждой из структур, карман, который мы будем обсуждать далее, определен под разным номером) - рисунок 5.
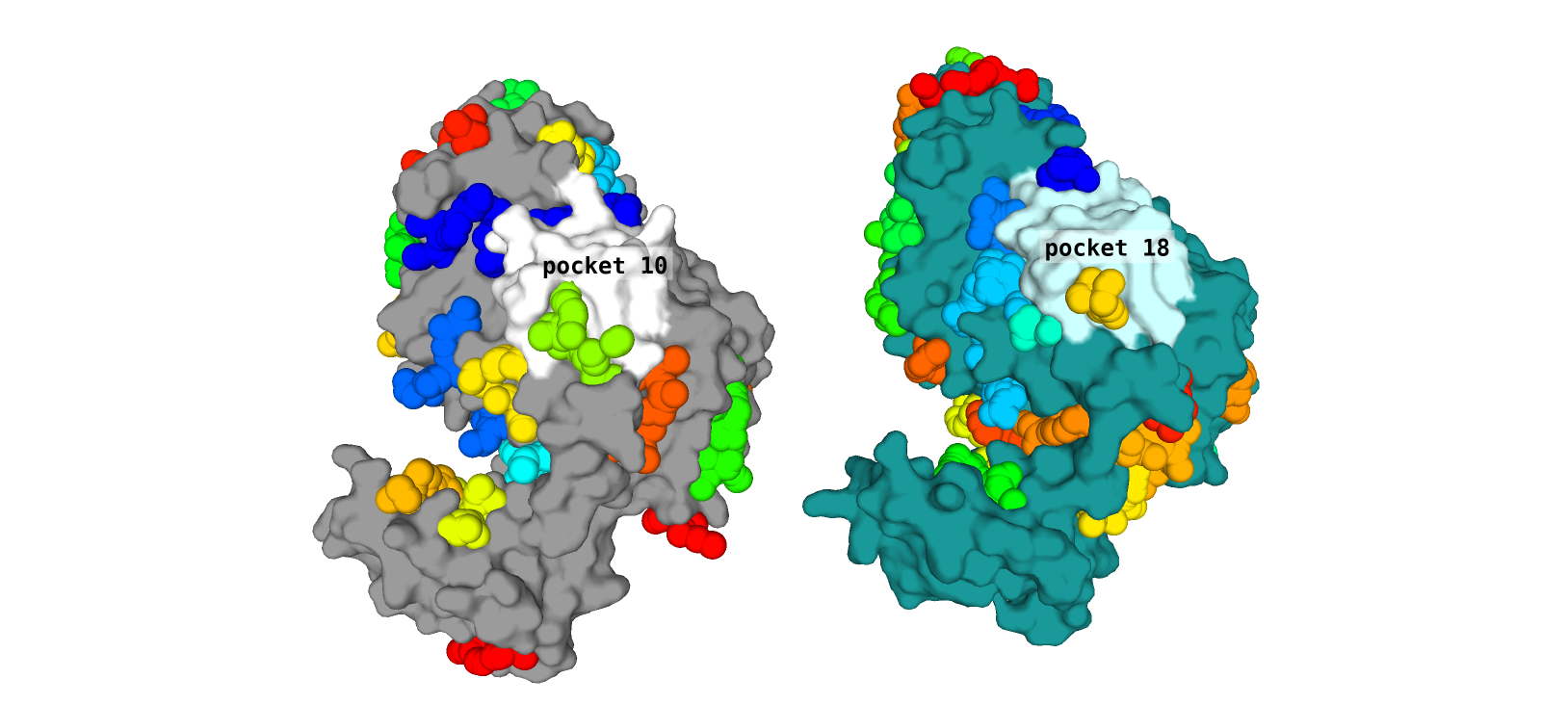
Примечательно, что по положению карманы 10 структуры 2FFF и 18 структуры 2BG1 соответствуют упомянутому в статье активному центру. Приведем значения объема для рассматриваемого
нами кармана, которые были получены из аннотации (поле HEADER 8 - Real volume (approximation)):
Pocket 10 (2FFF, открытая форма): 1870.0350
Pocket 18 (2BG1, закрытая форма): 1281.9022
Мы видим, что объем кармана меньше в закрытой форме, что достаточно логично. Можно предположить, что закрытие кармана опосредовано смещением трех описанных нами ранее петель,
которые закрывают область активного сайта.
Задание 3. Экспонированность
В этом задании нам было интересно посмотреть на изменение экспонированности аминокислотных остатков при переходе между открытой и закрытой формой
рассматриваемого нами белка. Комментарии по заданию, графики и заметки доступны по ссылке.
Приведем изображение окружения остатка, для которого характерно наибольшее (по модулю) изменение в экспонированности при переходе между формами
(Val361):
1) открытая форма - рис. 6
2) закрытая форма - рис. 7
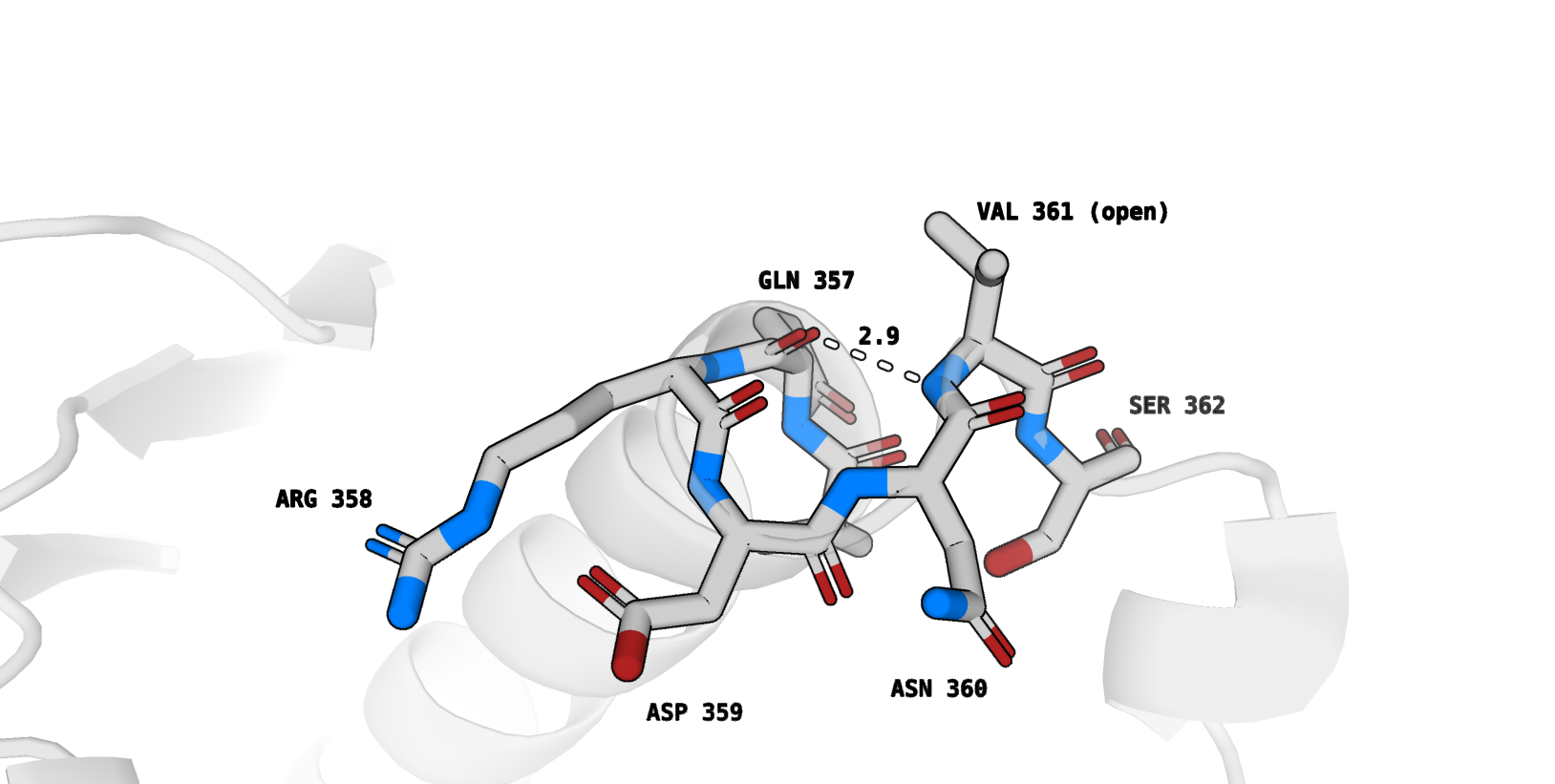
В открытой форме боковой радикал Val361 экспонируется на поверхности, его остовный азот формирует водородную связь с остовным кислородом Gln357.
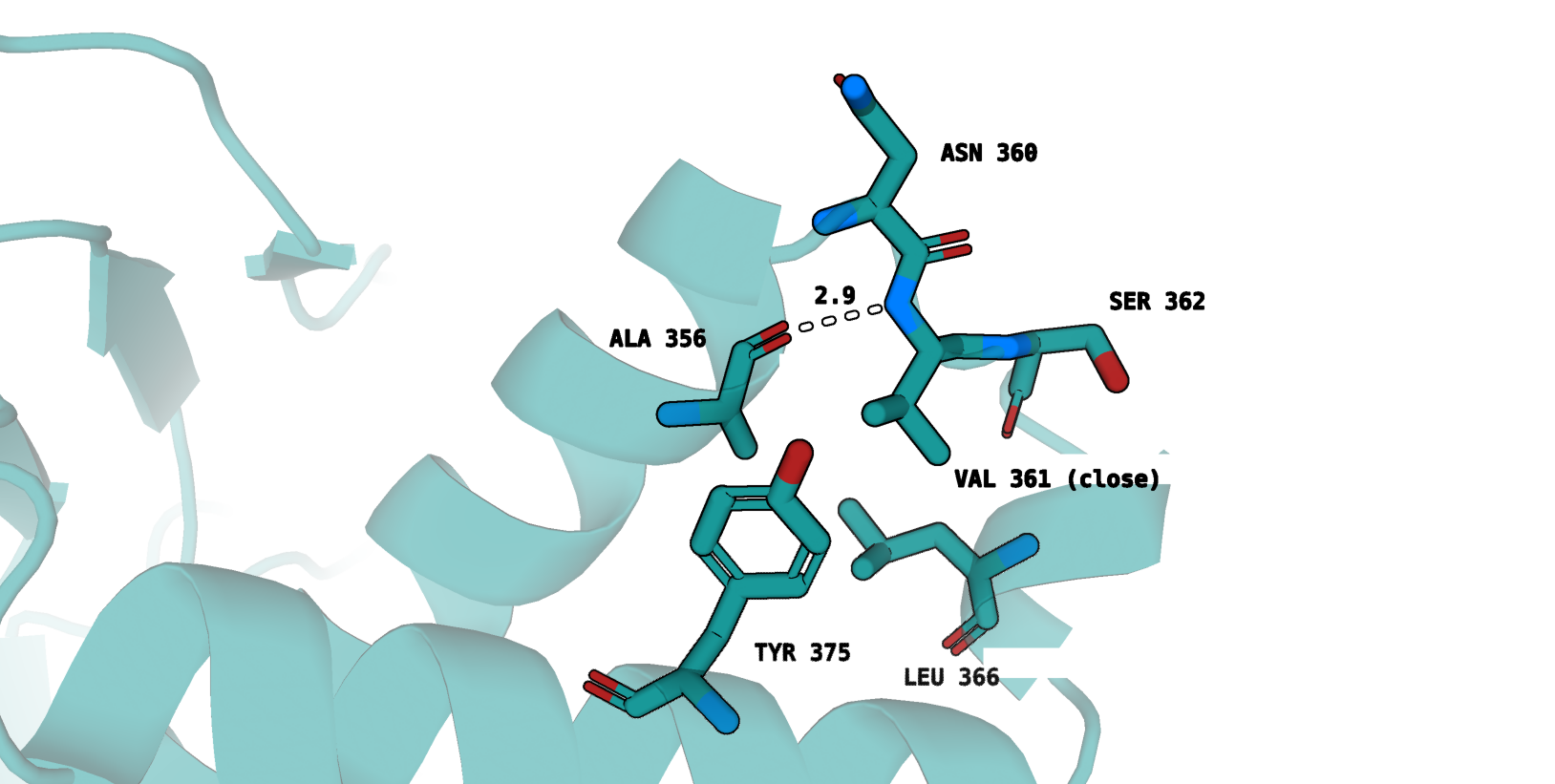
В закрытой форме, напротив, боковой радикал Val361 обращен внутрь белковой глобулы и характеризуется, как кажется, достаточно хорошим
гидрофобным окружением - Tyr375, Leu366, Ala356. Остовный азот валина формирует водородную связь с остовным кислородом Ala356.
Интересно, что остаток с наибольшим изменением экспонированности при переходе между формами принадлежит первой определенной нами ранее (в задании 1)
компоненте. По-видимому, этот участок молекулы может играть значимую роль в выполнении белком его функций. Быть может, компонента 1 - некий аллостерический центр
рассматриваемого нами белка (но это не более чем предположение).