Описание структуры 3х альфа-спиральных ТМ белков и 3х ТМ бета-баррелей
| PDB код | Тип
(спираль, баррель) |
Число цепей,
образующих одну ТМ единицу (баррель или набор спиралей) |
Число трансмембранных участков в ТМ единице | Число остатков в одном трансмембранном участке
(типичное, минимальное, максимальное) |
Толщина мембраны в ангстремах | Наклон спиралей/тяжей к нормали | Какая мембрана, организм, "код транспортера", функция белка |
| 2dhh | спираль | 3 | по 12 от каждой цепи (36) | типичное 19, минимальное 17, максимальное 23 | 29.0 | 1° | Во внутренней мембране Escherichia coli 2.A.6.2.2 транспортер малых молекул через мембрану |
| 3p5n | спираль | 1 | 6 | типичное 18, минимальное 10, максимальное 26 | 30.6 | 6 ± 4° | 2.A.87 (TCDB)-транспорт прокариотического рибофлавина через плазматическую мембрану Staphylococcus aureus. |
| 3abv | спираль | 1 | 3 | типичное 20, минимальное 19, максимальное 25 | 29.8 | 3 ± 6° | 5.A.3 (TCDB)-сукцинатдегидрогеназа (II комплекс дыхательной цепи) во внутренней митохондриальной мембране Sus scrofa |
| 3aeh | баррель | 1 | 12 | типичное 10, минимальное 8, максимальное 12 | 25.2 | 4 | 1.B.12 (TCDB)- автотранспорт через внешнюю мембрану Escherichia coli гемоглобин-связанной протеазы Hbp |
| 1g90 | баррель | 1 | 8 | типичное 9, минимальное 8, максимальное 11 | 25.4 | 11 ± 1° | 1.B.6 (TCDB), используется Escherichia coli для коньюгации и поддержания структуры внешней мембраны |
| 1wp1 | баррель | 3 | 12 | типичное 9, минимальное 5, максимальное 9 | 24.7 | 0 | 1.B.17 (TCDB)транспортирует лекарства через внешнюю мембрану Pseudomonas aeruginosa |
По данным Lipid Composition Atlas толщина внутримембранной части ТМ белков значительно варьирует (примерно от 7 до 40 ангстрем) в зависимости от организма и типа мембраны.
Для архей: примерно 28-32 ангстрем;
для внешей мембраны грамм-отрицательных бактерий: примерно 23-26;
для внутренней мембраны грамм-отрицательных бактерий: примерно 28-31;
для внутренней мембраны митохондрий: примерно в диапазонах 6-8 и 27-30;
для плазматической мембраны эукариот - значения сильно колеблются;
Длина трансмембранных участков баррелей в 2 раза меньше (по числу остатков) длины трансмембранных спиралей засчет более компактной структуры спирали. Длина трансмембранного участка α-спирали около 20 ангстрем, а баррелей около 10.
Аннотация трансмембранных участков белка A1JHZ2
По данным записи Uniprot: TCDB 2.A.4.; семейство белков, участвующих в диффузии катионов (CDF);трансмембранные участки: 12-32, 40-60, 82-102, 114-134, 164-184;
цитоплазматические участки: не указаны;
внеклеточные участки: не указаны.
Результат TMHMM
# uniprot_A1JHZ2_FIEF_YERE8 Length: 300 # uniprot_A1JHZ2_FIEF_YERE8 Number of predicted TMHs: 6 # uniprot_A1JHZ2_FIEF_YERE8 Exp number of AAs in TMHs: 125.91911 # uniprot_A1JHZ2_FIEF_YERE8 Exp number, first 60 AAs: 44.16728 # uniprot_A1JHZ2_FIEF_YERE8 Total prob of N-in: 0.99549 # uniprot_A1JHZ2_FIEF_YERE8 POSSIBLE N-term signal sequence uniprot_A1JHZ2_FIEF_YERE8 TMHMM2.0 inside 1 11 uniprot_A1JHZ2_FIEF_YERE8 TMHMM2.0 TMhelix 12 34 uniprot_A1JHZ2_FIEF_YERE8 TMHMM2.0 outside 35 37 uniprot_A1JHZ2_FIEF_YERE8 TMHMM2.0 TMhelix 38 60 uniprot_A1JHZ2_FIEF_YERE8 TMHMM2.0 inside 61 79 uniprot_A1JHZ2_FIEF_YERE8 TMHMM2.0 TMhelix 80 102 uniprot_A1JHZ2_FIEF_YERE8 TMHMM2.0 outside 103 116 uniprot_A1JHZ2_FIEF_YERE8 TMHMM2.0 TMhelix 117 139 uniprot_A1JHZ2_FIEF_YERE8 TMHMM2.0 inside 140 157 uniprot_A1JHZ2_FIEF_YERE8 TMHMM2.0 TMhelix 158 175 uniprot_A1JHZ2_FIEF_YERE8 TMHMM2.0 outside 176 179 uniprot_A1JHZ2_FIEF_YERE8 TMHMM2.0 TMhelix 180 199 uniprot_A1JHZ2_FIEF_YERE8 TMHMM2.0 inside 200 300
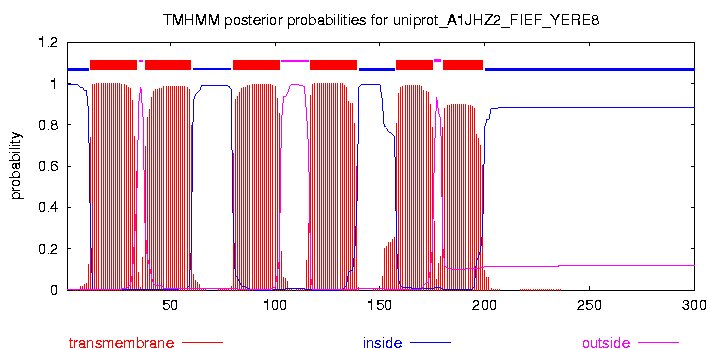
Сравнение с гомологом FIEF_ECOLI (PDB ID: 3H90)
трансмембранные участки: 12-34, 38-60, 80-102, 117-139, 158-175, 180-199;
цитоплазматические участки: 1-11, 61-79, 140-157, 200-300;
внеклеточные участки: 35-37, 103-116, 176-179.
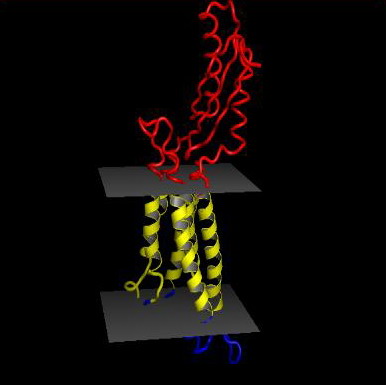
Гомолог содержит 6 спиральных участков, пронизывающих мембрану, примечательно,
что для результаты TMHMM для моего белка совпадают с анализом гомолога.
Выравнивание также подтвердило, что результаты TMHMM и анализа гомолога совпадают, а вот результаты Uniprot незначительно отличаются. По данным Uniprot мой белок насчитывает не 6, а пять трансмембранных участков, из них первые 4 почти совнадают с данными других анализов (разницу в несколько аминокислотных остатков считаю незначительной), а вот пятый указан в середине между пятым и шестым приведенным в TMHMM для моего белка и в гомологе, всвязи с этим считаю, что анализ TMHMM дает более точные данные.