Измерение торсионных углов остатка 19 в белке THIE_BACSU, цепь А.
|
Название
двугранного угла |
Угол определяется по координатам атомов |
Данный угол описывает поворот вокруг связи |
Результат измерения
с помощью RasMol |
| φ |
|
N19 - Cα19 | -63.52 |
| ψ |
|
Cα19 - C19 | -35.25 |
| ω |
|
C19 - N20 | 179.15 |
Измерение угла φ
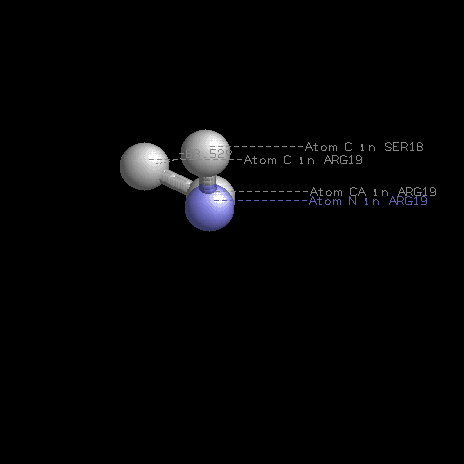
Карты Рамачандрана для различных множеств аминокислотных остатков белка THIE_BACSU
(по вертикали отложен угол ψ , по горизонтали - φ)
- Все остатки:
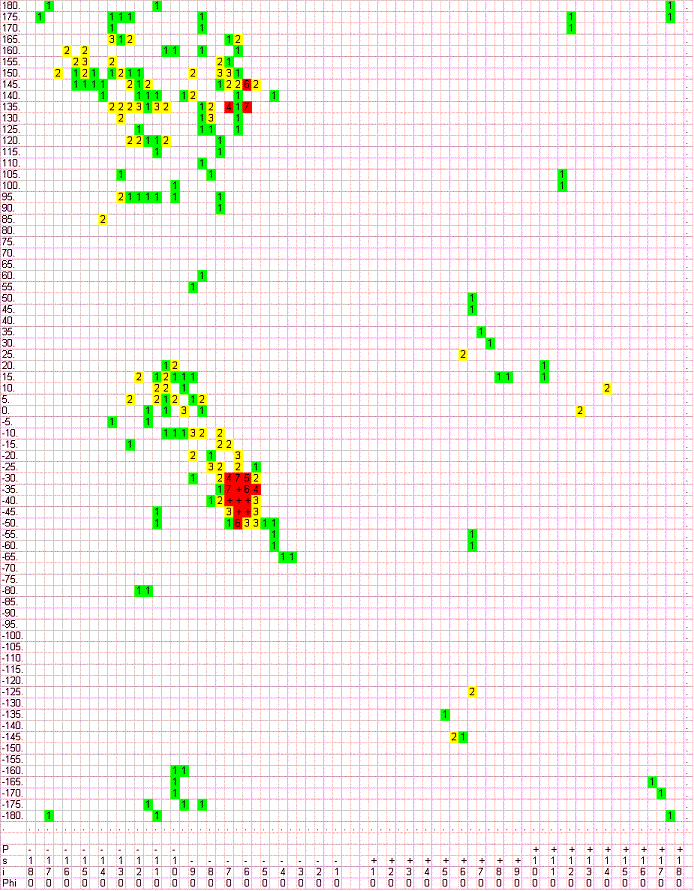 Как несложно понять, карты для любого множества остатков будут являться подмножествами такой карты Рамачандрана. Поэтому на данной карте можно оценить, какие значения углов в молекуле в принципе встречаются.
Как несложно понять, карты для любого множества остатков будут являться подмножествами такой карты Рамачандрана. Поэтому на данной карте можно оценить, какие значения углов в молекуле в принципе встречаются. - Все остатки пролина:
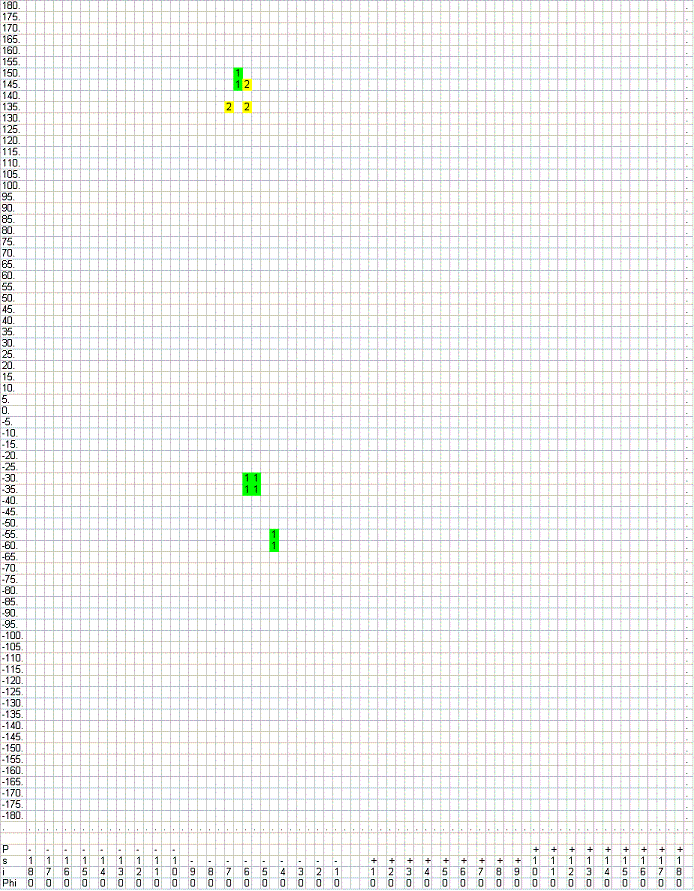 Значения углов для пролина, как будет заметно ниже, имеют частичное сходство с α-спиралями (в области φ~-60o, ψ~-30o), но не пересекаются со значениями углов для β-листов, значит, скорее всего пролин используется в спиралях и почти не встречается в листах.
Значения углов для пролина, как будет заметно ниже, имеют частичное сходство с α-спиралями (в области φ~-60o, ψ~-30o), но не пересекаются со значениями углов для β-листов, значит, скорее всего пролин используется в спиралях и почти не встречается в листах. - Все остатки глицина:
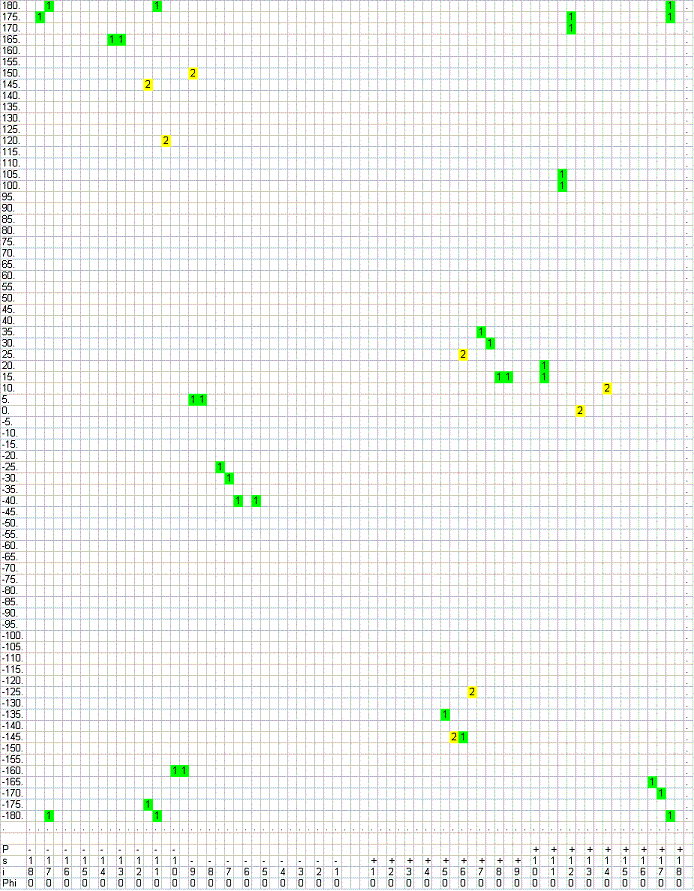 Значения углов для глицина, как будет видно в дальнейшем, имеют частичное сходство и с α-спиралями (в областях наиболее часто встречающихся значений углов), и с β-листами (в предельных значениях углов), следовательно, глицин должен в достаточном количестве входить в эти структуры.
Значения углов для глицина, как будет видно в дальнейшем, имеют частичное сходство и с α-спиралями (в областях наиболее часто встречающихся значений углов), и с β-листами (в предельных значениях углов), следовательно, глицин должен в достаточном количестве входить в эти структуры. - Все остатки в α-спиралях:
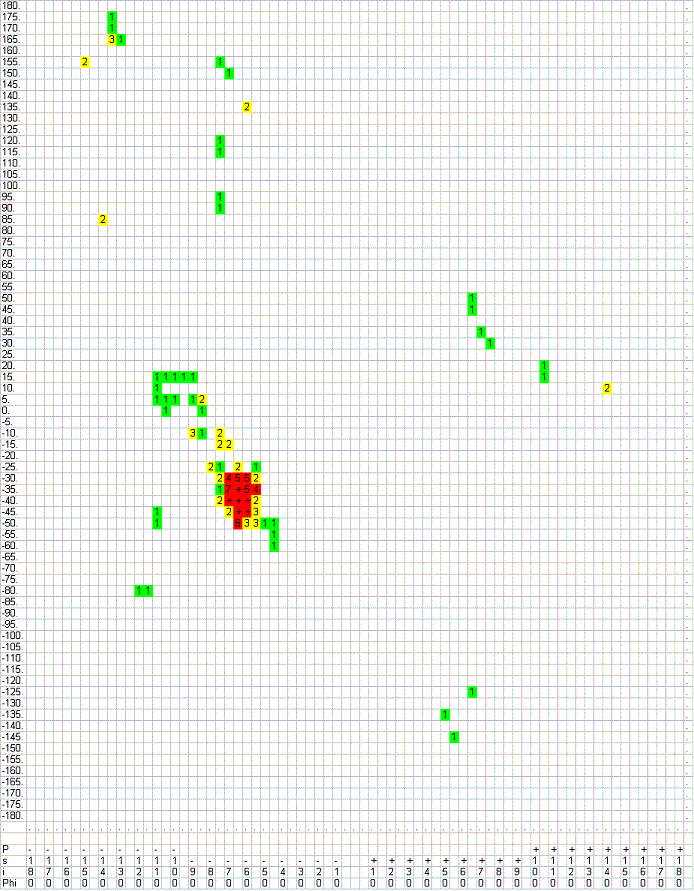 α-спирали обычно имеют углы -60o>φ>-90o, -30o>ψ>-60o, которые, по-видимому, характеризуют математические параметры спирали (период исчерченности и пр).
α-спирали обычно имеют углы -60o>φ>-90o, -30o>ψ>-60o, которые, по-видимому, характеризуют математические параметры спирали (период исчерченности и пр). - Все остатки в β-листах:
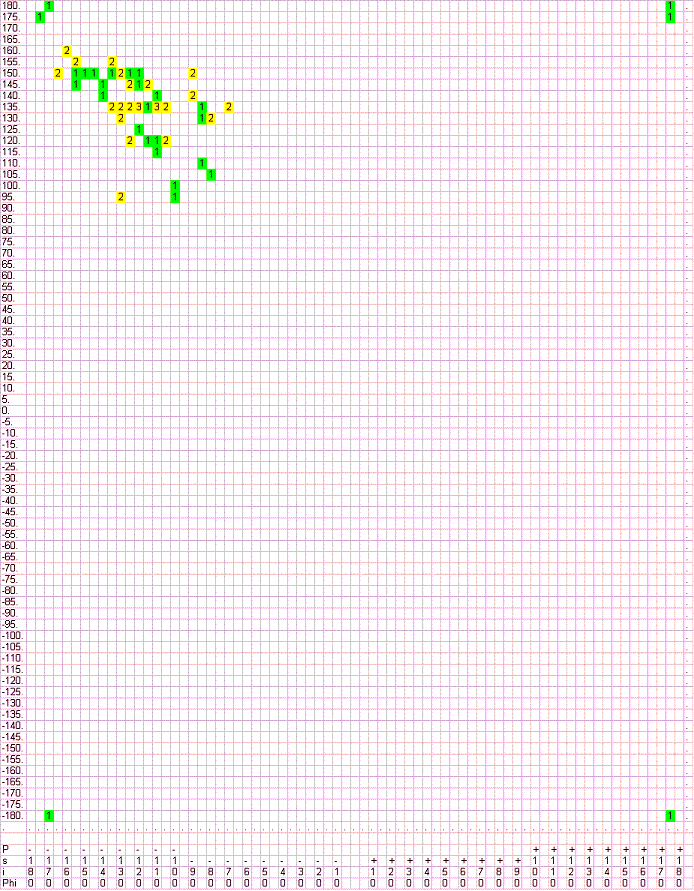 Для β-листов, как видим, свойственны углы φ<-60o и ψ>90o, а также предельные случаи, когда углы φ и ψ равны +/- 180 (соответствующие резким поворотам в этих слоях).
Для β-листов, как видим, свойственны углы φ<-60o и ψ>90o, а также предельные случаи, когда углы φ и ψ равны +/- 180 (соответствующие резким поворотам в этих слоях).
Наиболее часто встречающиеся значения для углов: φ - <-30o (с пиком около -60o), а также от 60o до 90o (намного реже); ψ - <-160o (относительно немного), от -60o до 30o и >90o.
Угол φ для пролина в данном случае принимает значения около -60o - -70o
Дело в том, что глицин, как самая маленькая из всех аминокислот, предоставляет наибольшую (пусть и не абсолютную) свободу в расположении соседних а.о. в белке. Боковая группа глицина (атом водорода) практически не мешает соседним боковым группам изгибаться необходимым способом, для построения сложной структуры, такой, как α-спираль или β-тяж. Т.е. наличие глицина практически необходимо для построения этих структур.
Дополнительная информация:
Карты Рамачандрана в формате Excel