| Главная страница | Обучение | Обо мне | Ссылки |
Совмещение структур | |||
|
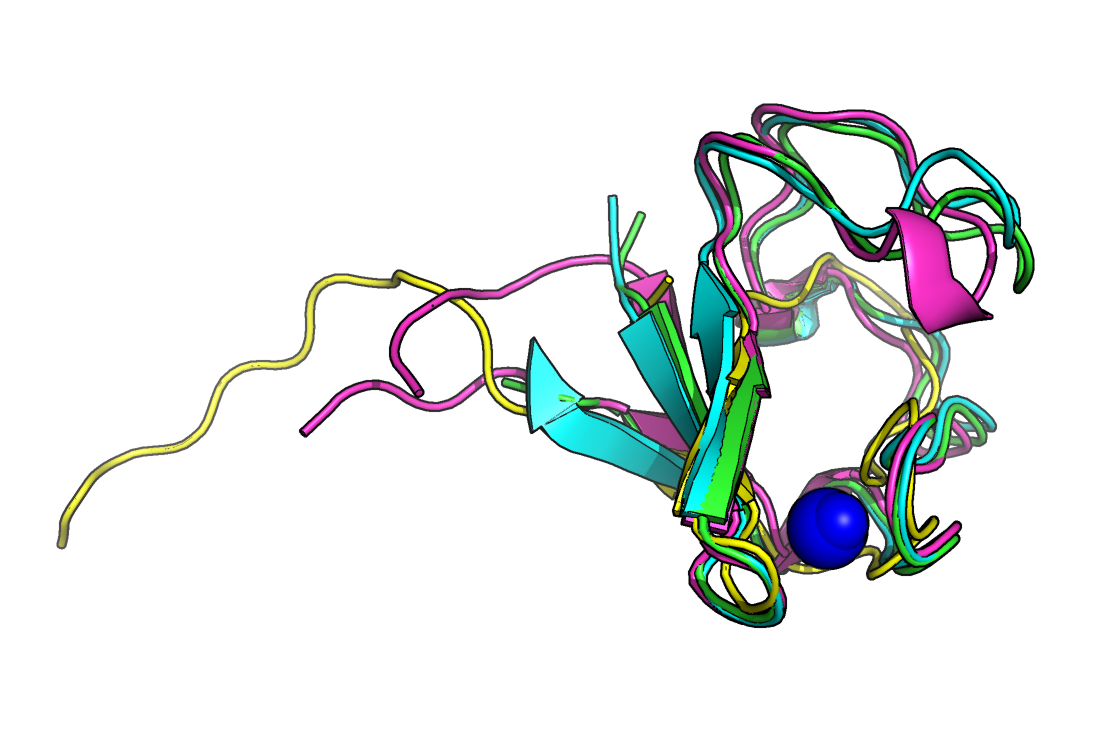
Для белка рубредоксина (PDB ID 1FHH) были найдены 3 структурных гомолога с помощью сервиса PDBeFold, которые приведены в таблице на Рис.1. В приведенной таблице первые 2 гомолога - рубредоксины из других микроорганизмов, а последний - субъединица РНК-полимераз дрожжей. Выбранные совмещенные структуры приведены на Рис. 2. Структурное выравнивание, построенное в PDBeFold, приведено в файле.
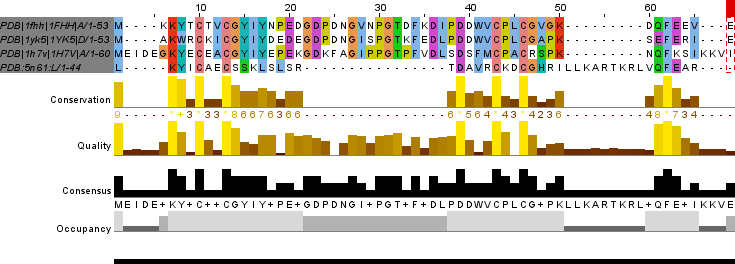
Структурное выравнивание, построенное в PDBeFold, приведено в файле и на Рис. 3. Также было построено обычное выравнивание без учета структуры в JalView с помощью программы Tcoffee (Рис. 3 и в файле). Судя по Рис. 2 и Рис. 3, структурное выравнивание не очень хорошего качества - не везде хорошо выравнены элементы вторичной структуры, хотя петли наложены неплохо - за исключением свободного С-конца. Тем не менее, консервативными оказались (логичным образом) цистеины, координирующие двухвалентный атом металла (железа в рубредоксинах и цинка - в РНК-полимеразе). Кроме них, консервативными оказались лизин в начале всех цепей и некоторые позиции с гидрофобными остатками (Рис. 3).
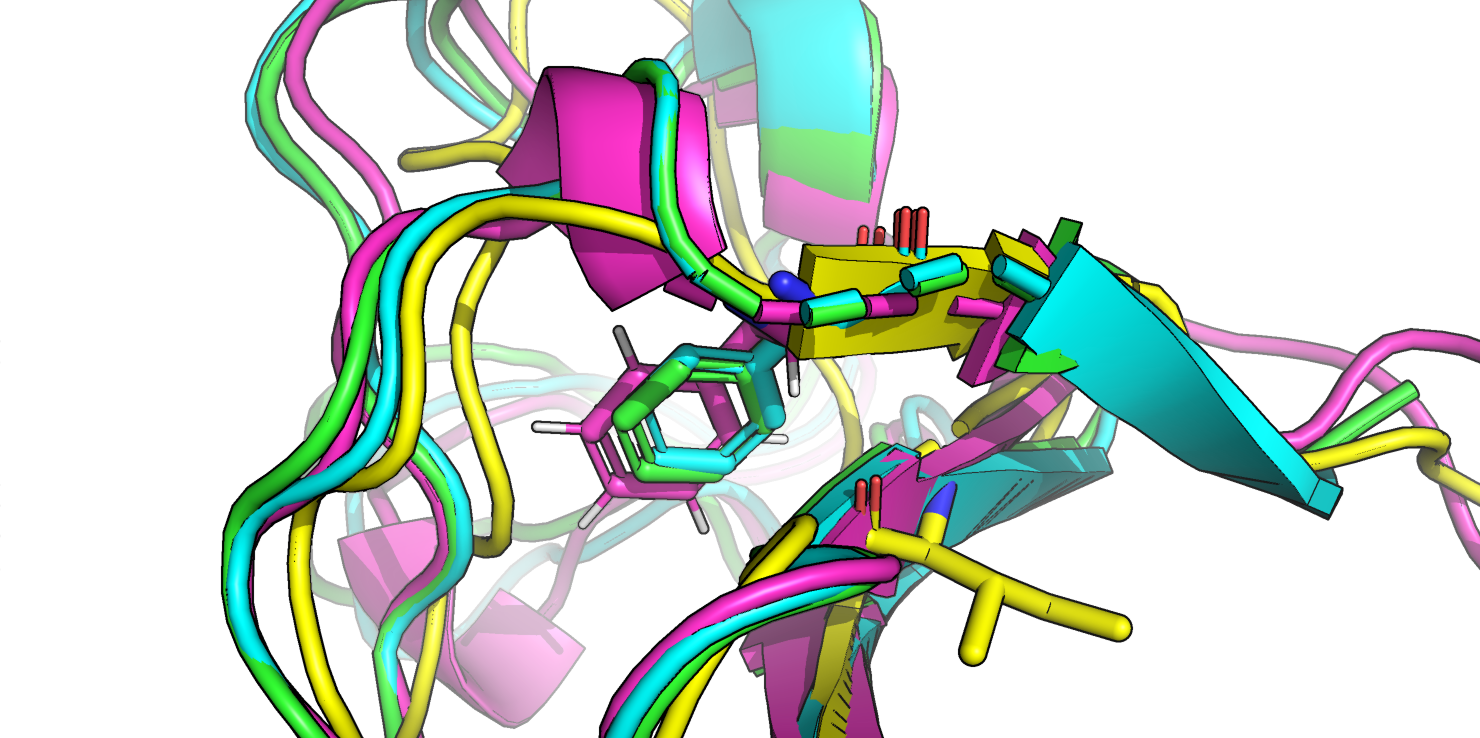
Отличия между выравниваниями имеются, и их довольно много. В выравнивании по последовательности (результат Tcoffee) больше консервативных позиций - помимо цистеинов, например, для всех 4 структур совмещены глутаматы D39, а также колонка с фенилаланинами на С-конце (F62) и первая позиция - M/L1. В обоих выравниваниях также выделена колонки с ароматическими аминокислотами (Y/W8). В целом, конечно, хорошо видно, что белок не-рубредоксин портит картину выравнивания в обоих случаях и рубредоксины очень похожи между собой (много позиций, где консервативны остатки именно для первых 3 последовательностей). Структурное выравнивание сместило С-концевой фрагмент РНК-полимеразной субъединицы 5N61, ради выравнивания лейцина с фенилаланинами других структур. При этом видно, что сами остатки не накладываются друг на друга и, таким образом, структурное выравнивание в этом месте проигрывает выравниванию по последовательности (Рис. 4).
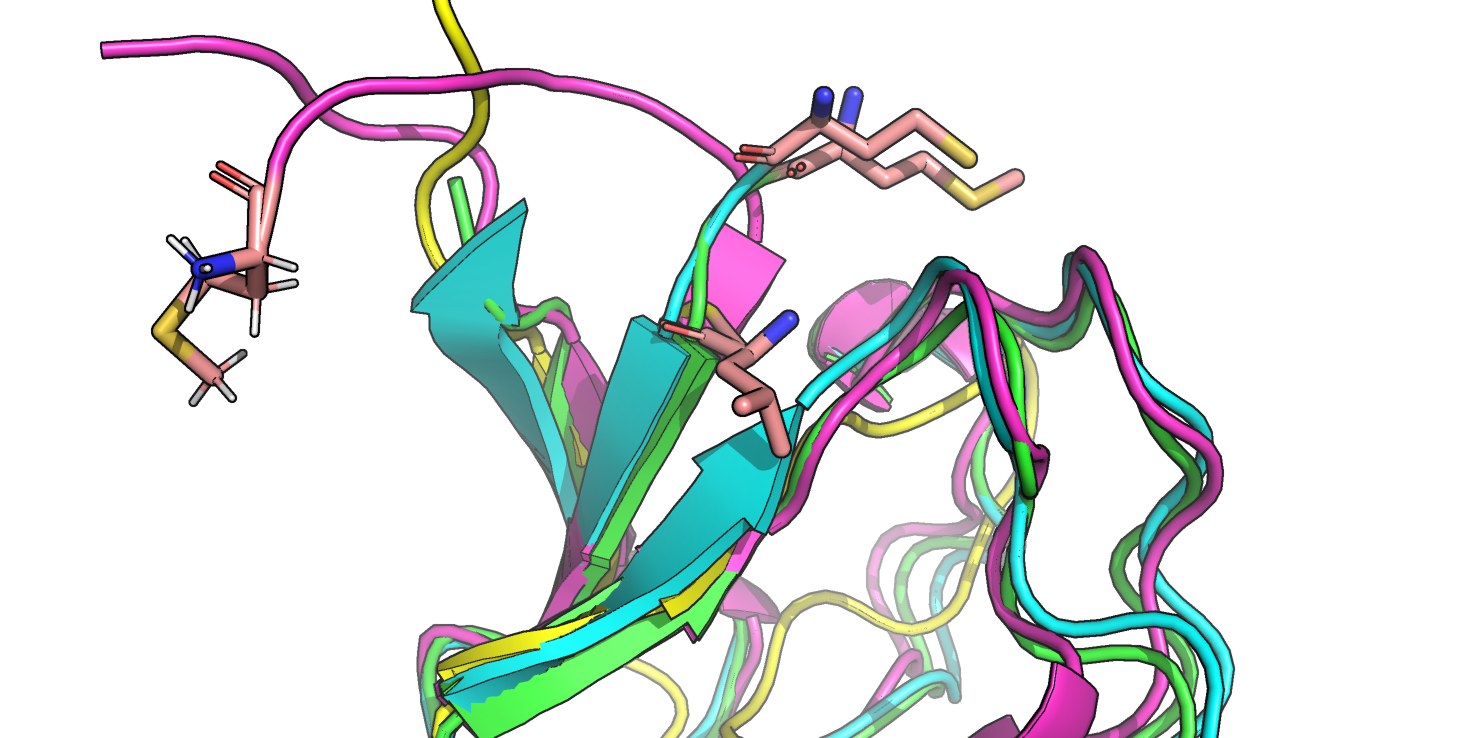
Зато в том, что касается выравнивания N-концевого аминокислотного остатка, структурное выравнивание оказалось точнее, поскольку, несмотря на общность функциональных свойств метионина и лейцина (гидрофобность), они находятся в разных местах в пространстве (Рис. 5).
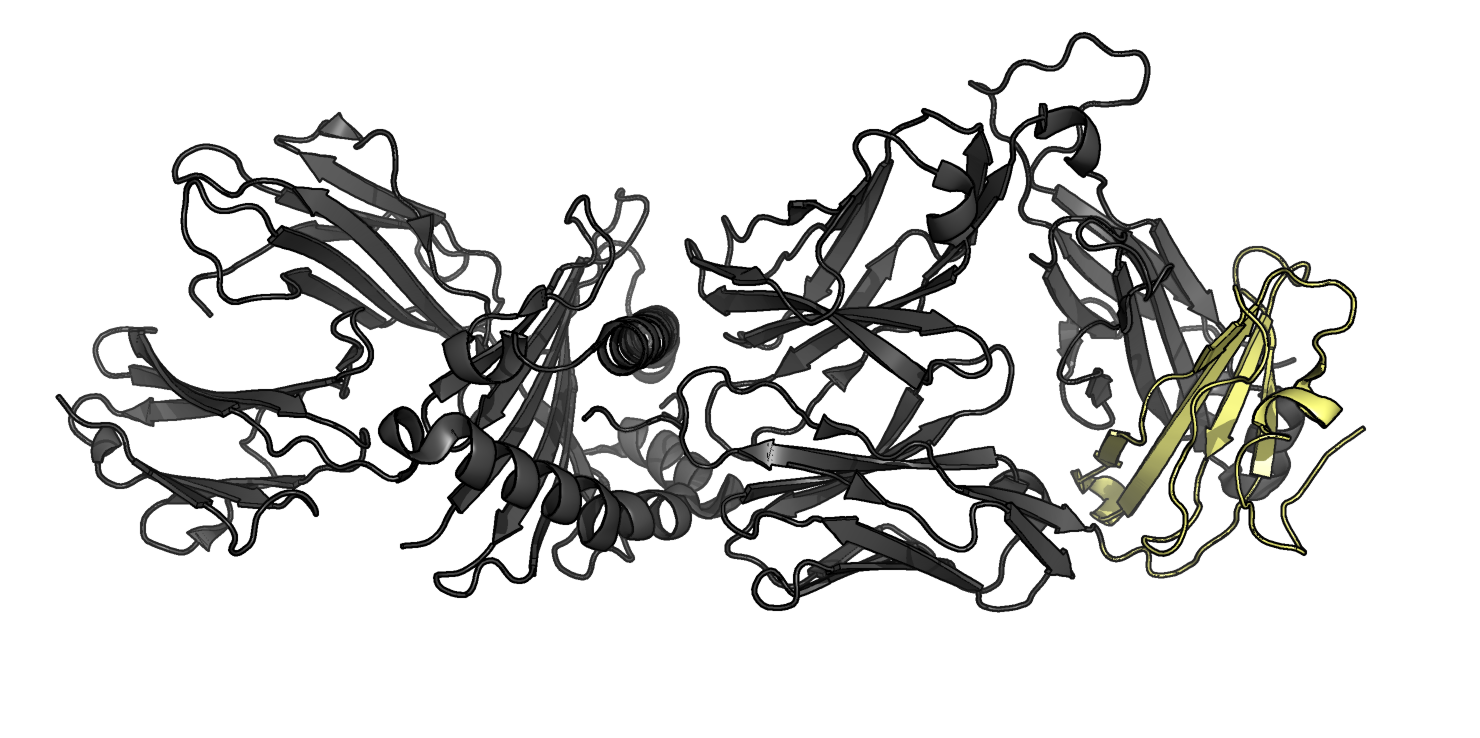
Совмещение по заданному выравниванию. Домены Т-клеточного рецептора Для совмещения по заданному выравниванию были выбраны домен D:115-204 структуры 2BNQ из α-цепи и Е:119-247 структуры 2ESV из β-цепи (Рис. 6).
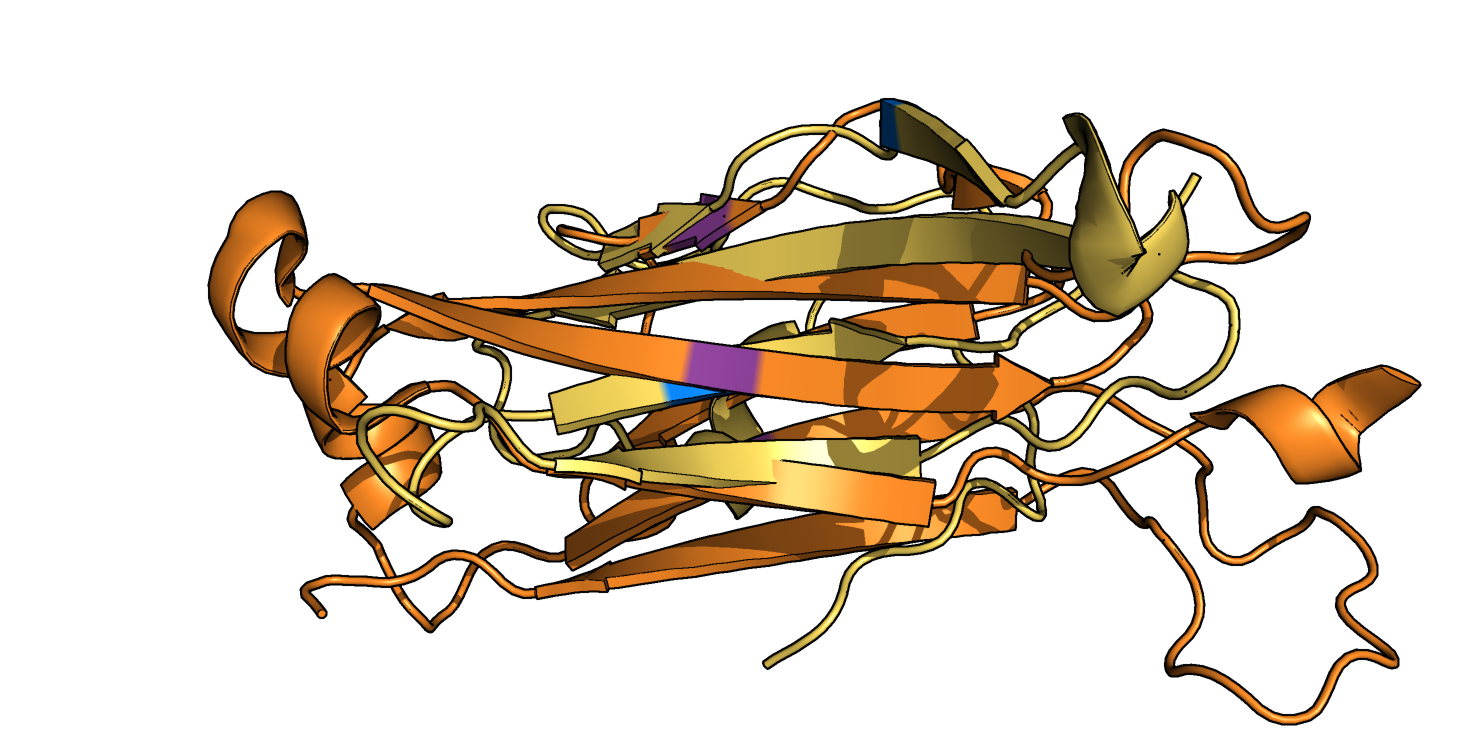
При накладывании выбранных доменов друг на друга с помощью align в PyMol видно, что совмещаются они не очень хорошо (Рис. 7).
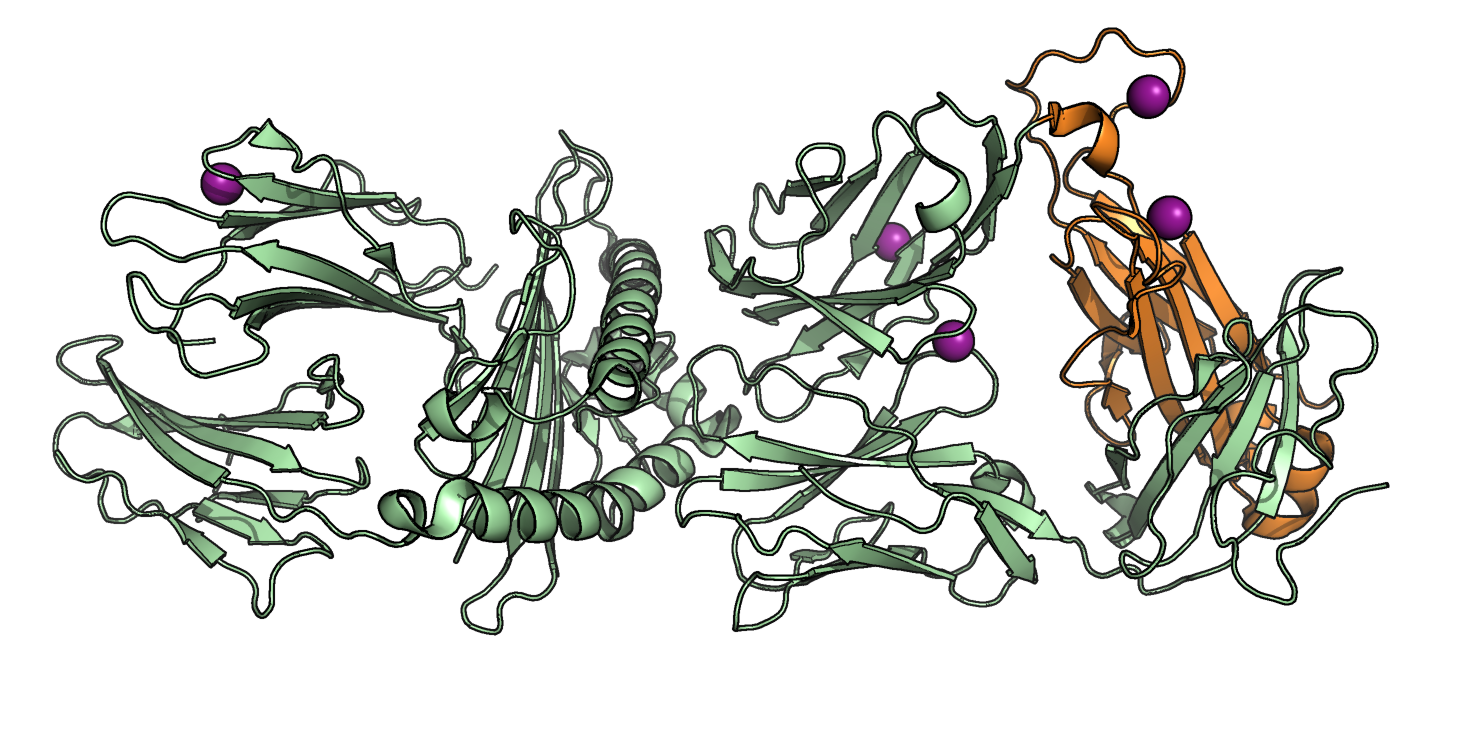
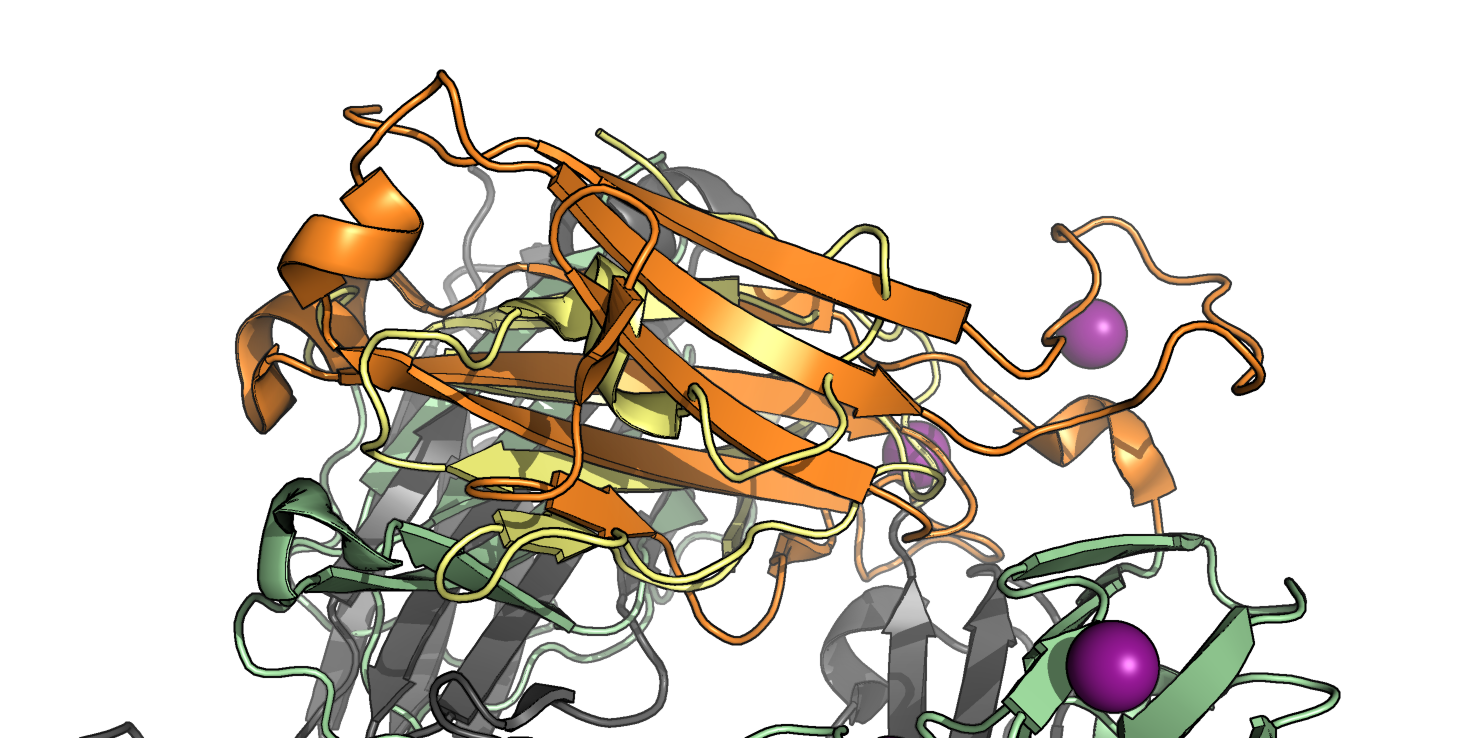
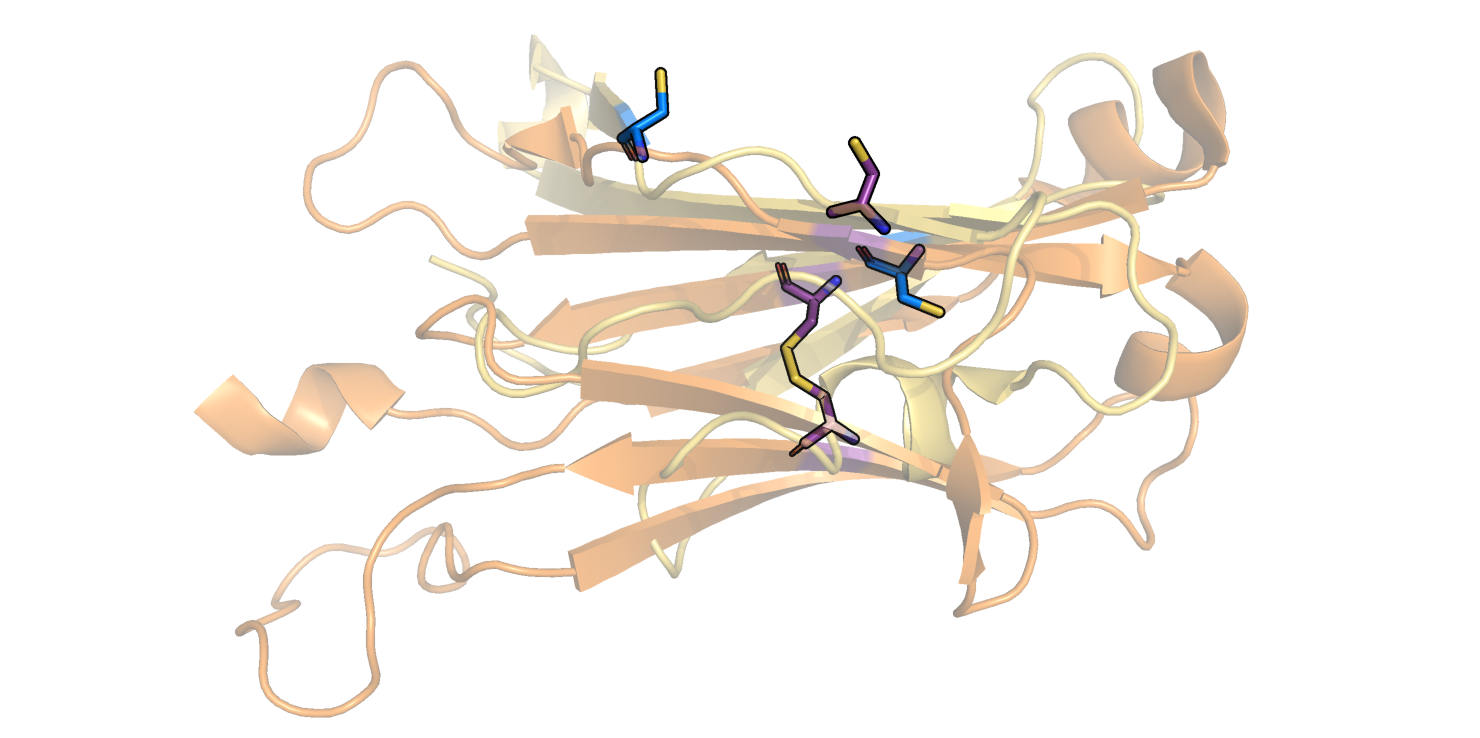
Исходя из Рис. 7, можно исключить нижний β-слой (Рис. 8) из рассмотрения, так как он не соответствует β-листу в α-цепи. С поиском консервативного цистеина возникли сложности, так как цистеины, образующие дисульфидную связь, обнаружились не по одному в каждой цепи, оба - в β-цепи, а в α-цепи присутствуют только 2 цистеина, не образующие дисульфидный мостик (Рис. 9).
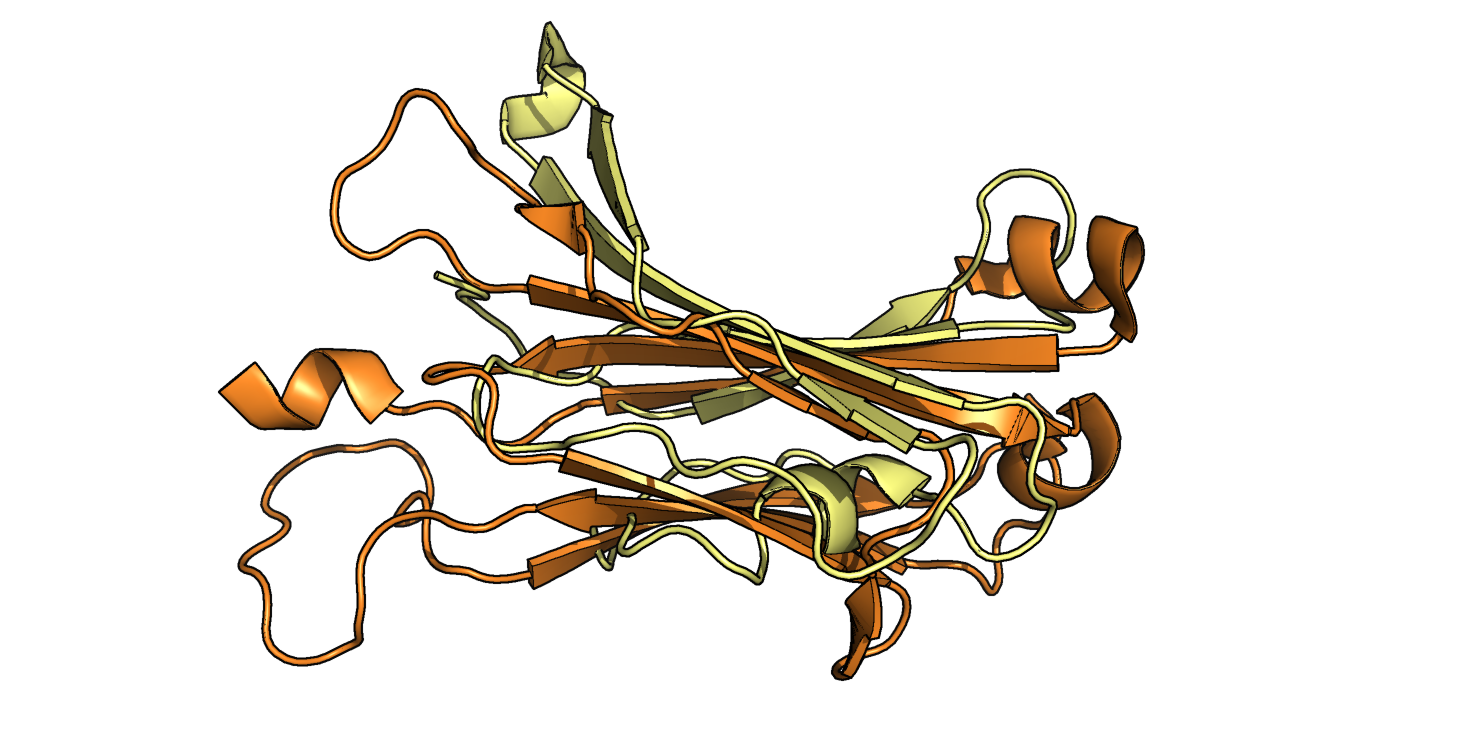
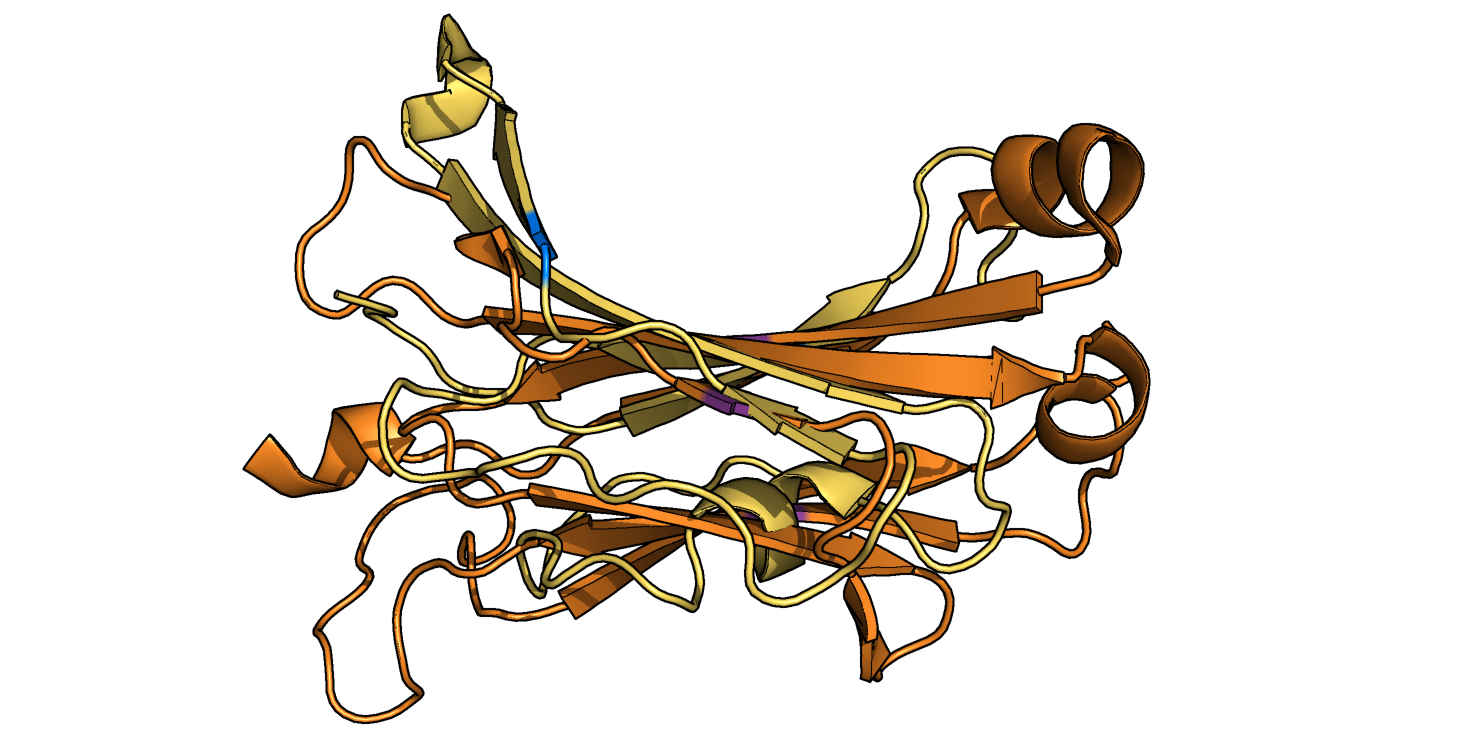
За основу выравнивания были взяты Cys137 α-цепи (домен из 2BNQ) и Cys148 β-цепи (домен из 2ESV) и их ближайшие соседи. Команды для выравнивания: select a, domA and resi 124-126+136-138+177-179 and name CA select b, domB and resi 129-131+147-149+195-197 and name CA pair_fit a, b * domA и domB - это домены α и β-цепи, соответственно, полученные из соответствующих моделей 2BNQ и 2ESV с помощью команды extract. После совмещения с помощью приведенной выше команды было получено RMS = 1.470. Файл с совмещением. Видно, что тяжи, данные как затравка, совместились хорошо, а также совпали некоторые петли (Рис. 10). Однако остальные части доменов (например, α-спирали) выравнялись плохо.
Прослеживая ход каждой из цепей, можно заключить, что топологии двух доменов, вообще говоря, схожи - в обеих присутствуют греческие ключи, но все же во втором (оранжевом) домене присутствуют дополнительные β-тяжи, из-за которых его топология отличается от топологии первого домена. Эти дополнительные тяжи накладываются на α-спираль первого домена.
| |||
| © Alexandra Boyko, 2014. Faculty of Bioengineering and Bioinformatics, MSU. | |||