| Главная страница | Обучение | Обо мне | Ссылки | ||||||||||||||||||||||||||||||||||||||||
Анализ ЯМР-файла | |||||||||||||||||||||||||||||||||||||||||||
|
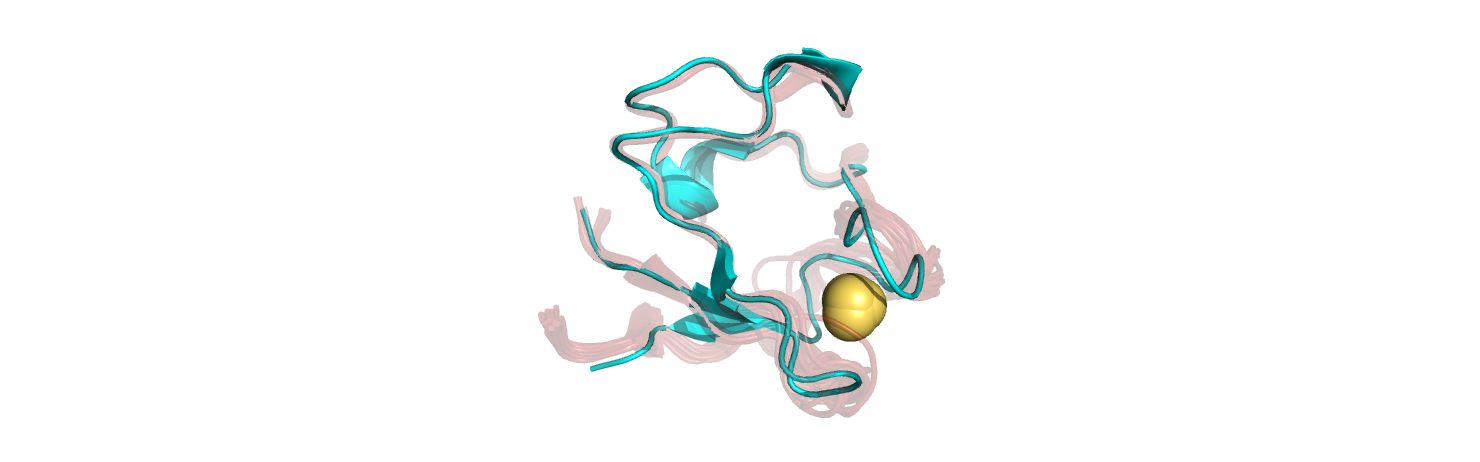
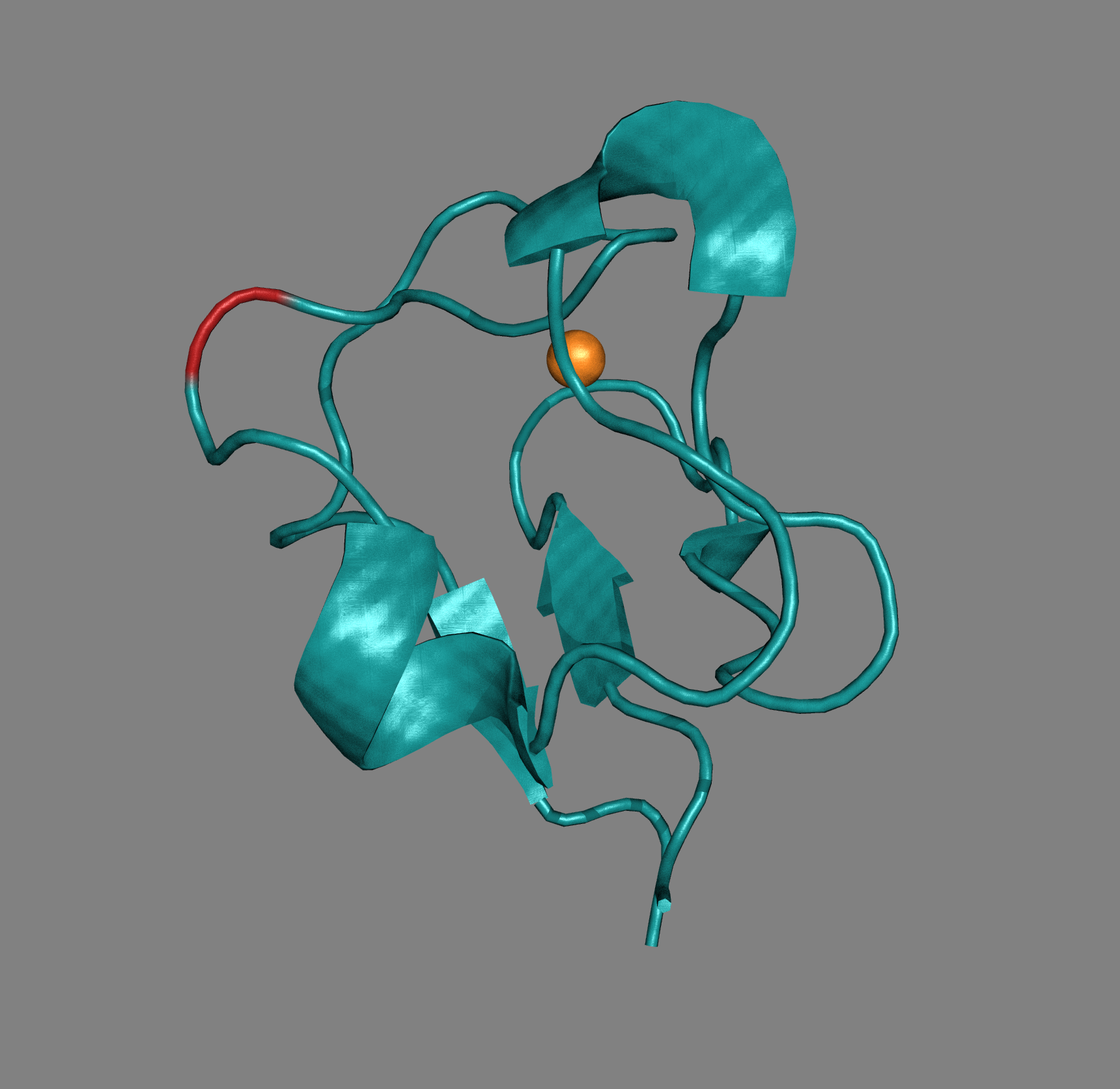
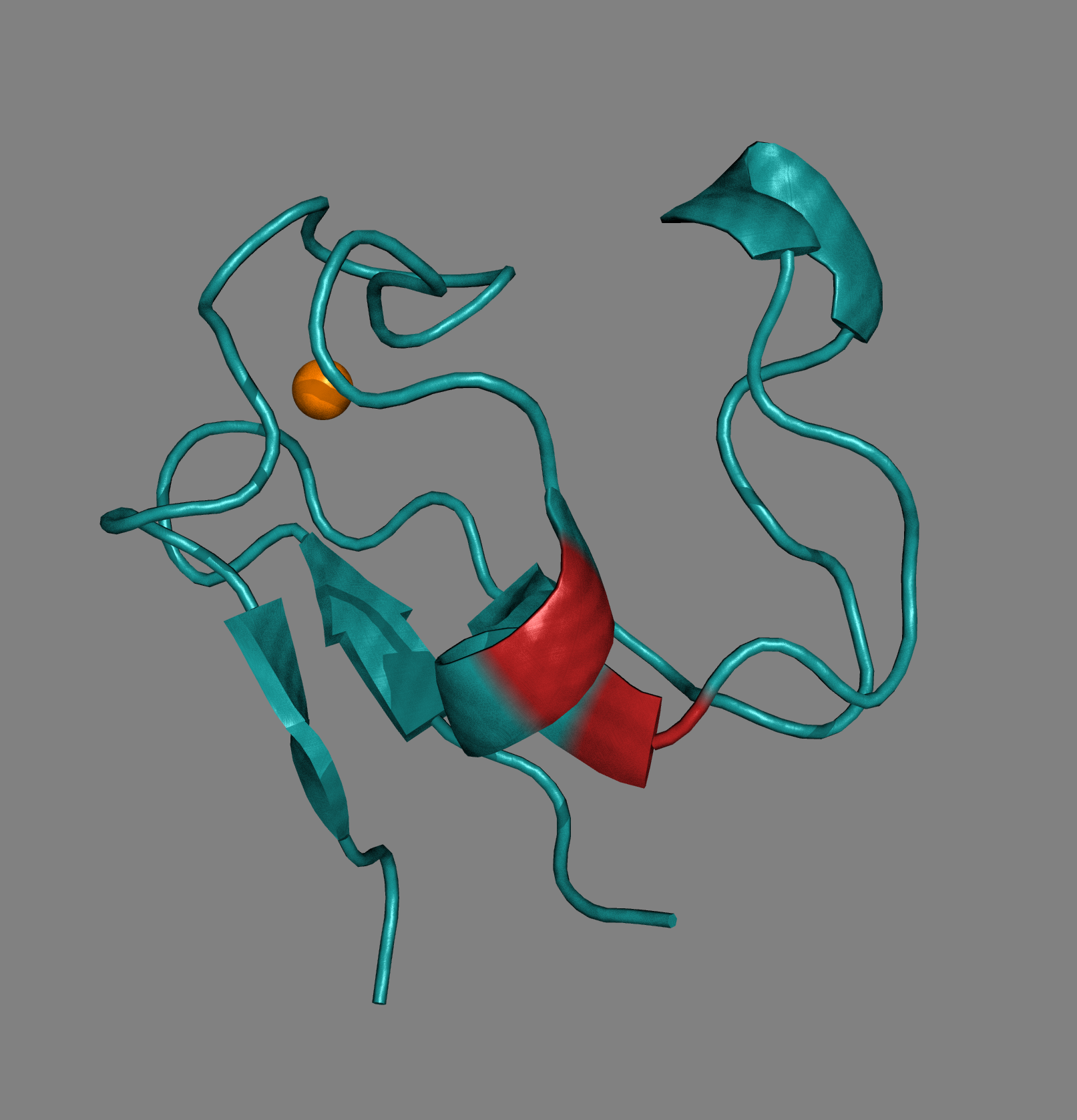
Для сравнения структур, полученных методами ЯМР и РСА, был выбран маленький белок рубредоксин из организма Clostridium pasteurianum. Этот белок связывает один атом железа Fe3+(окисленная форма) и участвует в реакциях одноэлектронного переноса. Для него были получены ЯМР-структура (1BFY) и РСА-структура (1FHH). Обе структуры приведены на Рис. 1.
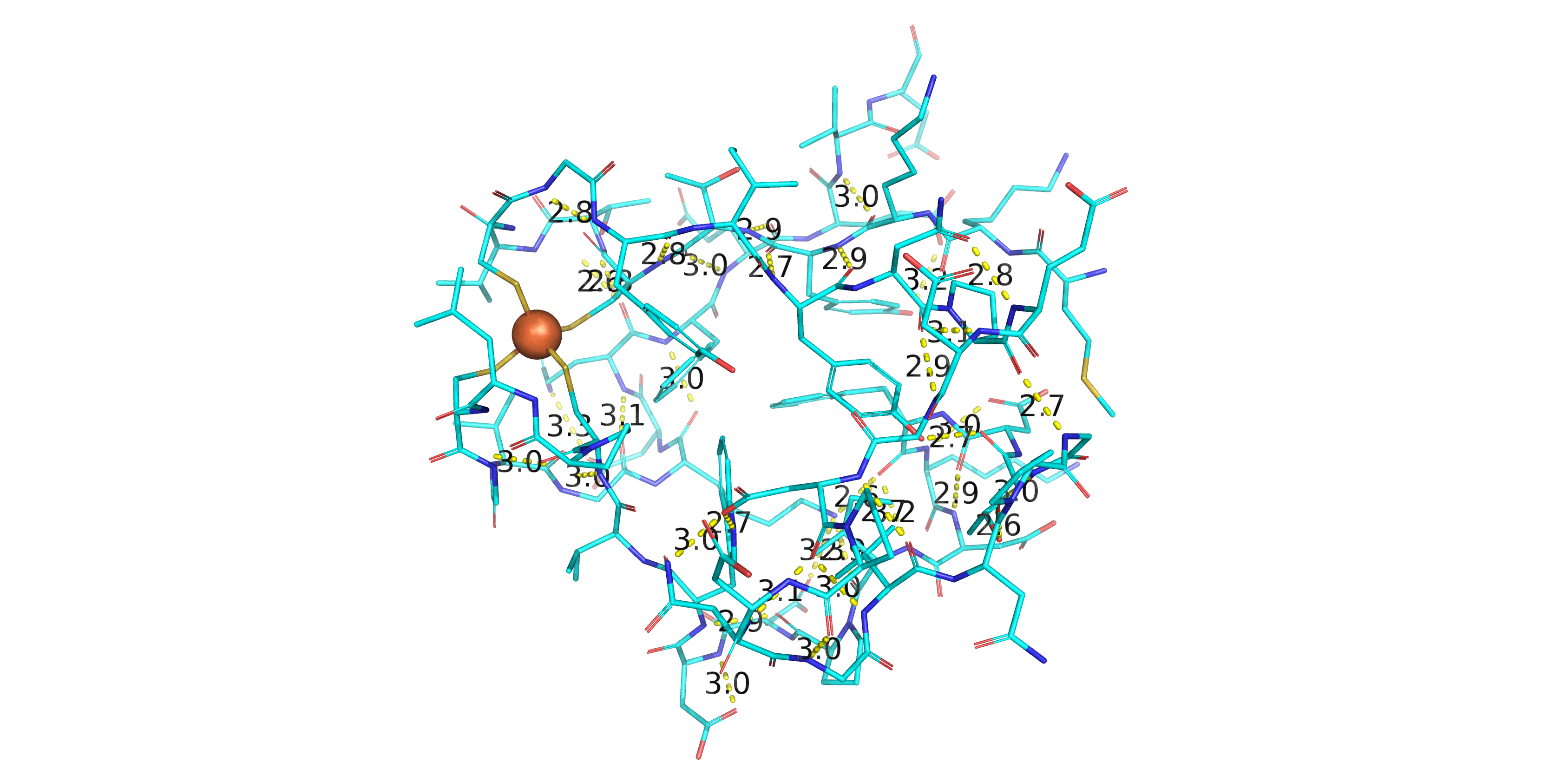
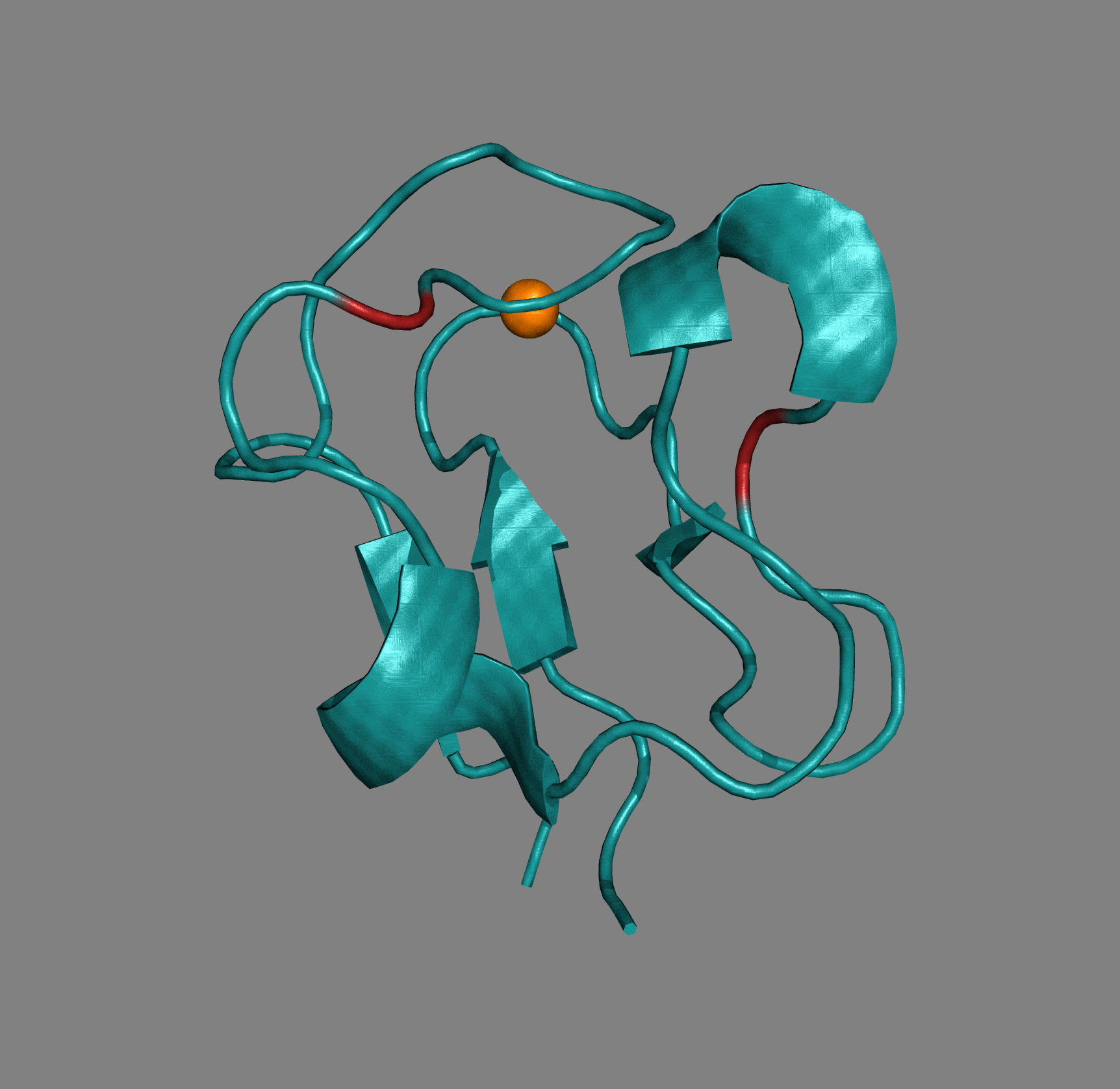
По Рис. 1 видно, что структуры, полученные разными методами, хорошо совмещаются друг с другом. Далее была оставлена только структура 1FHH (модель, полученная рентгено-структурным анализом), и для нее с помощью команды dist bond_h, donors, acceptors, 3.5, mode=2 (donors, acceptors - стандартно заданные в Pymol множества) были показаны все водородные связи (Рис. 2). Водородными связями в данном случае называем связи между электроотрицательными атомами доноров и акцепторов, находящихся на расстоянии не больше 3.5 Å друг от друга.
Затем были выбраны и визуализированы несколько водородных связей из разных частей белковой глобулы (Рис. 3 - 6). Их представленность в ЯМР-файле также была оценена по каждой из 20 структур файла 1BFY.
На Рис. 3 приведен пример внутрибелкового взаимодействия атомов остова полипептидной цепи - 2 водородные связи между (маленькими) бета-слоями. Длины связей - 2.9 Å и 2.7 Å.
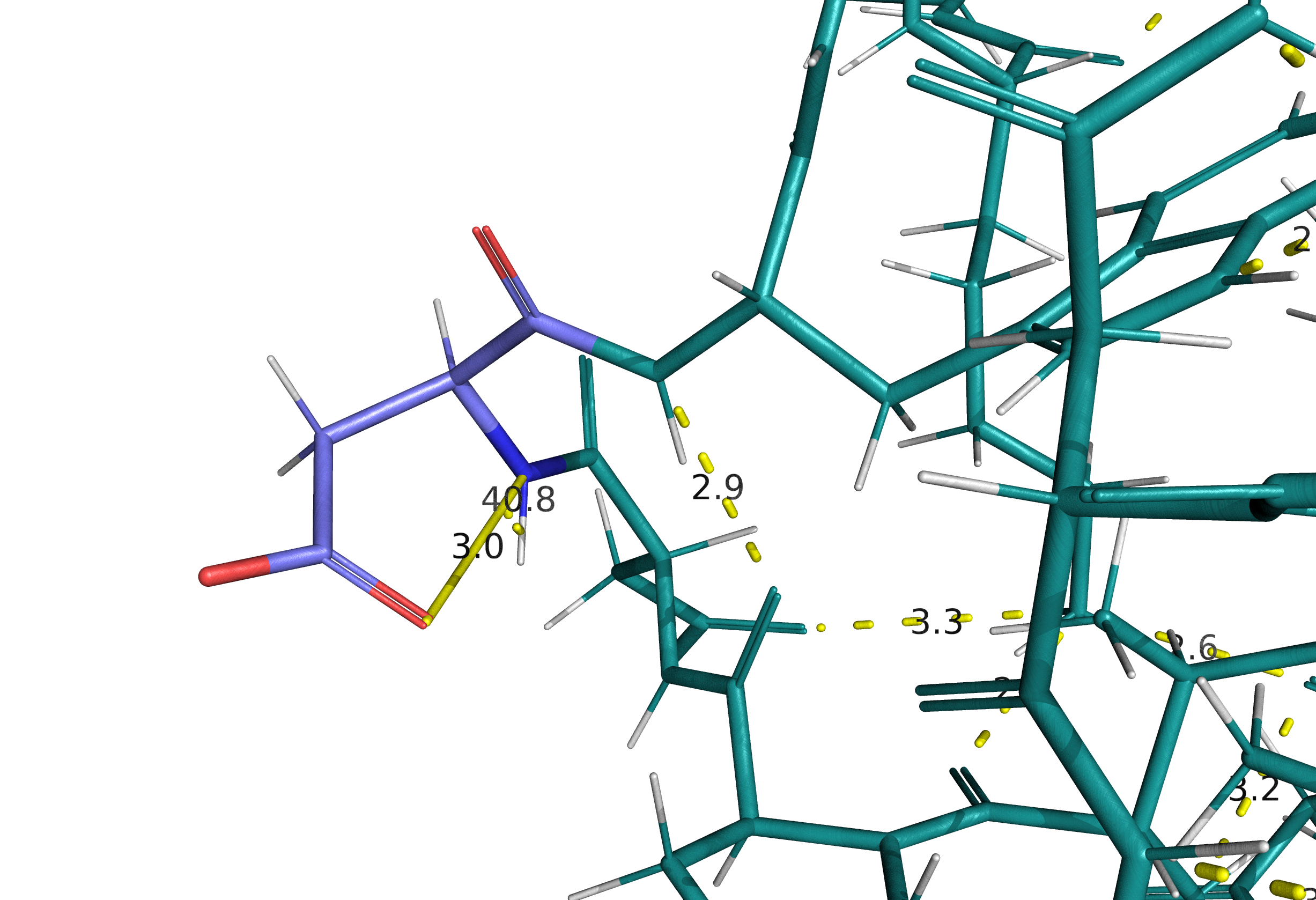
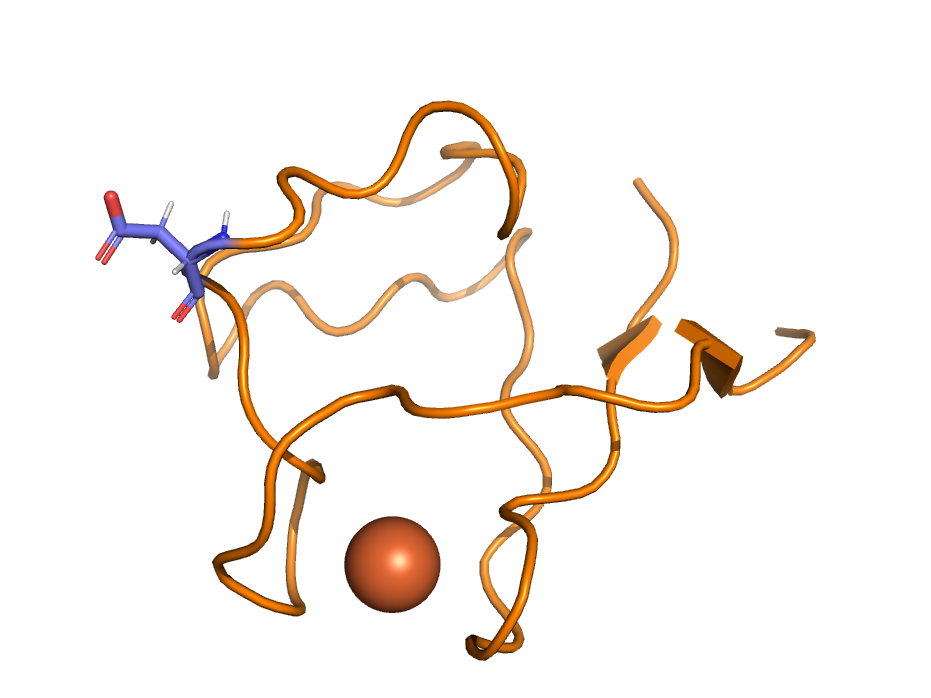
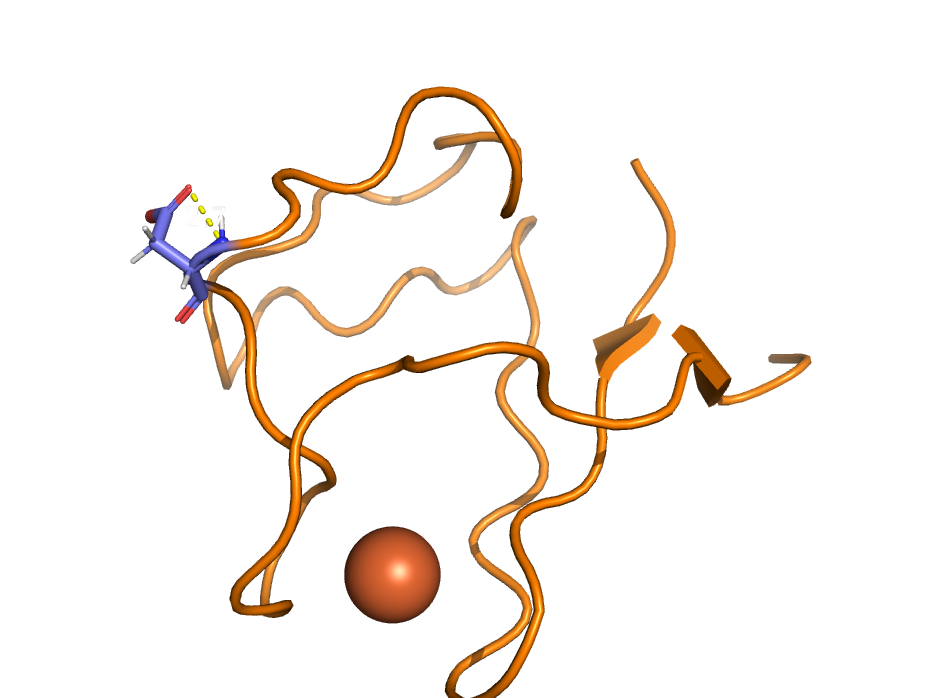
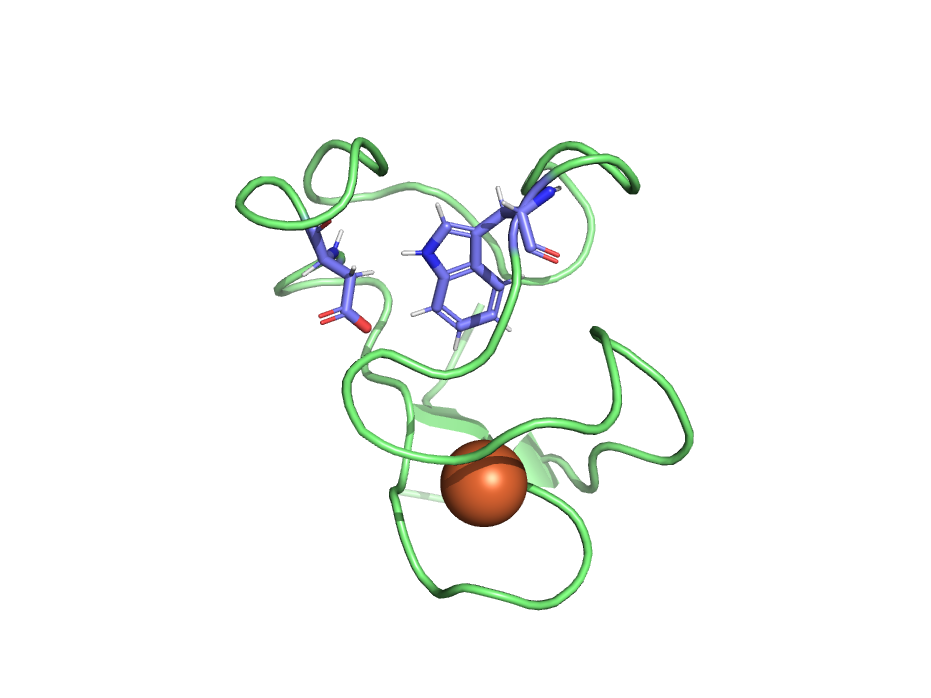
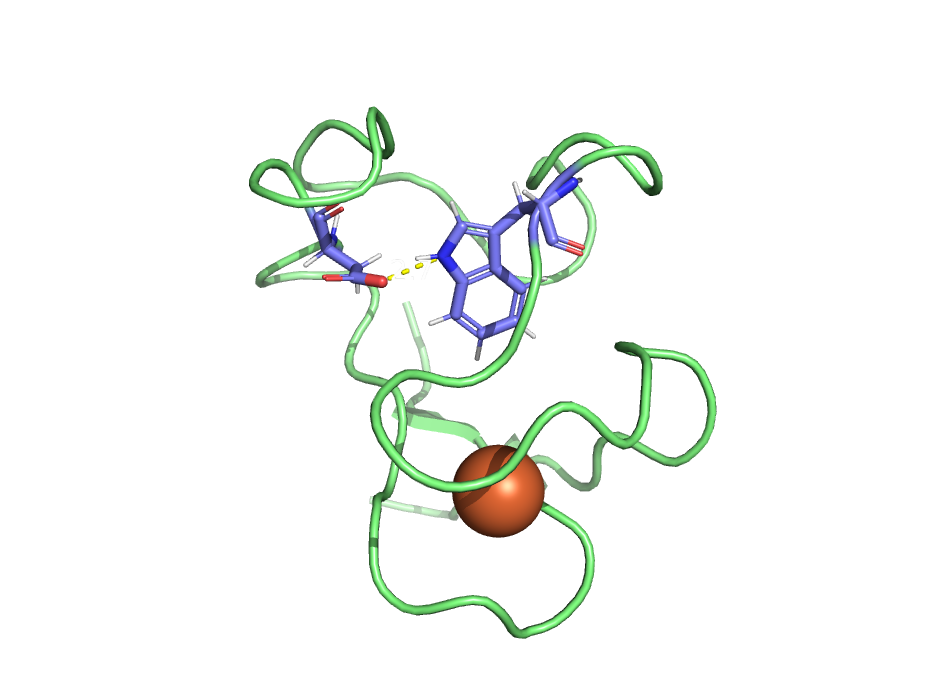
Интересный вариант образования водородной связи можно наблюдать на Рис. 4, где аспартат, находясь на поверхности белковой глобулы в неупорядоченной петле, кислородом боковой цепи образует водородную связь со своим же атомом азота, входящим в остов. Длина связи 3 Å, а угол донор-акцептор-водород составляет 40.8° - то есть водородная связь довольно искривлена по сравнению с типичными случаями, в которых величина угла не превышает 20°.
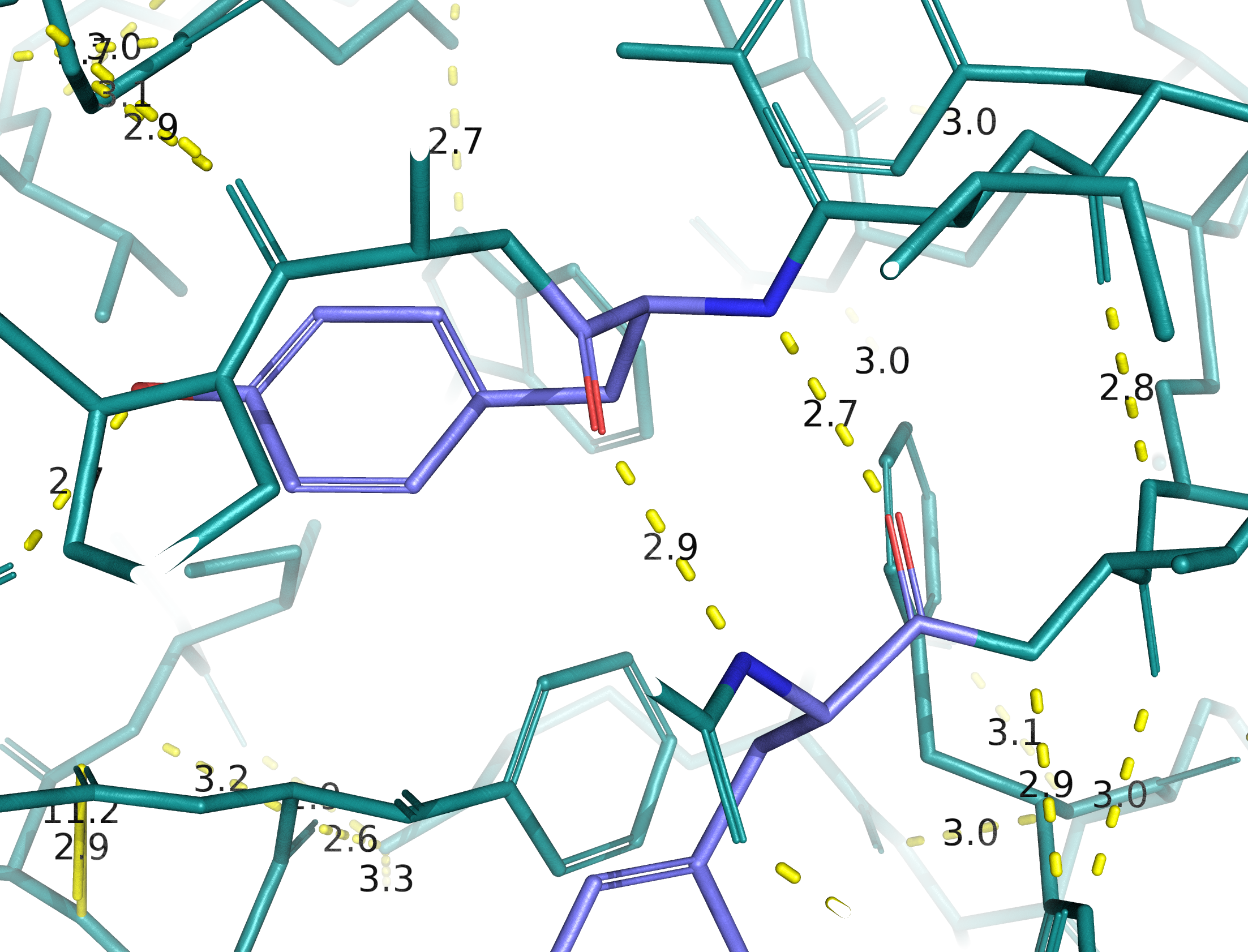
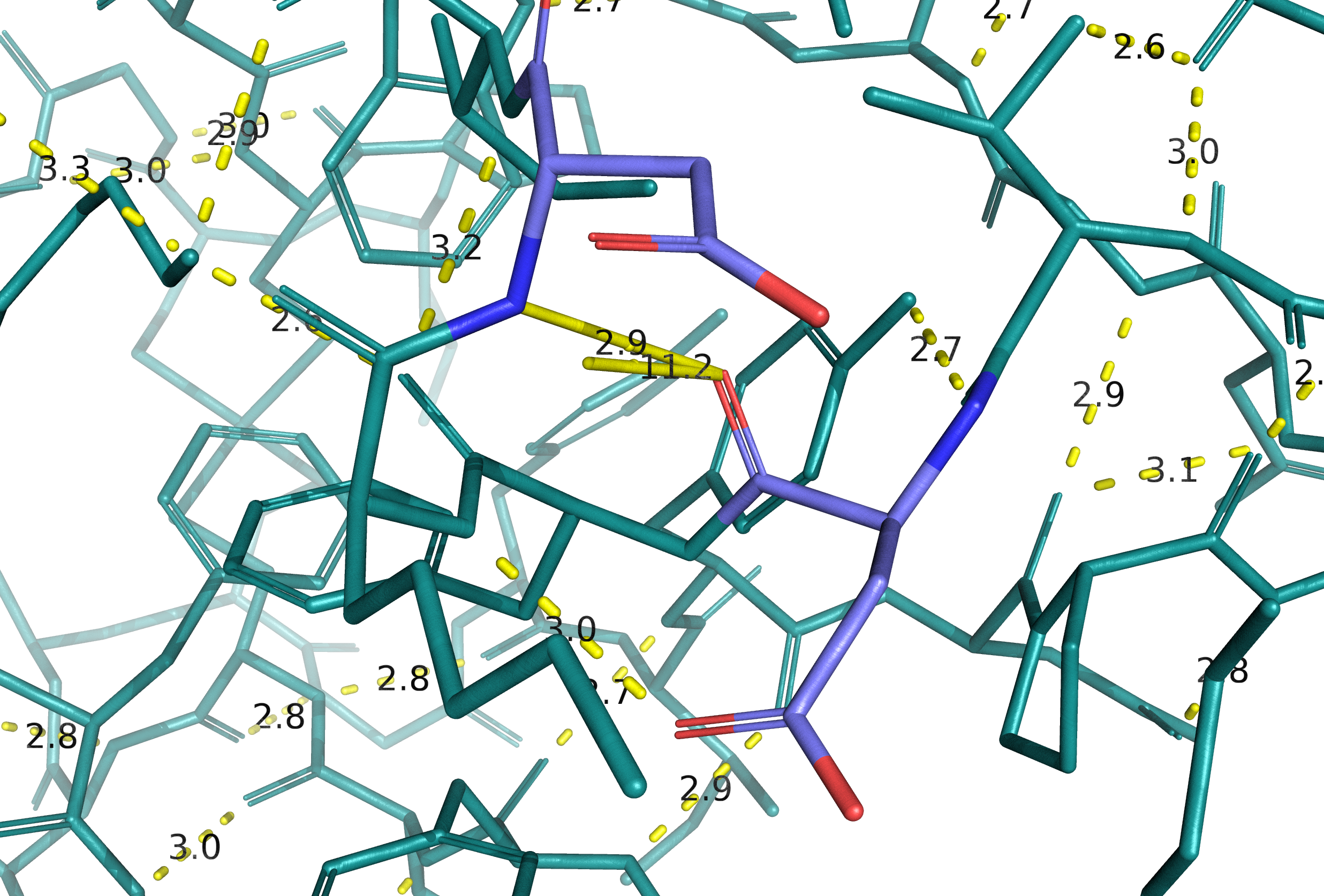
На Рис. 5 показан вариант образования водородной связи прямо в core белковой глобулы. Это не очень хорошо отражено структуре всего белка (Рис.5, внизу), однако по верхнему рисунку видно, что аминокислотные остатки, участвующие в образовании связи, во-первых, относительно крупны, а во-вторых, ориентированы навстречу друг другу. Длина связи при этом составляет 2.7 Å, а угол наименьший из всех рассматриваемых в этом практикуме вариантов - 6,9° - то есть остатки расположены практически на прямой линии.
Наконец, на Рис. 6 приведен пример водородной связи внутри маленького фрагмента α-спирали. Длина связи 2.9 Å.
Затем эти же связи я искала во всех 20 структурах, представленных в ЯМР-файле 1BFY. В Таблице 1 приведены результаты поиска. Таблица №1. Сравнение параметров водородных связей в структурах, расшифрованных с помощью РСА и ЯМР
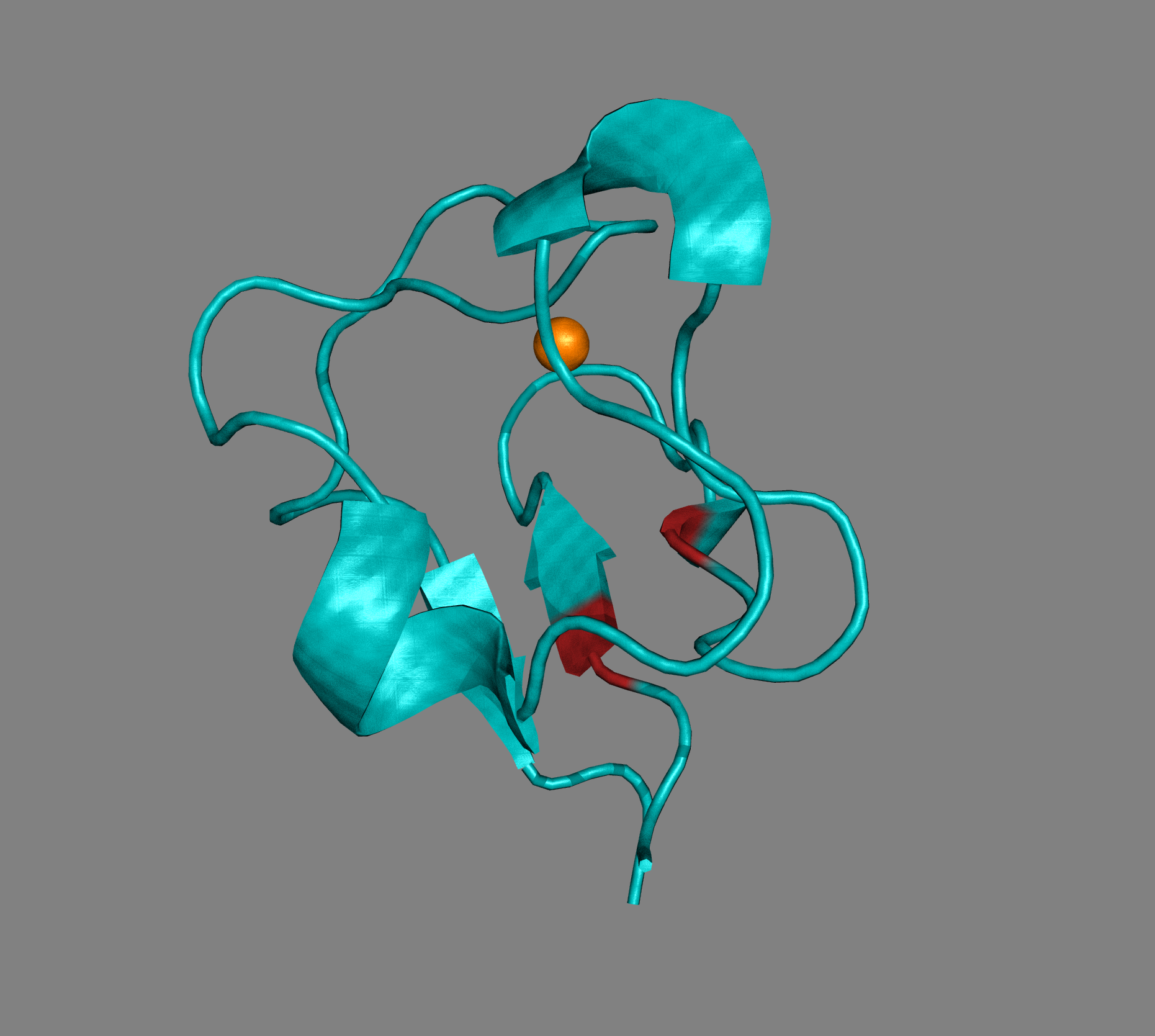
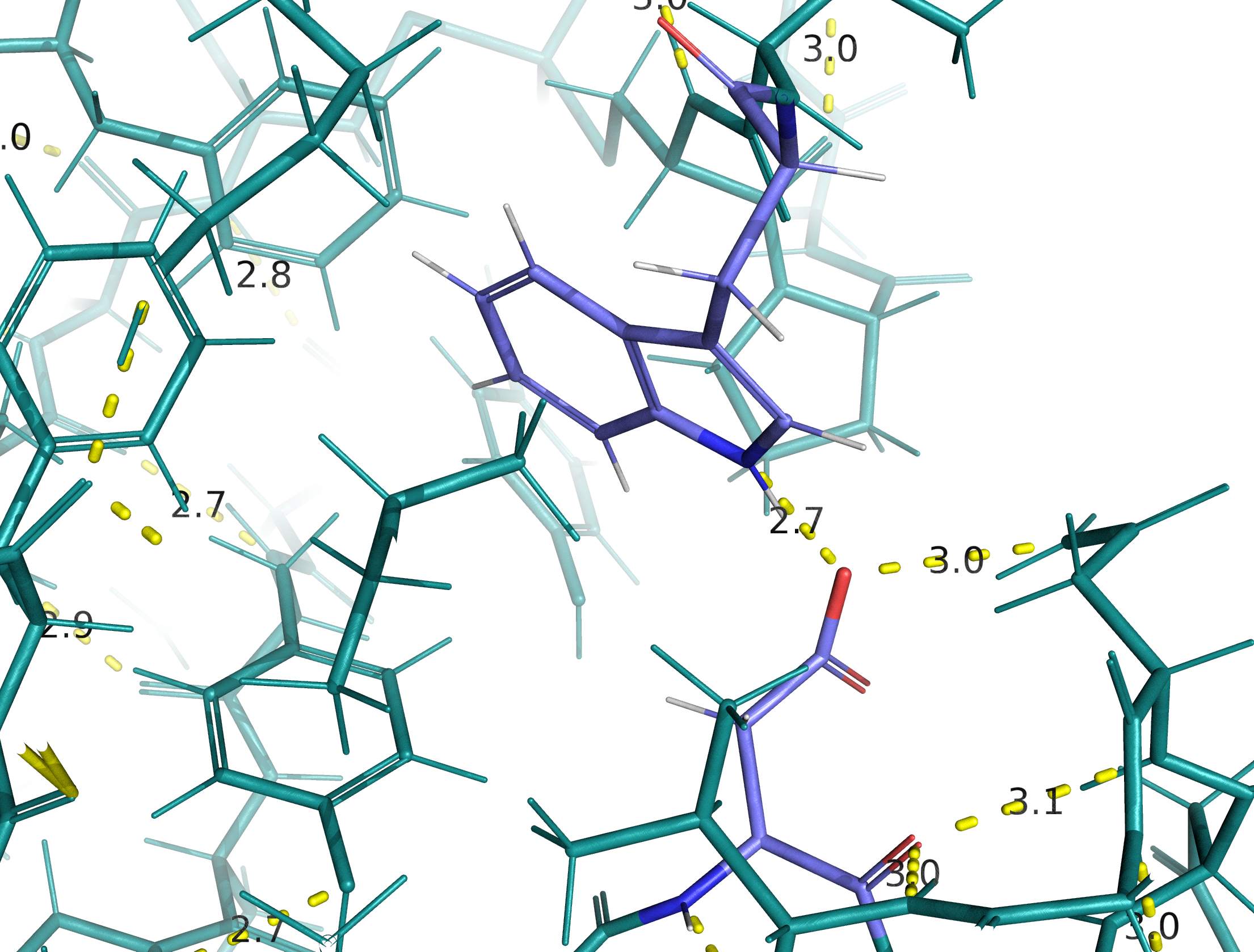
Из Таблицы 1 и из Рис. 7-8 (ниже) очевидным образом следует, что, несмотря на бОльшую динамичностью структуры белка в растворе в ходе ЯМР-эксперимента, связи, вовлеченные в формирование вторичных структур (β-слоя или α-спирали), представлены во всех ЯМР-моделях, поскольку являются биологически значимыми. В то же время, на поверхности белка стабильность водородных связей сильно ниже из-за более высокой неупорядоченности среды и структуры. Аминокислотный остаток в поверхностной петле свободно вращается вокруг своих торсионных χ-углов, в некоторых конформациях (25% случаев) образуя водородные связи с пептидным остовом. Наконец, довольно интересные данные получились с остатками, которые имеют общую водородную связь внутри белковой глобулы, однако они расположены на неупорядоченных петлях, из-за чего могу довольно свободно двигаться. Из-за этого, на самом деле, в растворе водородная связь, зафиксированная в кристалле, возникает всего в 10% случаев. Еще напрашивается замечание, что подвижность коровой части белка зависит от общего размера белка - в данном случае был выбран маленький рубредоксин, и, наверное, говорить о внутреннем ядре этого белка как таковом не очень корректно. В заключение приведу примеры отсутствия/наличия водородной связи в той или иной ЯМР-модели (Рис. 7).
| |||||||||||||||||||||||||||||||||||||||||||
| © Alexandra Boyko, 2014. Faculty of Bioengineering and Bioinformatics, MSU. | |||||||||||||||||||||||||||||||||||||||||||