Практикум 11:
Описание семейства доменов из Pfam:
В рамках данного практикума я решил выбрать для описания, семейство доменов RNA_binding (PF01877), в связи с потенциально большой значимостью данного домена для регуляции экспрессии генов, а также в связи с относительно благоприятными техническими характеристиками, подходящими для выполнения данного практикума. Структура домена состоит из 5 альфа-спиралей и 8 бета-нитей. Первые шесть бета-нитей формируют антипараллельный бета-лист, к которому примыкают пять альфа-спиралей с одной стороны. Остальные две бета нити формируют меньший бета-лист на С-конце белка. Наглядный пример 3D структуры домена вы можете рассмотреть на фотографии ниже, на ней представлен белок SSO0741 (PDB 2nrq), состоящий из единственного РНК-связывающего домена.
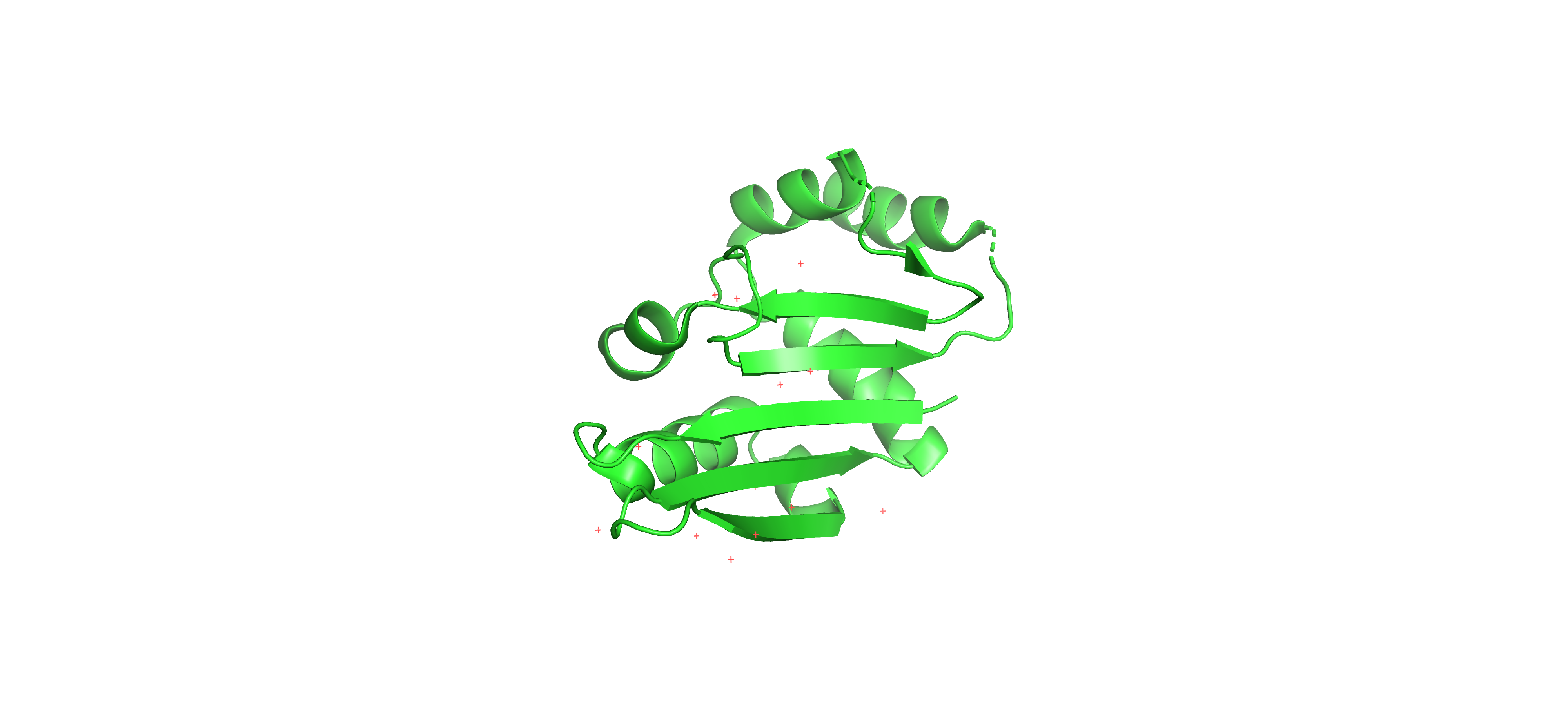
Данный домен может исполнять свою функцию только в форме гомодимера, неспецифически связывая двухцепочечную РНК. Таксономически более 95% видового разнообразия носителей белков с данным доменов представлено Археями, из оставшихся 5 примерно 4% занимают бактерии, и оставшийся процент занимают вирусы.
Характеристики семейства доменов из Pfam:
AC: PF01877 ID: RNA_binding Name: RNA binding Seed: 93 Full: 483 Architectures: 10 (интересно что значение в таблице и в Pfam различается, в таблице написано что их всего 2)
Множественное выравнивание:
Максимально достоверный блок, присутствующий у всех последовательностей белков данного семейства есть только один, он представляет собой аминокислотный остаток лизина в 121 позиции, который является при этом первым остатком пятой альфа-спирали белка. С учётом того что белок связывает РНК, вероятно данный лизин играет важную роль в электростатическом взаимодействии белка с сахарофосфатным остовом или несёт важную структурную функцию на уровне укладки.
Максимально достоверных блоков, которые тем не менее присутствуют не во всех последовательностях сильно больше, при минимальном проценте идентичности в 90 это: Пара аминокислотных остатков треонин-глутамат на 11 и 12 позиции соответственно (при укладке находятся в петле, видимо создают какой-то важный угол). Остаток валина в 17 позиции. Остаток глутамина в 122 позиции (по консервативности очень близок к лизину 121, видимо блок 121-122 участок связывания).
При понижении процента идентичности до 80% к этому списку присоединяются: Аланин в позиции 124 (находится в одной альфа-спирали с глутамином упомянутым выше, а также с очень консервативным лизином, возможно тоже образует участок связывания). Глицин в позиции 128. Изолейцин в позиции 145.
Теперь рассмотрим участок выравнивания, плохо отражающий ход эволюции, не имеющий достоверных блоков или подблоков. Для этого дела очень подходит участок между 65 и 72 аминокислотным остатками. Поскольку даже при проценте идентичности в 20, не имеет никаких выразительных блоков, при этом данный участок выпадает частично на бета-лист, частично на альфа-спираль и петлю между ними. Очевидно что в реализации функции белка этот участок роли не играет.