Практикум 4. ProDy-2. ЯМР vs РСА
1. Вводное
Для работы был дан белок семейства Ras. Одна структура была получена методом ЯМР (2LCF), а вторая - методом РСА (1CTQ). Разрешение 1CTQ - 1.26 Å. Число моделей для 2LCF - 20.Ниже представлено наложение всех моделей 2LCF (желтым) и структуры 1CTQ (зеленым).
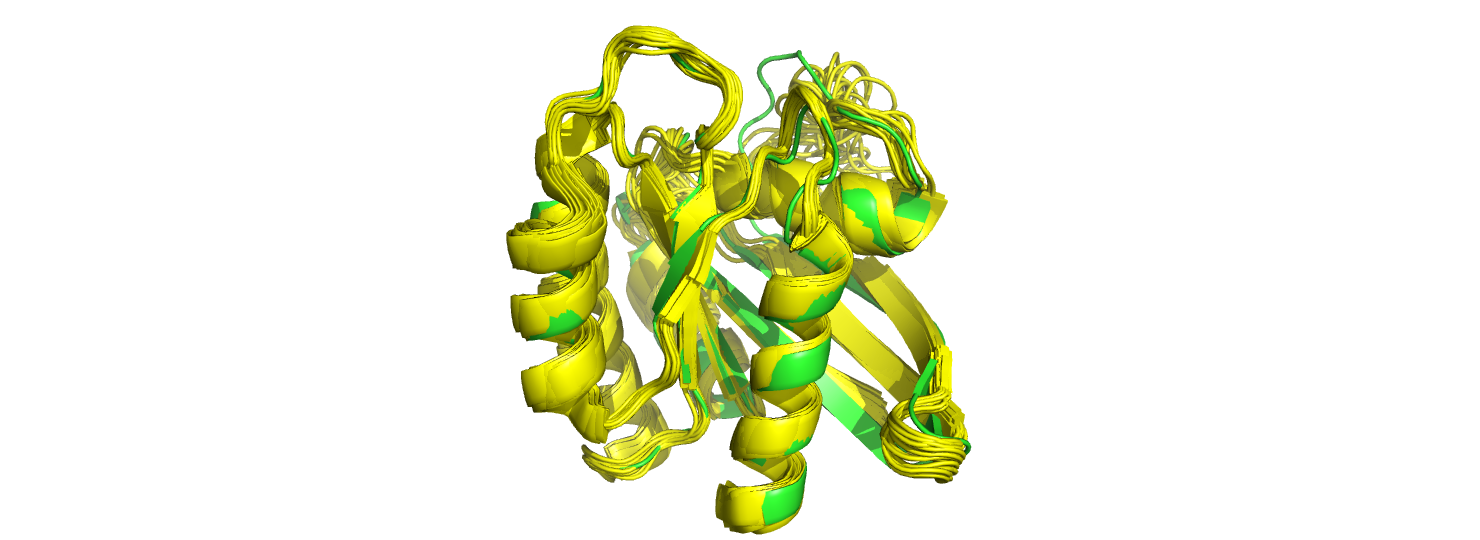
Рис.1 Общий вид наложенных структур. 2LCF показана желтым цветом, 1CTQ - зеленым
В общем и целом структуры хорошо совпадают. В структуре, полученной методом ЯМР визуально не наблюдается разрывов, концы молекулы уложены примерно одинаково. Элементы вторичной структуры совпадают. Немного по-разному изогнут бетa-лист. Основное различие можно видеть на рисунке 2. Видно, что правый край наложенных структур более "лохматый" (стрелка (1) на рис.2)
 Рис.2 Вид наложенных структур. 2LCF показана желтым цветом, 1CTQ - зеленым
Рис.2 Вид наложенных структур. 2LCF показана желтым цветом, 1CTQ - зеленым
Также начало альфа-спирали, на которую указывает стрелка (2) на рис.2 и на рис.3, не показана в ЯМР-структуре в виде альфа-спирали.
Петля, указанная стрелкой (1) на рис. 2 и рис. 4, имеет разное положение в моделях, с которыми ведется работа. Причем
в модели РСА она не совпадает ни с одной структурой ЯМР, это хорошо видно на рис 2.
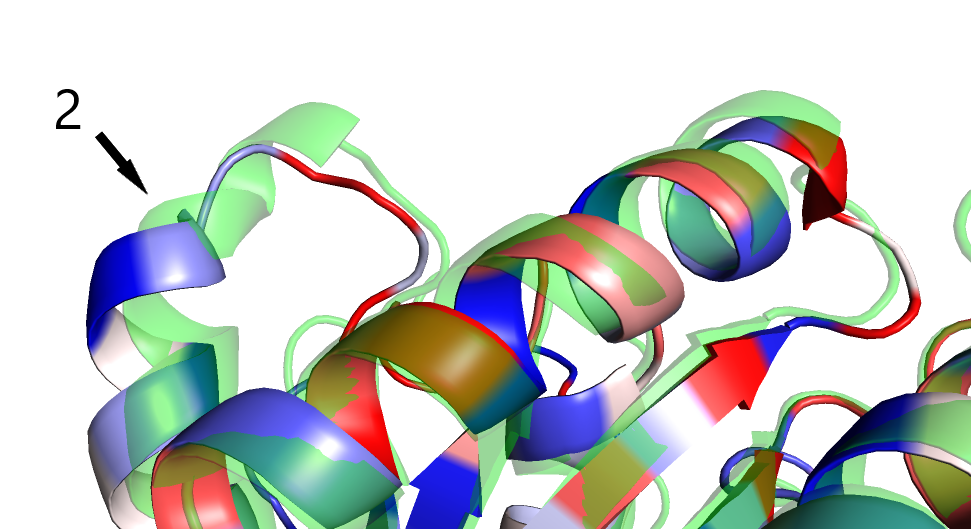 Рис.3 Различия в макроструктуре. По b-фактору покрашена ЯМР структура, зеленым - РСА структура. 2 - различия в
структуре альфа-спирали.
Рис.3 Различия в макроструктуре. По b-фактору покрашена ЯМР структура, зеленым - РСА структура. 2 - различия в
структуре альфа-спирали.
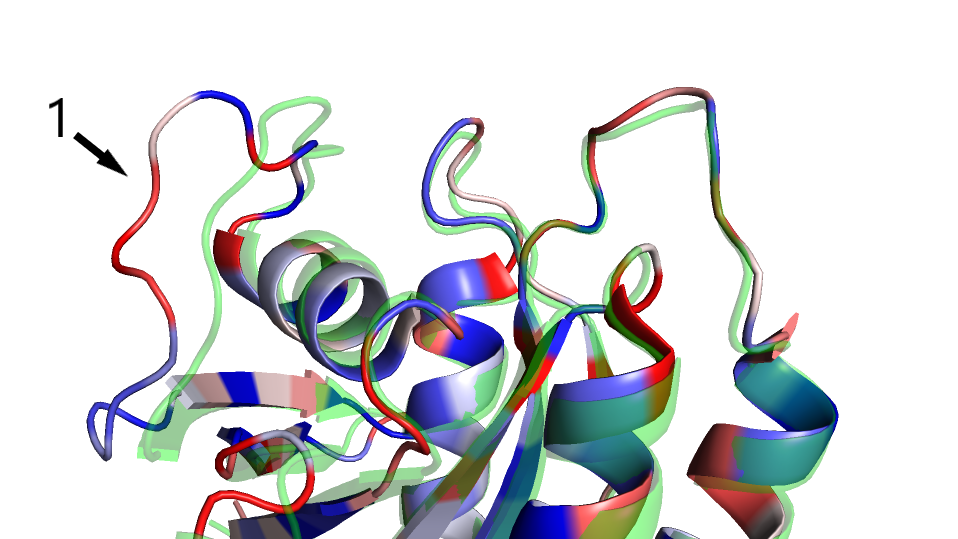 Рис.4 Различия в макроструктуре. По b-фактору покрашена ЯМР структура, зеленым - РСА структура. 1 - различия в структуре
петли.
Рис.4 Различия в макроструктуре. По b-фактору покрашена ЯМР структура, зеленым - РСА структура. 1 - различия в структуре
петли.
Поищем примеры отличия на микроуровне. В ЯМР структуре видно водороды. В аминокислотных остатках основное различие в пространственной ориентации (рис.5). Благодаря второму заданию было найдено, что на позиции 35 в ЯМР модели расположен серин, а в РСА модели - треонин.
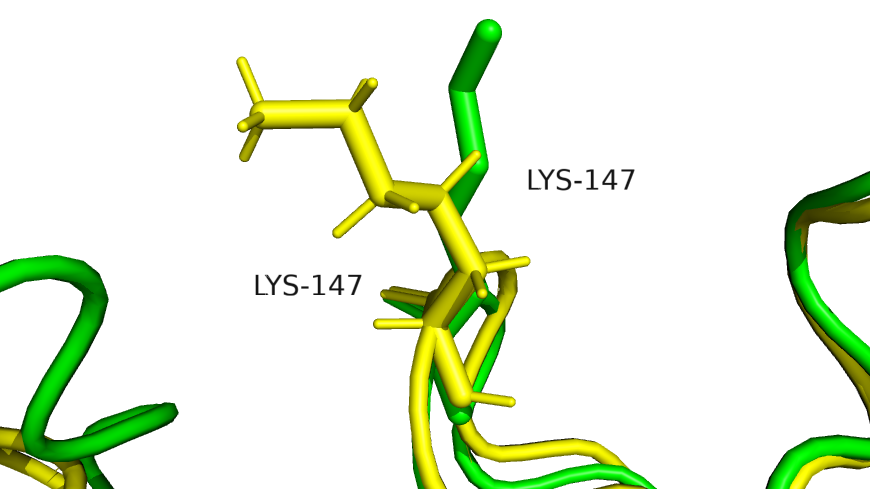 Рис.5 Различия в пространственной ориентации аминокислотных остатков на примере Lys-147.
Рис.5 Различия в пространственной ориентации аминокислотных остатков на примере Lys-147.
Также в РСА модели много альтлоков. Они есть, например,для Glu-3, Lys-42, Gln-43, Thr-87, Arg-128, Gln-165. Для ЯМР структуры нет понятия альтлоков.
2. RMSF
В данном задании была попытка сравнить меру RMSF для ЯМР модели с b-факторами для РСА модели. Сравнение производилось среди соответствующих остатков - у структур, с которыми ведется работа остатки совпадают по номерам все, кроме различия, о коротом рассказано в пункте 1. (серин и треонин)Ниже представлена зависимость среднего значения b-фактора от RMSF для соответствующих остатков.
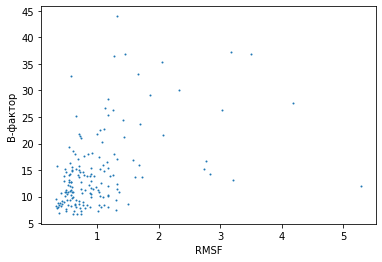 Рис.6 Зависимость среднего значения b-фактора от RMSF для соответствующих остатков в разных моделях
Рис.6 Зависимость среднего значения b-фактора от RMSF для соответствующих остатков в разных моделях
Можно сказать, что в основном остатки с меньшим значением RMSF обладают меньшим средним значением b-фактора. Большая часть точек сосредоточена в области малых значений. Значит RMSF отражает подвижность остатков. Но также существуют остатки с приблизительно похожим значением RMSF, но с сильно отличающимся средним значением b-фактора. Это наблюдается по мере увеличения RMSF. И есть точки с небольшим значением b-фактора, но при этом обладающие большим значением RMSF - значит, мера RMSF отражает не только подвижность атомов, а также может быть связана с качеством самой модели.
3. Водородные связи
Были выбраны четыре водородные связи. Их характеристика приведена ниже в таблице. При подсчете количества ЯМР структур, в которых есть данная водородна связь, учитывались те, у которых между указанными остатками наблюдалась необходимая геометрия и расстояние между атомами было не больше 3.3 А.На рисунках изображена РСА модель.
| Положение водородной связи | Остаток 1 | Остаток 2 | Расстояние в РСА (Å) | Число,процент ЯМР моделей со связью | Расстояние в ЯМР (Å) | ||
|---|---|---|---|---|---|---|---|
| Макс. | Мин. | Медиана | |||||
| В ядре белка, в бета-листе между атомами остова (рис. 7) | Val-144 (N-H) |
Cys-80 (:O=) |
2.9 | 20, 100% | 3.1 | 2.7 | 2.8 |
| Между атомами боковых цепей в ядре белка (рис.8) | Asn-116 (:O=) |
Thr-144 (O-H) |
2.8 | 4, 25% | 6.7 | 2.5 | 4.3 |
| Между атомами остова в петле на поверхности (рис.9) | Ile-46 (:O=) |
Glu-49 (N-H) |
2.9 | 20, 100% | 3.3 | 2.8 | 3.1 |
| Между атомами боковых цепей на поверхности (рис.10) | Asp-69 (:O=) |
Gln-99 (N-H) |
2.7 | 2, 10% | 8.9 | 2.7 | 5.1 |
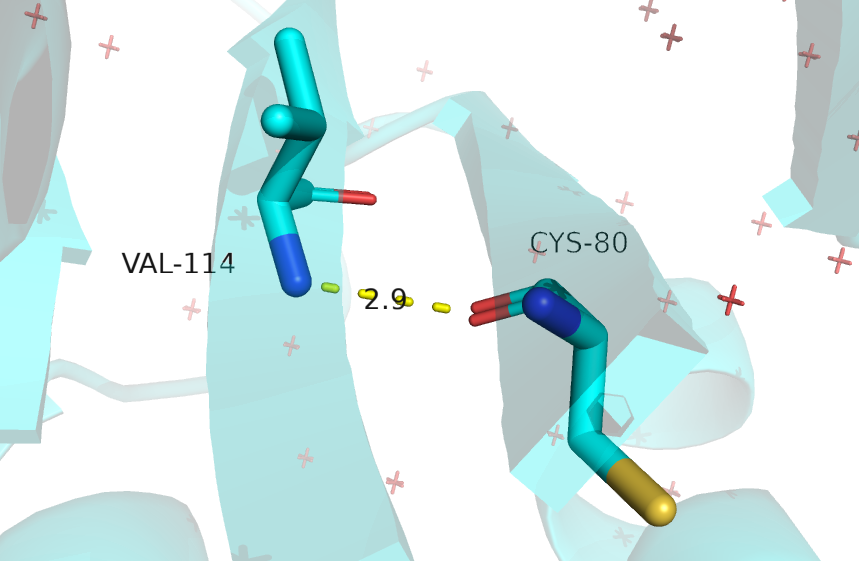 Рис.7 Водородная связь между атомами остова в ядре белка
Рис.7 Водородная связь между атомами остова в ядре белка
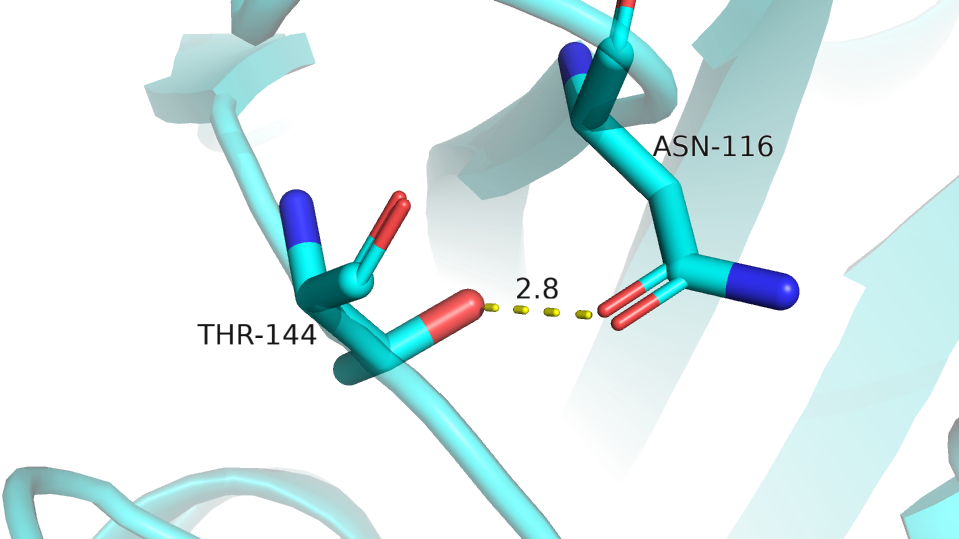 Рис.8 Водородная связь между атомами боковых цепей в ядре белка
Рис.8 Водородная связь между атомами боковых цепей в ядре белка
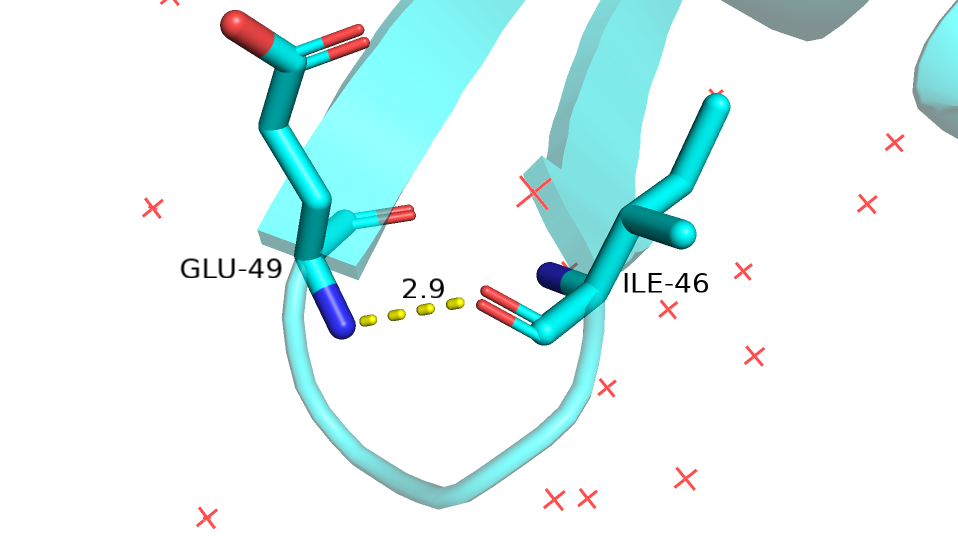 Рис.9 Водородная связь между атомами остова на поверхности ядра
Рис.9 Водородная связь между атомами остова на поверхности ядра
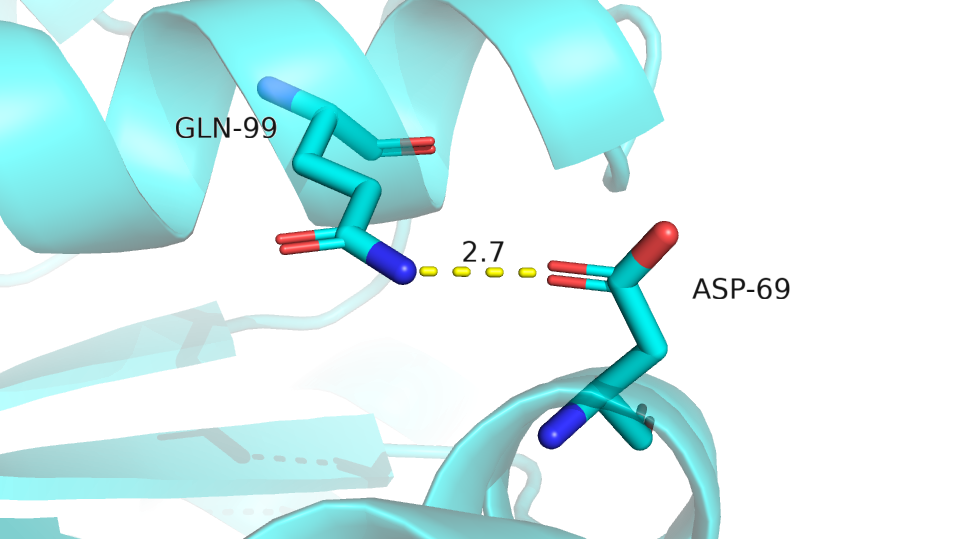 Рис.10 Водородная связь между атомами боковых цепей на поверхности ядра
Рис.10 Водородная связь между атомами боковых цепей на поверхности ядра
Подводя итог можно сказать, что не все водородные связи, найденные в РСА модели, можно обнаружить в ЯМР структурах - где-то есть, где-то нет. Водородные связи между атомами остова находятся во всех структурах ЯМР модели, что внутри глобулы, что на ее поверхности. На поверхности глобулы водородные связи между боковыми цепями остатков очень нестабильны.
© Нестеренко Екатерина 2017-2020