Практикум 8. Разметка вторичной структуры
В этом практикуме работаем с десятью записями PBD, последовательности которых похоже не более, чем на 40%.
1. Знакомство с укладками
Опорной структурой была выбрана 2N172A00. Ниже приведено наложение на нее всех остальных структур.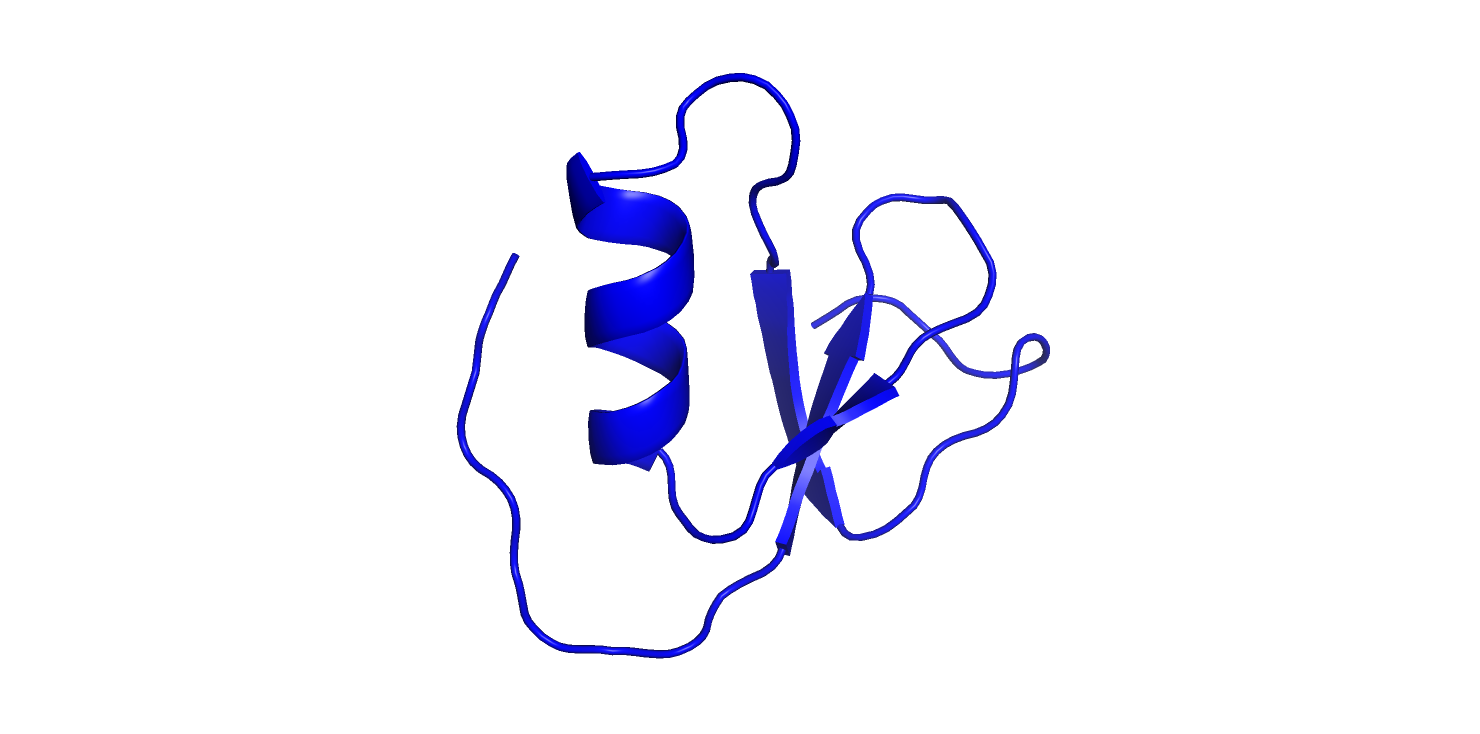 Рис. 1 2n17A00. Общий вид.
Рис. 1 2n17A00. Общий вид.
В выбранной опорной структуре есть правозакрученная альфа-спираль и довольно изогнутый бета-лист.
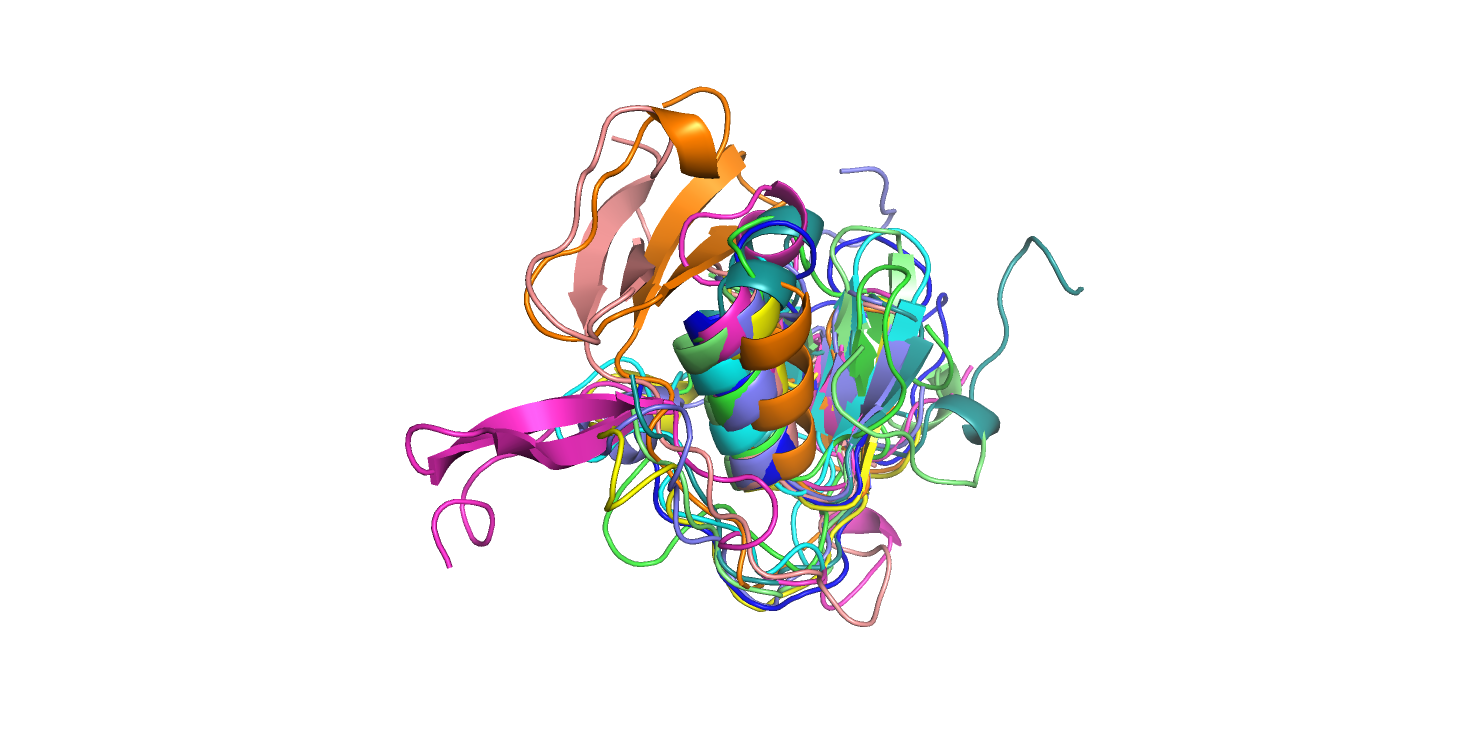 Рис. 2 Наложение всех структур на 2n172A00. 2n17A00 показана синим.
Рис. 2 Наложение всех структур на 2n172A00. 2n17A00 показана синим.
Определенно можно заметить общие части вторичной структуры. Альфа-сприаль в центре размечена так или иначе у всех структур. Небольшие спиральные кусочки размечены в петлях, например, у структур 1nubA01, 1uvgA01, 5daeA00. Есть один бета-лист, который присутствует у всех структур - его можно видеть на рисунке 1. У некоторых белков есть "уникальные" бета-листы (3hh2D04, 2arpF02).
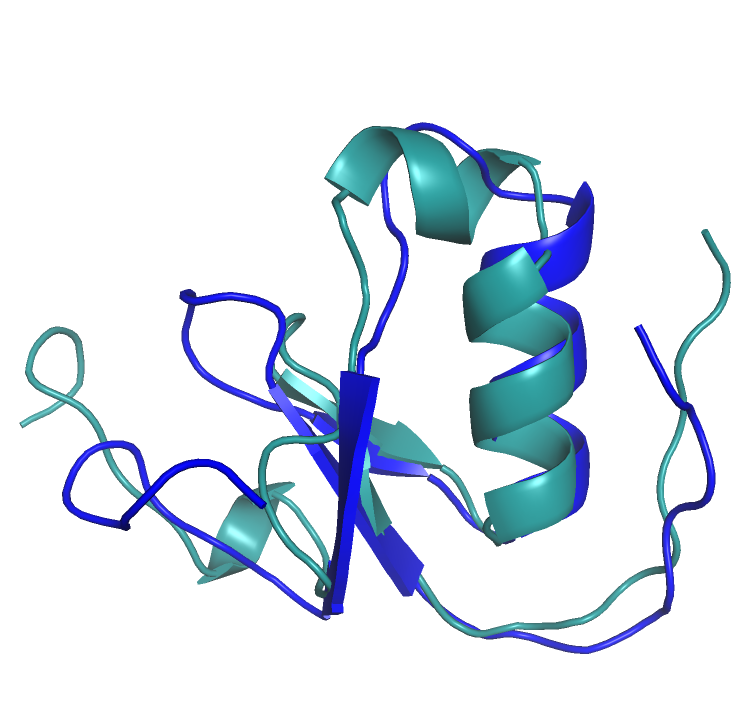 Рис.3 Кусочек альфа-спирали там, где у опорного белка петля. Зеленым показана - 5daeA00. Синим - опорный белок, 2n172A00.
Рис.3 Кусочек альфа-спирали там, где у опорного белка петля. Зеленым показана - 5daeA00. Синим - опорный белок, 2n172A00.
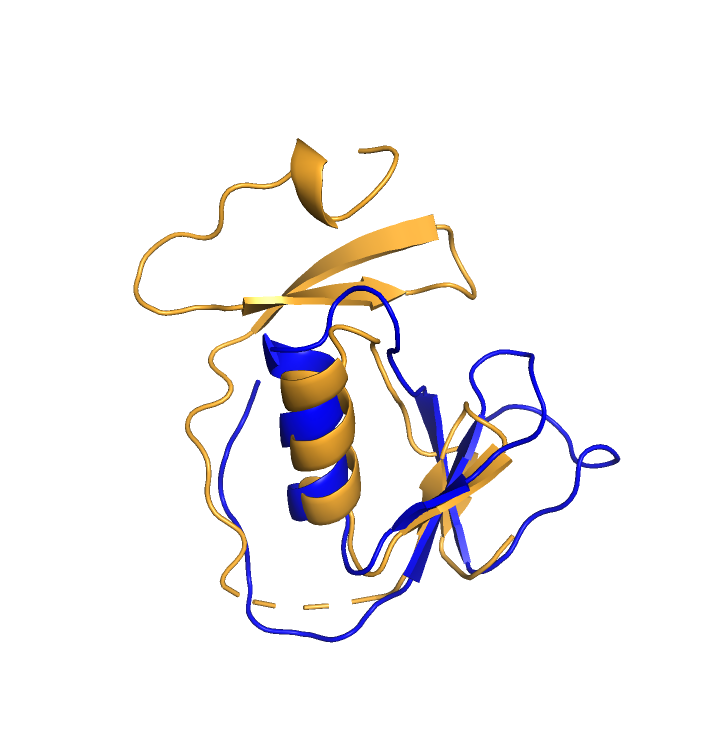 Рис.4 Бета-лист, которого нет у опорного белка. Оранжевым показана - 3hh2D04. Синим - опорный белок, 2n172A00
Рис.4 Бета-лист, которого нет у опорного белка. Оранжевым показана - 3hh2D04. Синим - опорный белок, 2n172A00
Таким образом, полностью третичная структура не совпадает, совпадают некоторые элементы вторичной структуры.
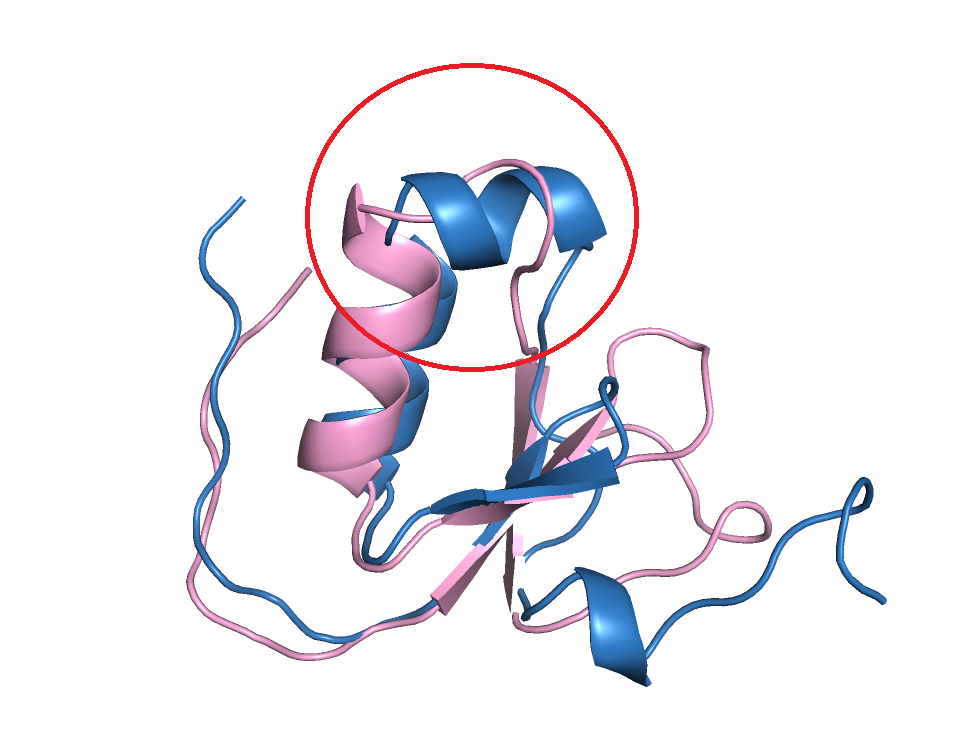 Рис.5 Различия во вторичной структуре - обведены. 2n17A00 (розовый) и 5daeA00 (синий)
Рис.5 Различия во вторичной структуре - обведены. 2n17A00 (розовый) и 5daeA00 (синий)
Посмотрим на свзи, которые позволили распознать здесь альфа-спираль. Действительно в структуре 5daeA00 можно найти паттерн водородных связей характерных для альфа-спирали (рис.6), кислороод остова остатка под номером i образует связь с азотом i+4 остатка. Только в одном месте водородная связь скорее есть между кислородом остова лейцина (Leu36) и азотом боковой цепи аспарагина (Asn40), чем между кислородом лейцина и азотом остова (длинновата - 3.4А и не очень удачно расположен донор), а быть может есть обе вородоные связи.
В случае 2n17A00 изогнутая петля (рис.7) получается из-за двух пролинов. Пролины не образуют водородную связь, поэтому альфа-спирали там получиться не могло.
2. Работа с разметкой вторичной структуры в ручном режиме
Для этого задания были выбраны пары - 2n17A00 (розовый) и 5daeA00 (синий). В структуре 2n172A00 в этом месте находятся остатки с 53 по 57, а в структуре 5daeA00 остатки с 34 по 41. Рис.5 Различия во вторичной структуре - обведены. 2n17A00 (розовый) и 5daeA00 (синий)
Рис.5 Различия во вторичной структуре - обведены. 2n17A00 (розовый) и 5daeA00 (синий)
Посмотрим на свзи, которые позволили распознать здесь альфа-спираль. Действительно в структуре 5daeA00 можно найти паттерн водородных связей характерных для альфа-спирали (рис.6), кислороод остова остатка под номером i образует связь с азотом i+4 остатка. Только в одном месте водородная связь скорее есть между кислородом остова лейцина (Leu36) и азотом боковой цепи аспарагина (Asn40), чем между кислородом лейцина и азотом остова (длинновата - 3.4А и не очень удачно расположен донор), а быть может есть обе вородоные связи.
В случае 2n17A00 изогнутая петля (рис.7) получается из-за двух пролинов. Пролины не образуют водородную связь, поэтому альфа-спирали там получиться не могло.
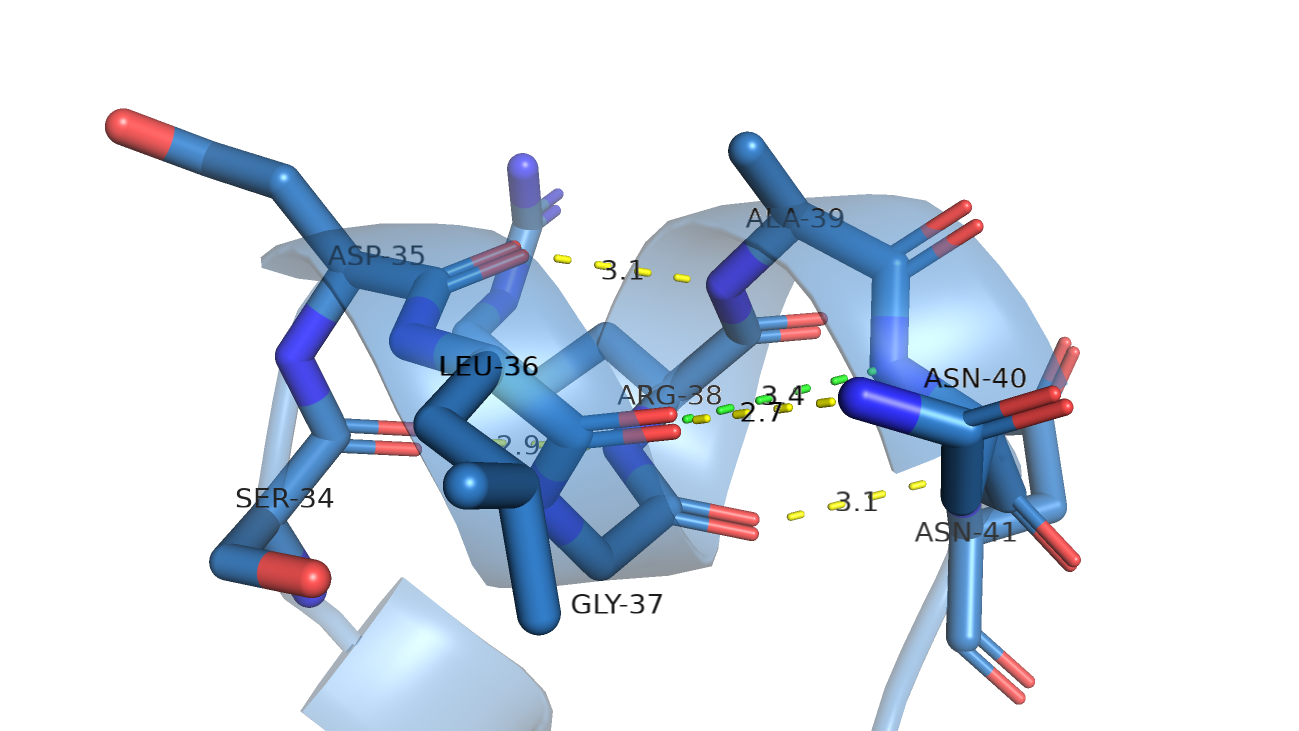 Рис. 6 Остатки в выбранном участке структуры 5daeA00.
Рис. 6 Остатки в выбранном участке структуры 5daeA00.
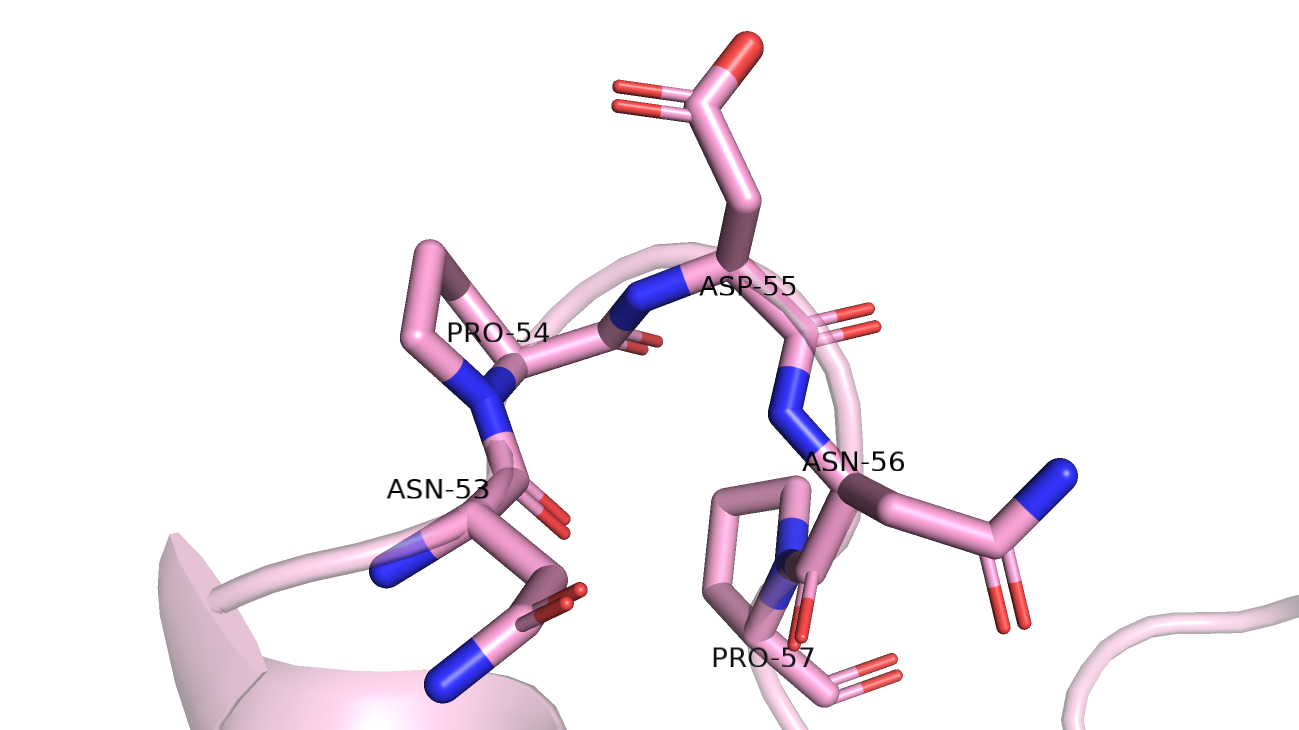 Рис. 7 Остатки в выбранном участке структуры 2n17A00.
Рис. 7 Остатки в выбранном участке структуры 2n17A00.
Подводя итог: различие в разметке оправдано.
3.Работа с разметкой вторичной структуры в автоматическом режиме
С помощью dssp построим разметку для всех десяти PBD записей. Затем с помощью Python было посчитано значение склонности каждого типа аминокислоты образовывать тот или иной вид вторичной структуры. Элементы вторичной структуры поделили на три класса: альфа-спирали, бета-листы и петли. В таблице приведены полученные значения для моей выборки.Примерs отстатков, которые чаще образует альфа-спирали - метионин, лейцин, аланин. Чаще образуют бета-листы - валин, треонин. Чаще образуют петли - глутамин, пролин.
© Нестеренко Екатерина 2017-2020