При укладке полипептидная цепь белка стремится принять энергетически выгодную форму, характеризующуюся минимумом свободной энергии.
Поэтому гидрофобные радикалы аминокислот стремятся к объединению внутри глобулярной структуры растворимых в воде белков.
Между ними возникают так называемые гидрофобные взаимодействия, а также силы ван-дер-Ваальса между близко прилегающими друг к другу атомами.
В результате внутри белковой глобулы формируется гидрофобное ядро. Гидрофильные группы пептидного остова при формировании вторичной структуры
образуют множество водородных связей, благодаря чему исключается связывание с ними воды и разрушение внутренней, плотной структуры белка.
[2]
В молекуле B3-металло-лактамазы можно наблюдать 2 больших гидрофобных ядра(1 и 5),
соответствующие 2 субьединицам белка(цепи А и В). Гидрофобное ядро 1 содержит 519 атомов(12,85% от всех атомов молекулы), гидрофобное ядро 5 - 508 атомов(12,58%).
Остальные ядра намного меньше и содержат по 3 атома, (исключение - гидрофобное ядро 6 - 4). Каждое из них составляет около 0,07% от общего числа атомов в молекуле,
а их суммарное соотношение - 0,62%.
Атомы, которые почти полностью покрывают поверхность гидрофобных ядер находятся на расстоянии примерно 5.0 А.
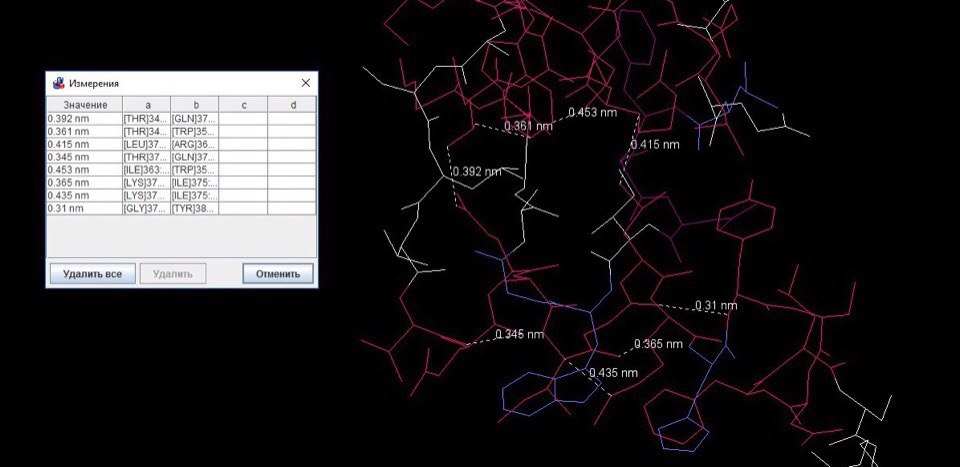
Расстояние между соседними не связанными ковалентно атомами в белке в среднем составляет 3,873 ангстрем.(см.рис2)
Диаметр молекулы воды, которая по своей сути представляет большой кислород. диаметр молекулы кислорода равен 2r=1,4*2=2,8 ангстрем.
Однако, в расстояние между атомами боковых цепей белка также входят и радиусы. наименьшим радиусом обладает кислород, следовательно, для того чтобы
молекула воды могла поместиться между атомами боковых цепей, расстояние между ними должно быть не меньше 5,6 ангстрем. 3,873 < 5,6.
Получаем противоречие.
Рисунок 2. Измерение углов между атомами белка, не связанными ковалентно.
Можно заметить, что предложенный днк-белковый комплекс 5IIM, комплекс днк и днк-полимеразы лямбда.
Она относится к классу днк-полимераз,
функция которых заключается в синтезе участка ДНК длиной в один или несколько dNMP(дезоксинуклеозид-5'-монофосфат)
при наличии поврежденных звеньев в матрице и невозможности их репарации.
Молекула белка в комплексе с ДНК способна быстрее реагировать на повреждения нуклеотидов матрицы ДНК.
Еще один пример днк-белкового комплекса - хроматин, комплекс ДНК с гистонами в клетках эукариот, смысл которого - плотная упаковка и конденсация днк.
Днк-белковые комплексы образуют некоторые специфические белки, например ДНК-связывающие соединения, которые способны связываться с
ДНК вируса и подавлять развитие вирусного цитопатического эффекта.
Множество ферментов, участвующих в репликации образуют ДНК-белковые комплексы: хеликазы(расплетают цепь днк), лигазы(сшивают фрагменты Оказаки на отстающей цепи),
днк-полимераза 1 и 3(достраивают комплементарную цепь).
[3]
Таблица1. Атомы белка, контактирующие с ДНК.
| Сравнительная характеристика полярных и неполярных атомов, связанных с сахаро-фосфатным остовом ДНК.
|
| | Полярные атомы | Неполярные атомы |
| Кислород | Азот | Углерод | Сера | Фосфор |
| количество атомов | 55 | 76 | 414 | 1 | 19 |
| всего | 131 | 434 |
Можно заметить, что больше всего атомов углерода - вероятно это атомы углеродного скелета аминокислот(если считать что 1 азот соответствует одной аминокислоте
то получится 5,44 атомов углерода на 1 аминокислоту(всегда есть 3 атома, кроме глицина).
Можно считать что связи между днк и белком в основном гидрофобные, можно заметить такие гидрофобные аминокислоты как триптофан и лейцин, изолейцин и другие.
Также видно водородные связи, образующиеся между сахарофосфатным остовом ДНК(кислород у фосфатной группы - акцептор водорода, аминогруппа - донор)
и азотом положительно заряженных радикалов аминокислот(аргинин).
Источники:
- База данных RCSB PDB
- Северин "Биохимия"
- РФФИ
- Биология и медицина
|
