- Краткое описание структуры в файле 1h88.pdb
В файле приведены координаты атомов следующих 4 молекул: 1.CAAT/энхансер связывающий белок бета(цепи A, B) Название организма: HOMO SAPIENS 2.MYB прото-онкогенный белок(цепь C) Название организма: MUS MUSCULUS 3.Молекула: 5'-D(*GP*AP*TP*GP*TP*GP*GP*CP*GP*CP*AP*AP*TP*CP*CP*TP*TP*AP*AP*CP*GP*GP*AP*CP*TP*G)-3'(цепь D) 4.Молекула: 5'-D(*CP*CP*AP*GP*TP*CP*CP*GP*TP*TP*AP*AP*GP*GP*AP*TP*TP*GP*CP*GP*CP*CP*AP*CP*AP*T)-3'(цепь E)
Для исследования были выбраны цепь C белка и цепи D и E ДНК со следующей последовательностью:
цепь D [1] 5'- GATGTGGCGCAATCCTTAACGGACTG -3' [26]
|||||||||||||||||||||||||
цепь E [26] 3'- TACACCGCGTTAGGAATTGCCTGACC -5' [1]
1.CAAT/энхансер связывающий белок бета(C/EBP BETA, NFIL-6)
Функции: Важный транскрипционный активатор в регуляции генов, вовлечённых в иммунный и воспалительный ответ.
Специфически связывается с реакционным элементом IL-1 в гене IL-6. NF-IL6 также связывается с регуляторными областями
нескольких генов цитокинов. Вероятно, это играет роль в регуляции воспаления и кроветворения. Типичный сайт узнавания это 5'-T[TG]NNGNAA[TG]-3'. Особенности:Связывает ДНК как димер и может формировать стабильные гетеродимеры с C/EBP альфа, дельта, гамма. Взаимодействует с TRIM28 и PTGES2.
2.MYB прото-онкогенный белок
Функции: Активатор транскрипции, ДНК-связывающий белок, специфически узнающий последовательность 5'-YAAC[GT]G-3'.
Играет важную роль в контроле пролиферации и дифференцации кроветворных клеток-предшественниц.
определено, что молекула ДНК имеет B-форму. Были определены средние значения торсионных углов для внутренних нуклеотидов
(для всех, кроме краевых). Были найдены самые "кривые" нуклеотиды со значениями торсионных углов, наиболее отклоняющимися от средних. Ими оказались: нуклеотид C9 из цепи D и нуклеотидA16 из цепи E.
Значения торсионных углов и их средние значения сохранены в файле Excel Torsion Angles.xls
В целом, связывание с белком в данном случае приводит к несущественной деформации ДНК, связаной со взамодействием остатков, принадлежащих ДНК и белку с целью создания наиболее выгодной в энергетическом плане структуры.
| Полярные | Неполярные | Всего | |
| остатками 2'-дезоксирибозы | |||
| остатками фосфорной кислоты | |||
| остатками азотистых оснований со стороны большой бороздки | |||
| остатками азотистых оснований со стороны малой бороздки |
В файле my_dna.def находятся определенные множества
атомов, понадобившиеся при заполнении таблицы. Наибольшее число
контактов
наблюдается с остатками
фосфорной кислоты, что объясняется тем, что они занимают граничное положение
в структуре
ДНК,
и в связи с этим могут свободно взаимодействовать с
аминокислотными остатками белка.
Предварительно был создан файл 1H88NEW_OLD.PDB, содержащий ДНК и исследуемую цепь С. Далее на сервере kodomo-count.cmm.msu.ru программе nucplot была введена команда nucplot 1H88NEW_OLD.PDB. В результате была получена следующая картинка:

Полученная схема на картинке не согласуется с результатами, полученными в упражнении IV, так как на картинке представлено намного
меньшее количество связей, что объясняется тем, что программа nucplot распознаёт и показывает не отдельные связи, а целые зоны связывания, что и обуславливает расхождение полученных данных.
1.аминокислотные остатки белка должны связываться непосредственно с нуклеотидом из ДНК
2.контакт должен располагаться в месте "сгущения" взаимодействий ДНК с белком
В результаты было выбрано взаимодействие Asn179(C) с A19 из цепи D ДНК, осуществляющееся посредством 2-ух связей:
из исследуемого комплекса молекул, представленного в файле 1h88.pdb:
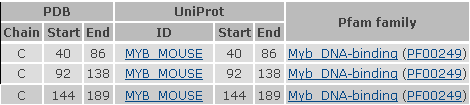
Данные, полученные через InterPro
Идентификатор: IPR014778Название ДНК-связывающего домена: Myb_DNA-binding
Ретровирусный онкоген c-myb кодирует ядерные ДНК-связывающие белки. Он принадлежит к семейству доменов SANT, члены которого специфично узнают последовательность YAACTG. В одном из наиболее консервативных регионов myb, состоящем из трёх последовательно-соединенных повторяющихся участков,
была показана его принадлежность к связыванию ДНК.