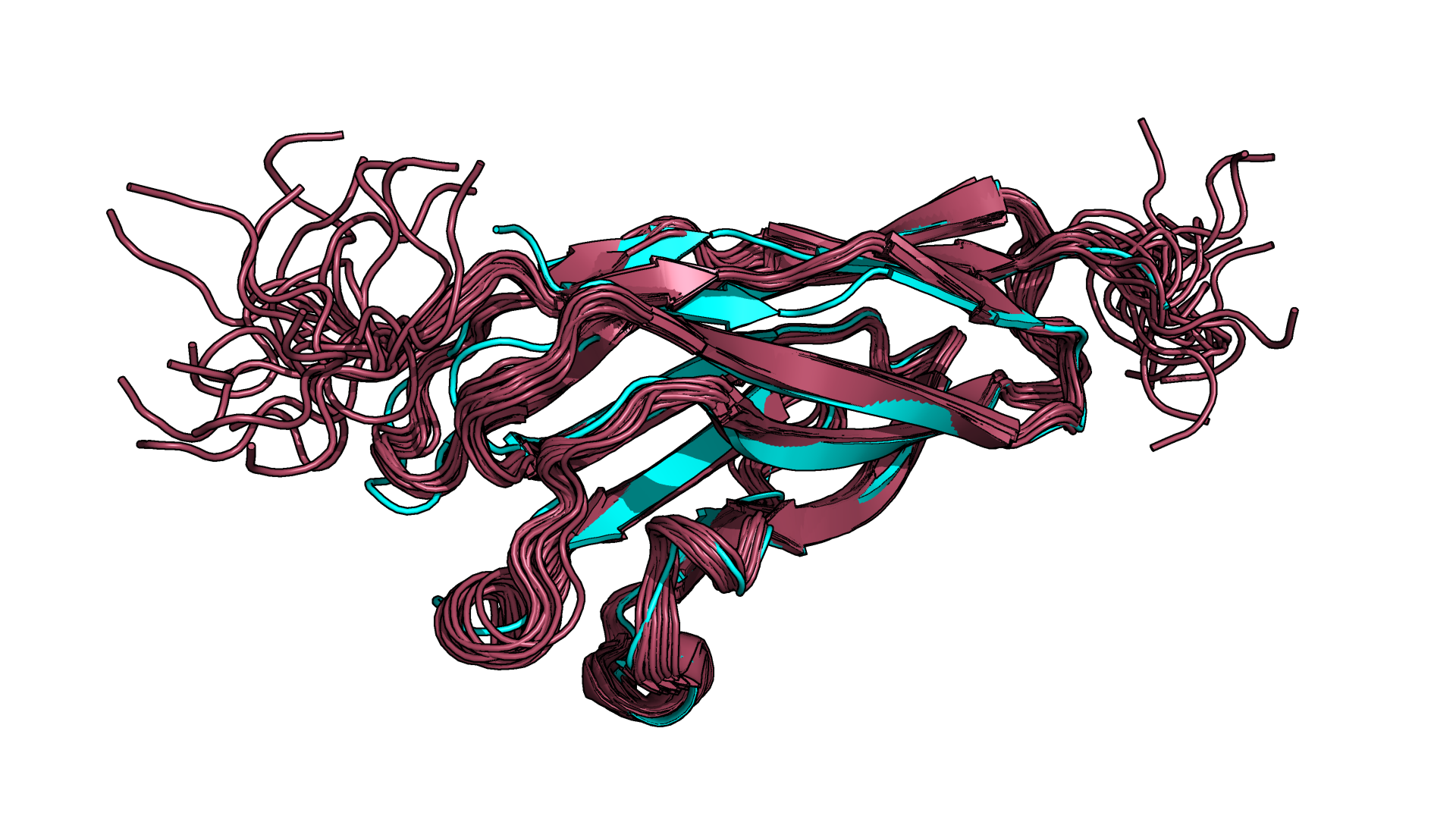
Рисунок 1.1. Наслоение модели 6KGC (РСА, бирюзовый цвет) на модели 6KG8 (ЯМР, красный цвет).
PDB IDs: 6KG8 (ЯМР) и 6KGC (РСА)
Название белка: Белок целлюлосомного каркаса
Разрешение РСА: 1.60 Å
Число моделей ЯМР: 20
Сравним предложенные структуры, полученные методами ЯМР и РСА:

Рисунок 1.1. Наслоение модели 6KGC (РСА, бирюзовый цвет) на модели 6KG8 (ЯМР, красный цвет).
Прежде всего хочется отметить, что в структуре, полученной с помощью РСА (6KGC), была также вода, ионы кальция и молекула
еще одного белка (целлюлозосвязывающая эндоглюканаза). Это не отражено на рис. 1.1., так как для наглядности выравнивания
я скрыла перечисленные элементы. При этом в методе ЯМР используется дейтерированный растворитель, который не детектируется, и рассмотреть его мы не можем.
Также мне бросилось в глаза, что в ЯМР моделях в некоторых местах мы можем наблюдать "неестественно" скрученные бета-листы,
в то время как в РСА модели в таких фрагментах находятся петли, что, как мне кажется, более реалистично.
Наиболее яркие отличия в двух структурах (и даже в рамках ЯМР структуры для разных моделей) можно наблюдать на концевых петлях,
где, по-видимому, очень высокая подвижность остатков. И в целом петли выровнялись хуже, чем бета-листы, что, как мне кажется,
также объясняется более высокой подвижностью остатков в петлях.
На глаз я выбрала один из таких неудачно выровнявшихся фрагментов петель и решила рассмотреть его поближе.
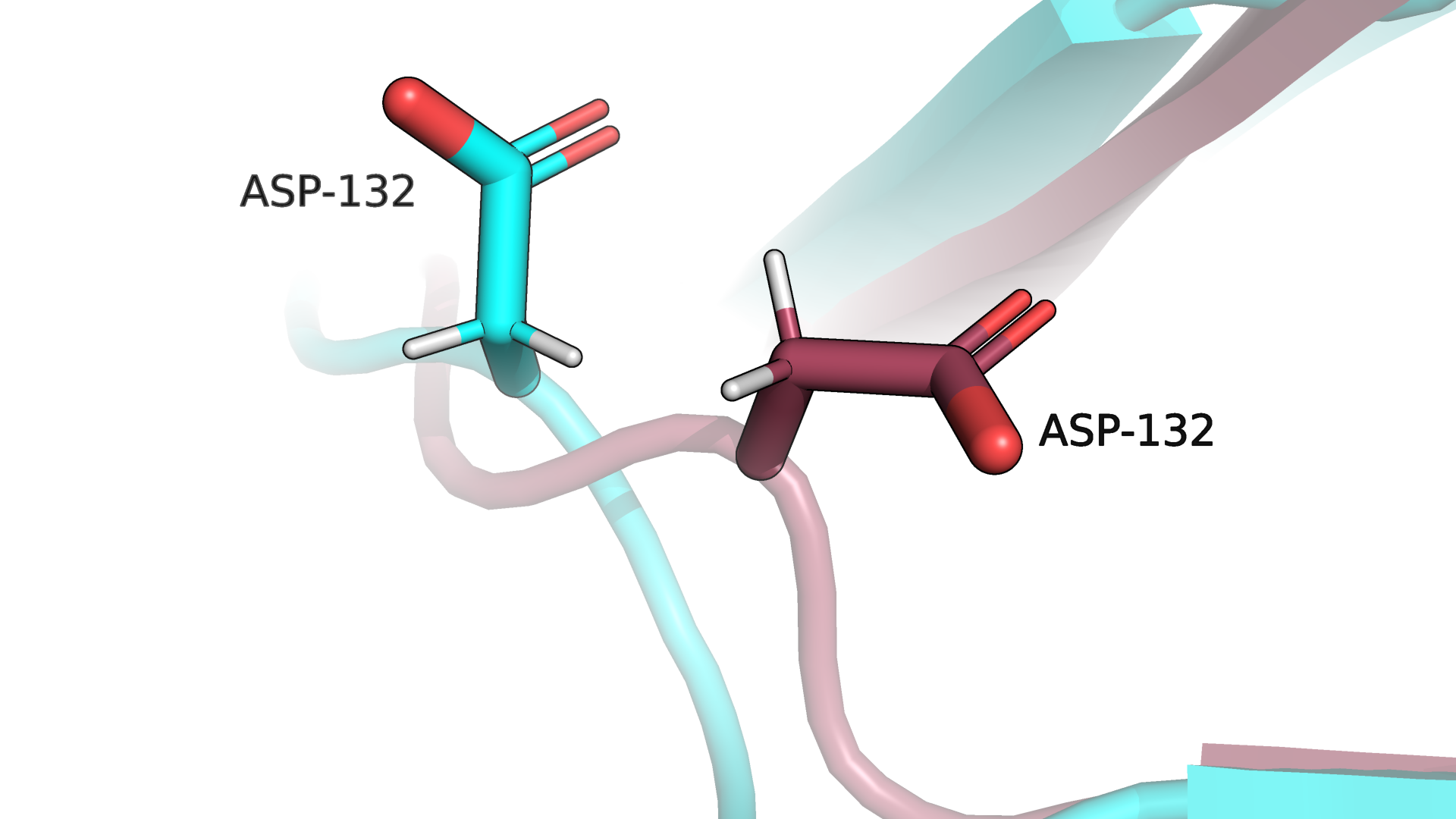
Рисунок 1.2. Asp-132 при наслоении модели 6KGC (РСА, бирюзовый цвет) на модели 6KG8 (ЯМР, красный цвет).
Разрешение структуры, полученное с помощью РСА, весьма хорошее (1.60 Å), благодаря чему видны водороды, как и в структуре, полученной при помощи ЯМР. При этом сразу же бросается в глаза то, что рассматриваемый аминокислотный остаток смотрит в разные стороны в двух структурах, полученных различными методами.
PDB IDs: 6KG8 (ЯМР) и 6KGC (РСА)
В данном задании необходимо было рассмотреть, как отличается В-фактор остатков в
зависимости от их подвижности, мерой которой является RMSF.
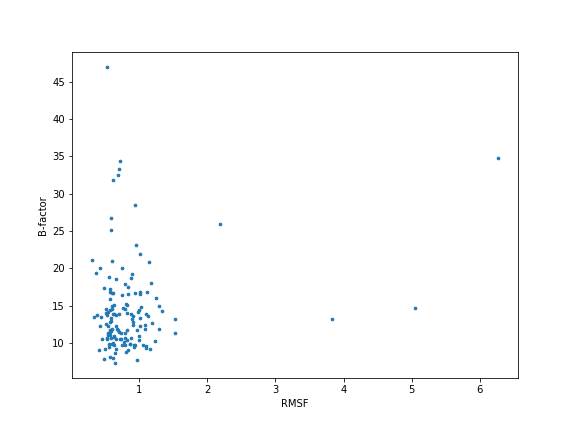
Рисунок 2.1. График зависимости B-фактора от RMSF.
На точечном графике (рис. 2.1) мы можем наблюдать зависимость B-фактора аминокислотных остатков, полученных из РСА структуры, от RMSF из ЯМР структуры.
Сначала я убрала остатки, которые не совпадают у обеих моделей, чтобы значения B-фактора и RMSF попарно соответствовали одному и тому же аминокислотному остатку.
В областях с большим RMSF B-фактор действительно либо большой, либо средний,
но большой В-фактор также (даже чаще) встречается у остатков с низким значением RMSF.
Также есть много остатков со средним В-фактором при низком RMSF и
остатки с довольно низким значением В-фактора при средних значениях RMSF.
В принципе, сама структура белка наводит на мысль о том, что он довольно малоподвижный, за исключением боковых петель, часть
аминокислотных остатков которых, по видимому, очень подвижны, из-за чего электронная плотность в данных участках сильно размыта, так,
что авторы структуры (РСА) не смогли вписать туда эти подвижные аминокислотные остатки. Из-за этого, как я понимаю, мы по сути
потеряли информацию о сильно подвижных участках с аминокислотными остатками, атомы которых предположительно имеют высокий B-фактор
(т.к. нам пришлось отбросить эти не совпадающие у обеих моделей аминокислотные остатки).
PDB IDs: 6KG8 (ЯМР) и 6KGC (РСА)
В этом было необходимо сравнить водородные связи в различных участках белка. Результаты по этому заданию представлены в
сводной таблице (табл.1):
Таблица 1. Сравнительная таблица для каждого из трех "типов" водородной связи.
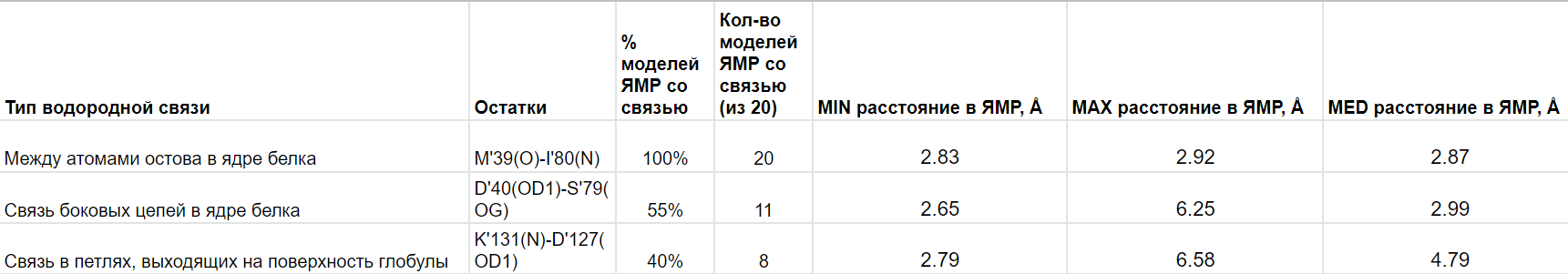
Водородная связь между атомами остова в ядре белка сохраняется во всех моделях структуры из ЯМР.
По-видимому, это связано с тем, что бета-лист - довольно устойчивая вторичная структура, подвижность остова в которой ограничена. (Рис.3.1-3.2)
В случае водородной связи между атомами боковых цепей в ядре белка (рис.3.3-3.4) уже только 55% моделей ЯМР структуры сохраняют данную связь. Боковая цепь гораздо подвижнее даже в ядре белка, что,
кстати, можно было заметить даже в первом случае на рис.3.1-3.2. На рисунке 3.4 можно наблюдать пример потери водородной связи для одной из моделей ЯМР.
Похожую ситуацию мы можем наблюдать в случае водородной связи в петле, выходящей на поверхность глобулы (рис. 3.5-3.6). В данном примере
только 40% моделей ЯМР структуры сохраняют рассматриваемую водородную связь (на рис. 3.6 также пример потери водородной связи для одной из моделей структуры ЯМР).
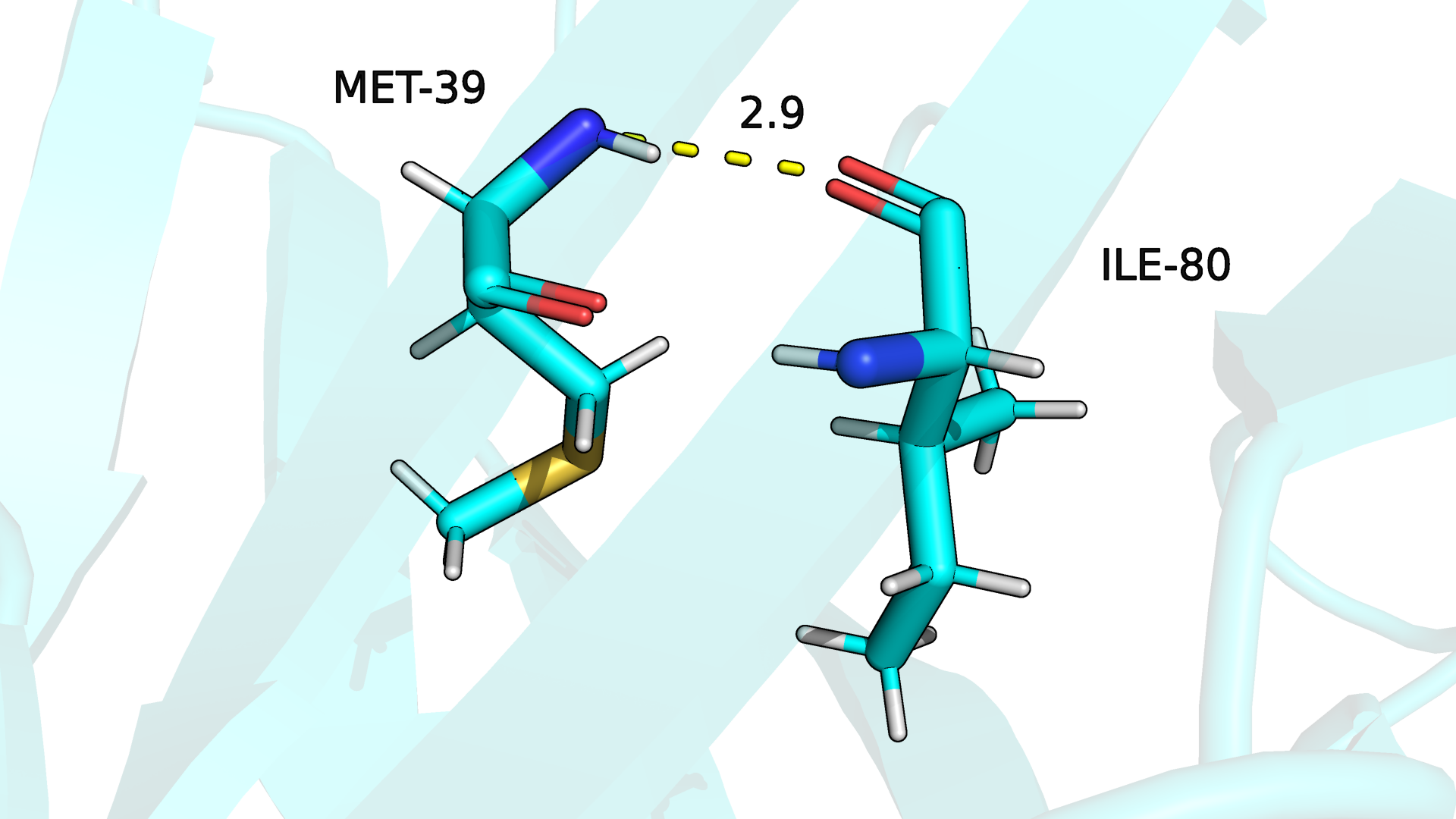
Рисунок 3.1. Водородная связь между атомами остова в ядре белка в бета-листе (РСА).
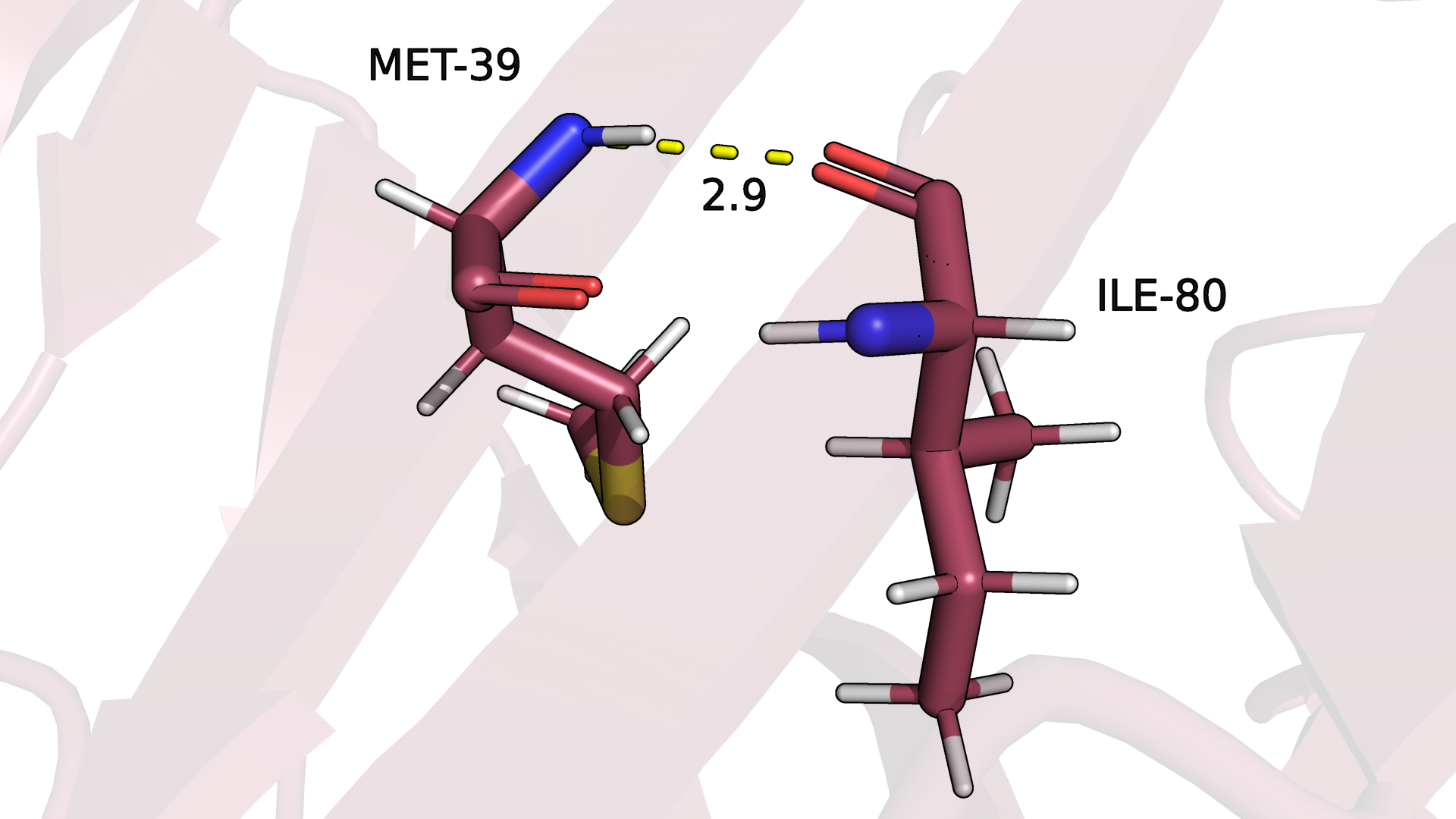
Рисунок 3.2. Водородная связь между атомами остова в ядре белка в бета-листе (одна из моделей ЯМР).
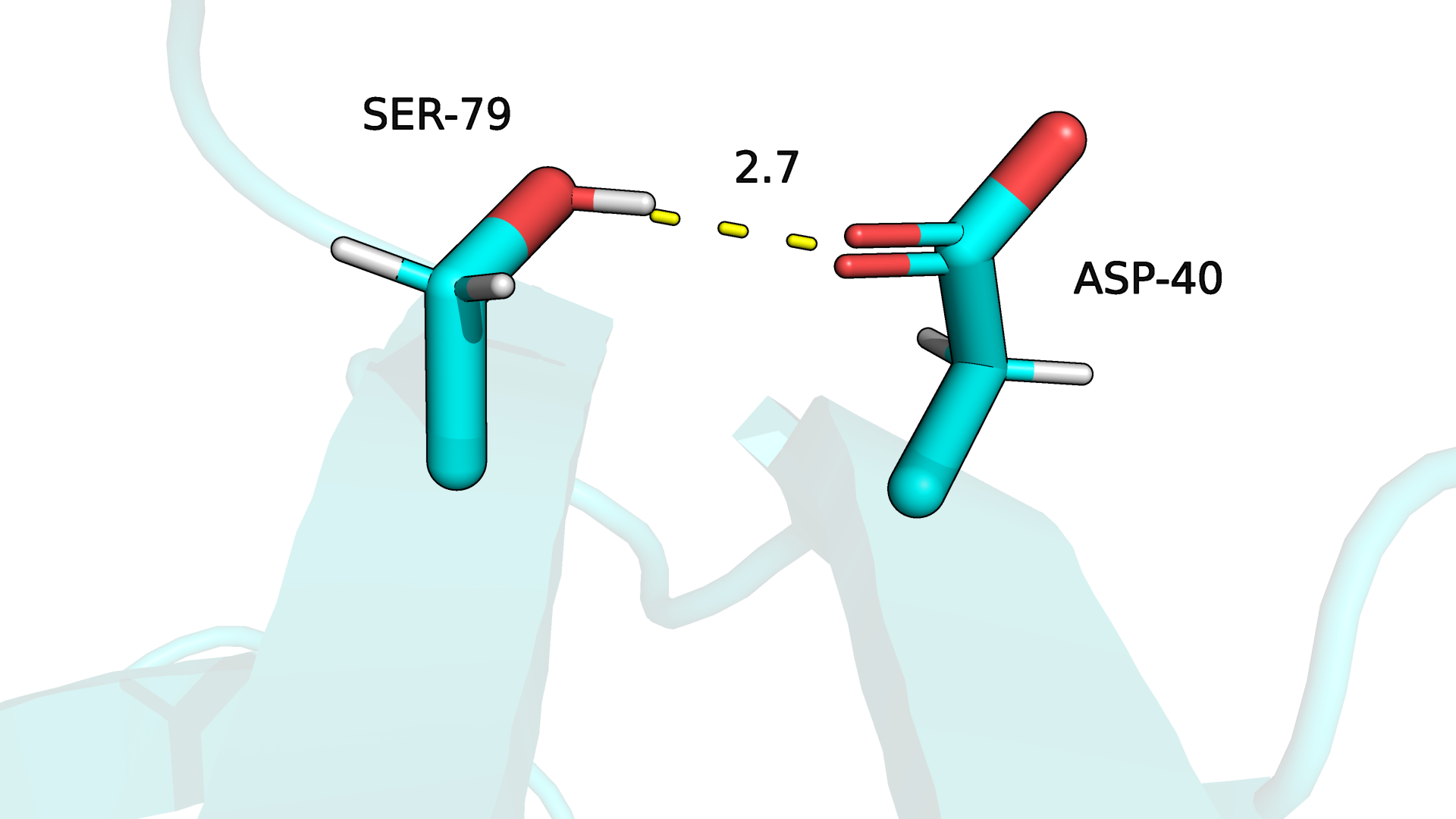
Рисунок 3.3. Водородная связь боковых цепей в ядре белка (РСА).
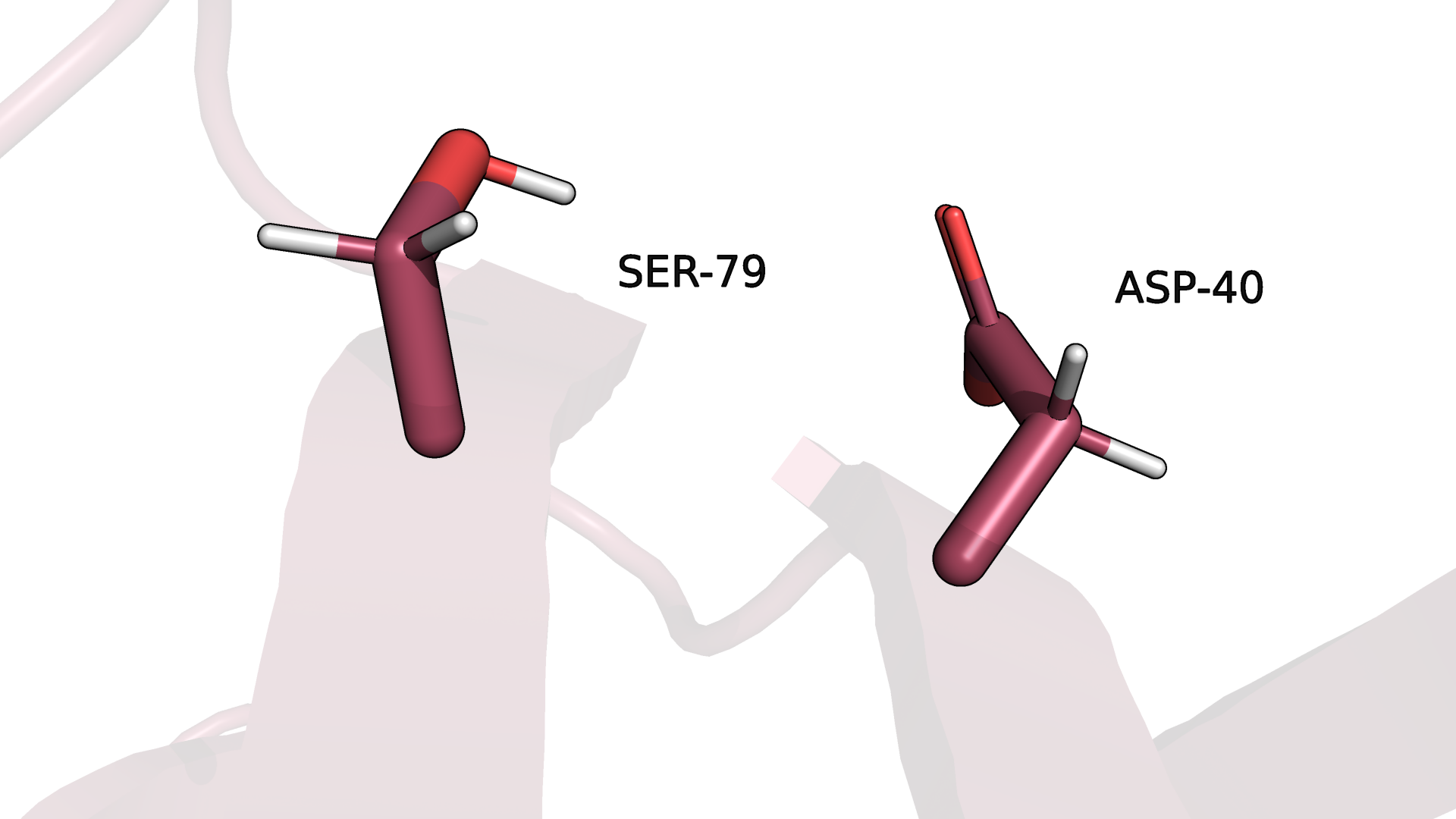
Рисунок 3.4. Водородная связь боковых цепей в ядре белка (одна из моделей ЯМР).
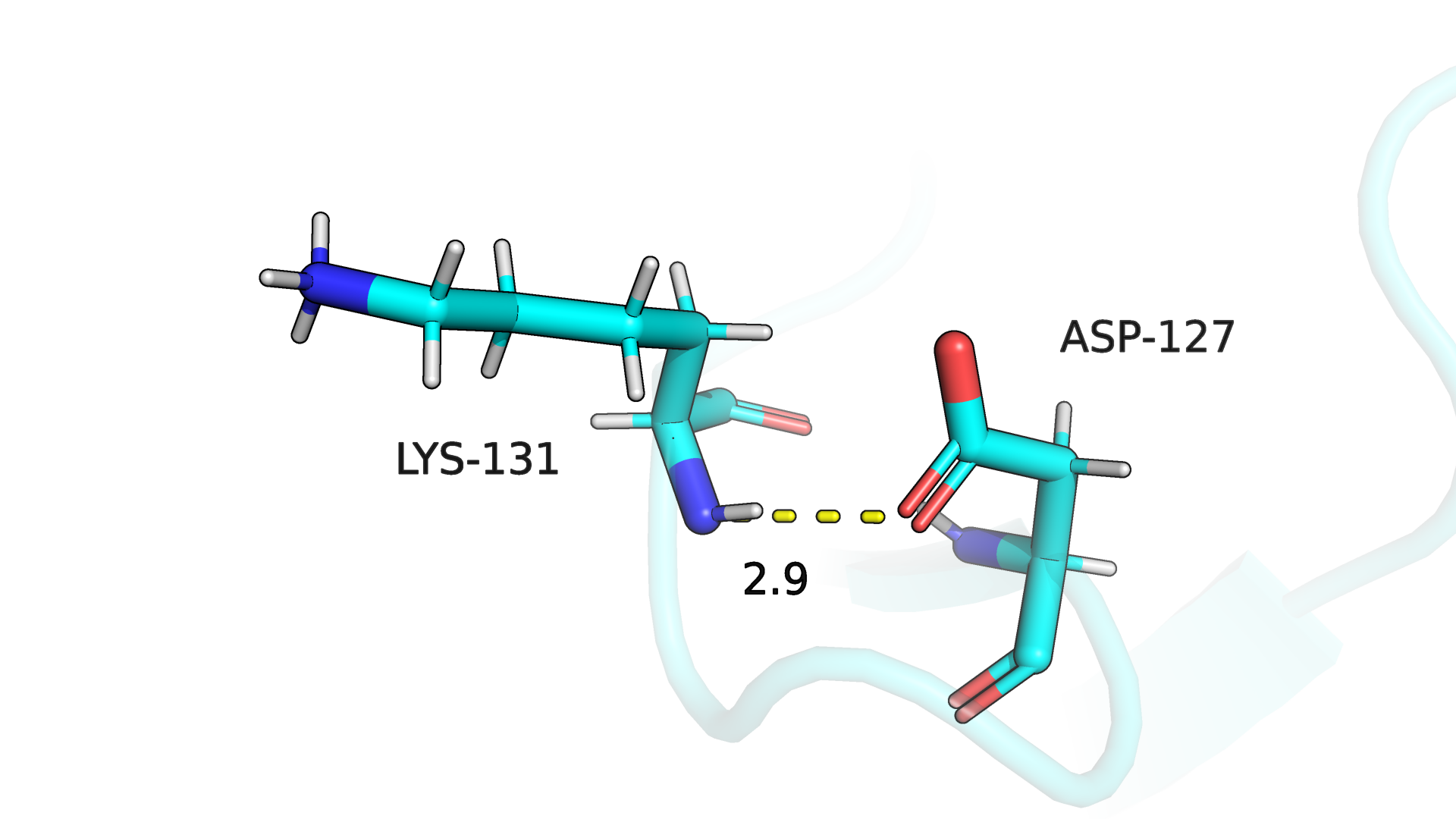
Рисунок 3.5. Водородная связь в петле, выходящей на поверхность глобулы (РСА).
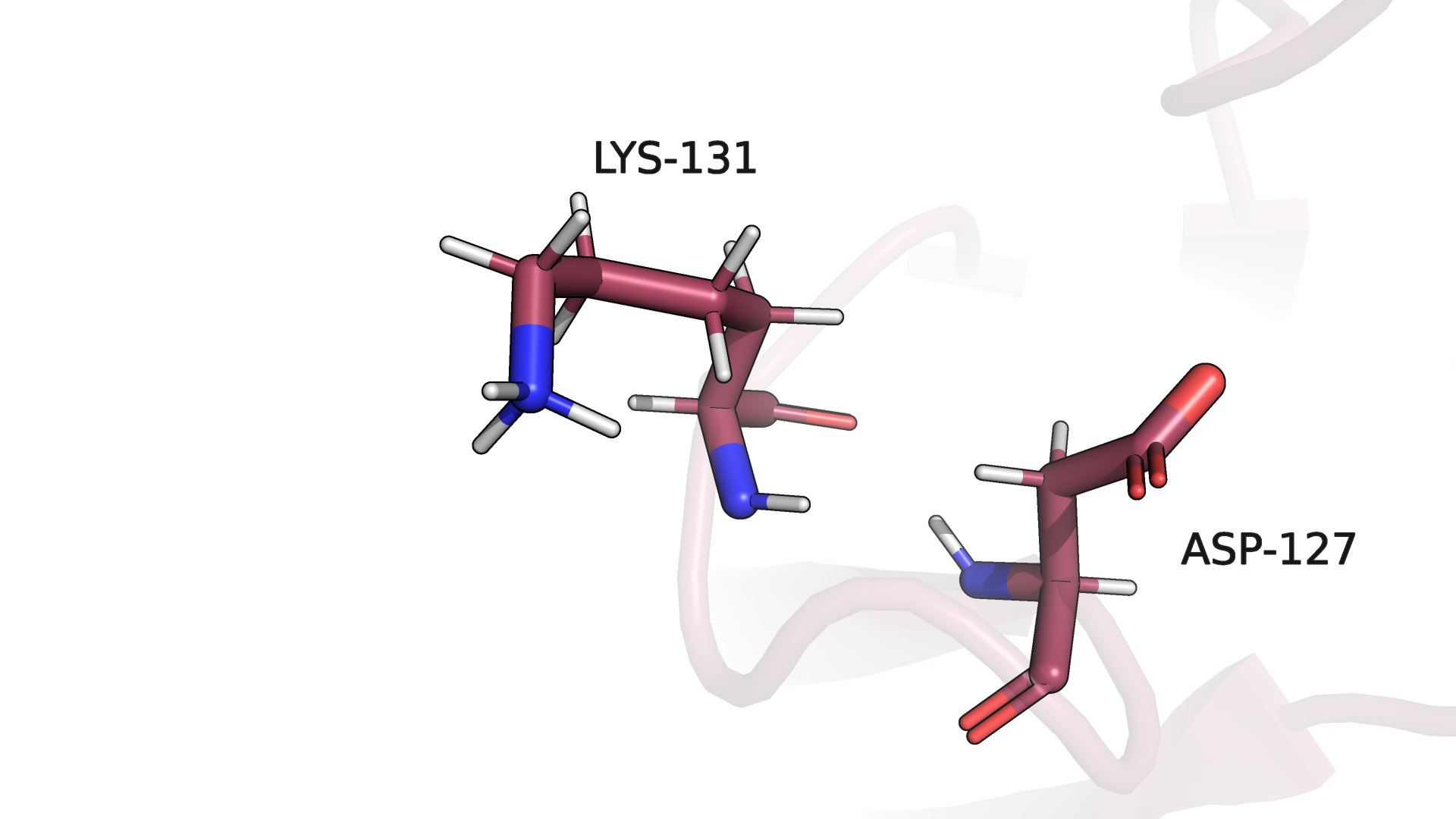
Рисунок 3.6. Водородная связь в петле, выходящей на поверхность глобулы (одна из моделей ЯМР).
© Макиевская Кьяра, 2017-2020