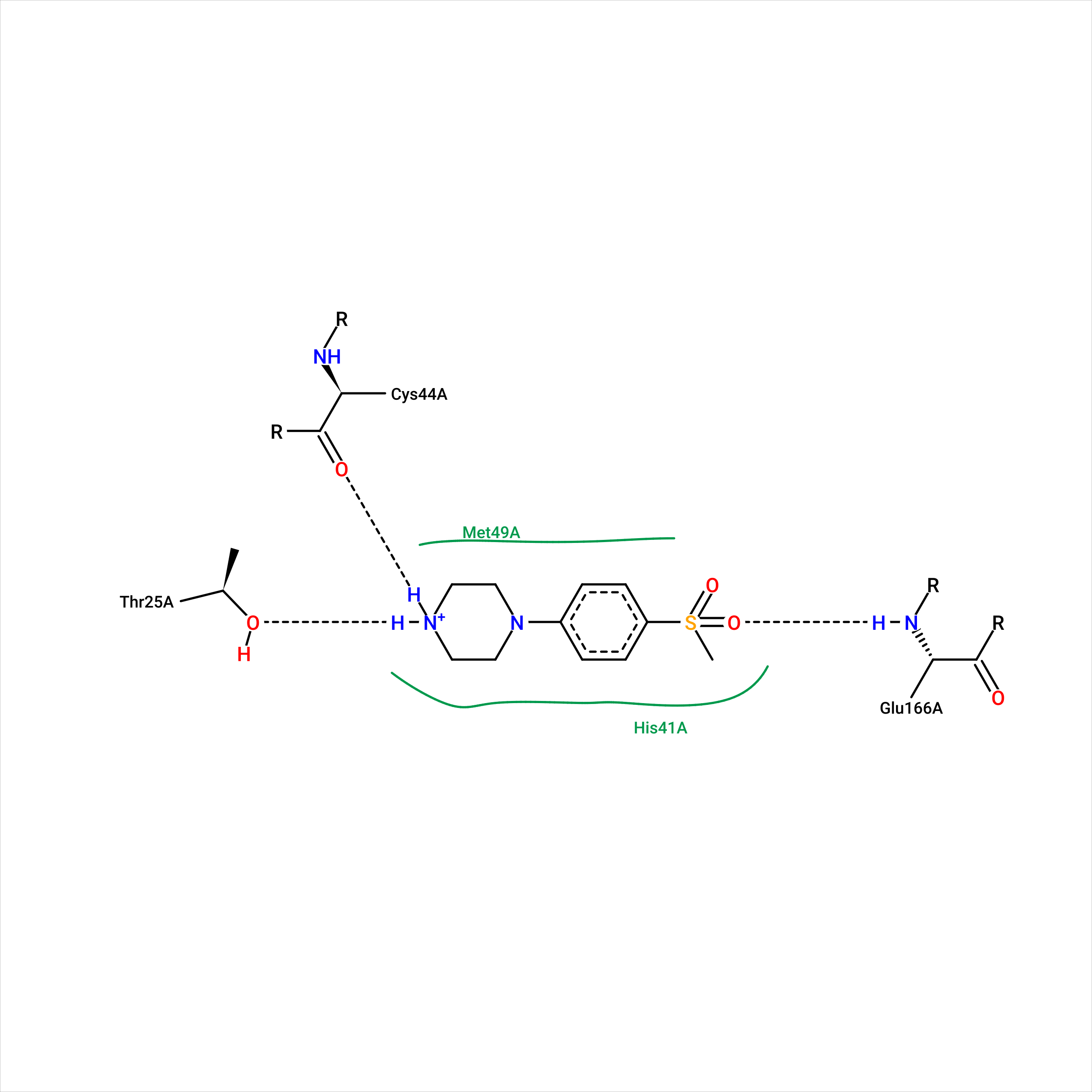
Рисунок 1.1. Полученная с помощью PoseView 2D-диаграмма взаимодействий протеазы SARS-CoV-2 с лигандом US7.
PDB ID: 5RHD.
В этом задании необходимо было использовать PDB ID из первого практикума (5RHD) структуры протеазы Sars-Cov-2 с лигандом.
С помощью PoseView на сайте Protein Plus была сгенерирована 2D-диаграмма этой структуры (рис. 1.1):

Рисунок 1.1. Полученная с помощью PoseView 2D-диаграмма взаимодействий протеазы SARS-CoV-2 с лигандом US7.
В целом, PoseView вывела на диаграмму те же остатки, что и я показала как потенциально интересные при выполнении практикума №1, за исключением того, что я не рассматривала в практикуме №1 гидрофобные вазимодействия, а PoseView это учла (рис. 1.2). И если His-41 я отмечала в силу предположительно имеющего место слабого стекинга, то Met-49, вступающего в гидрофобное взаимодействие (отмечен зеленым на диаграмме, как и His-41), я проглядела.
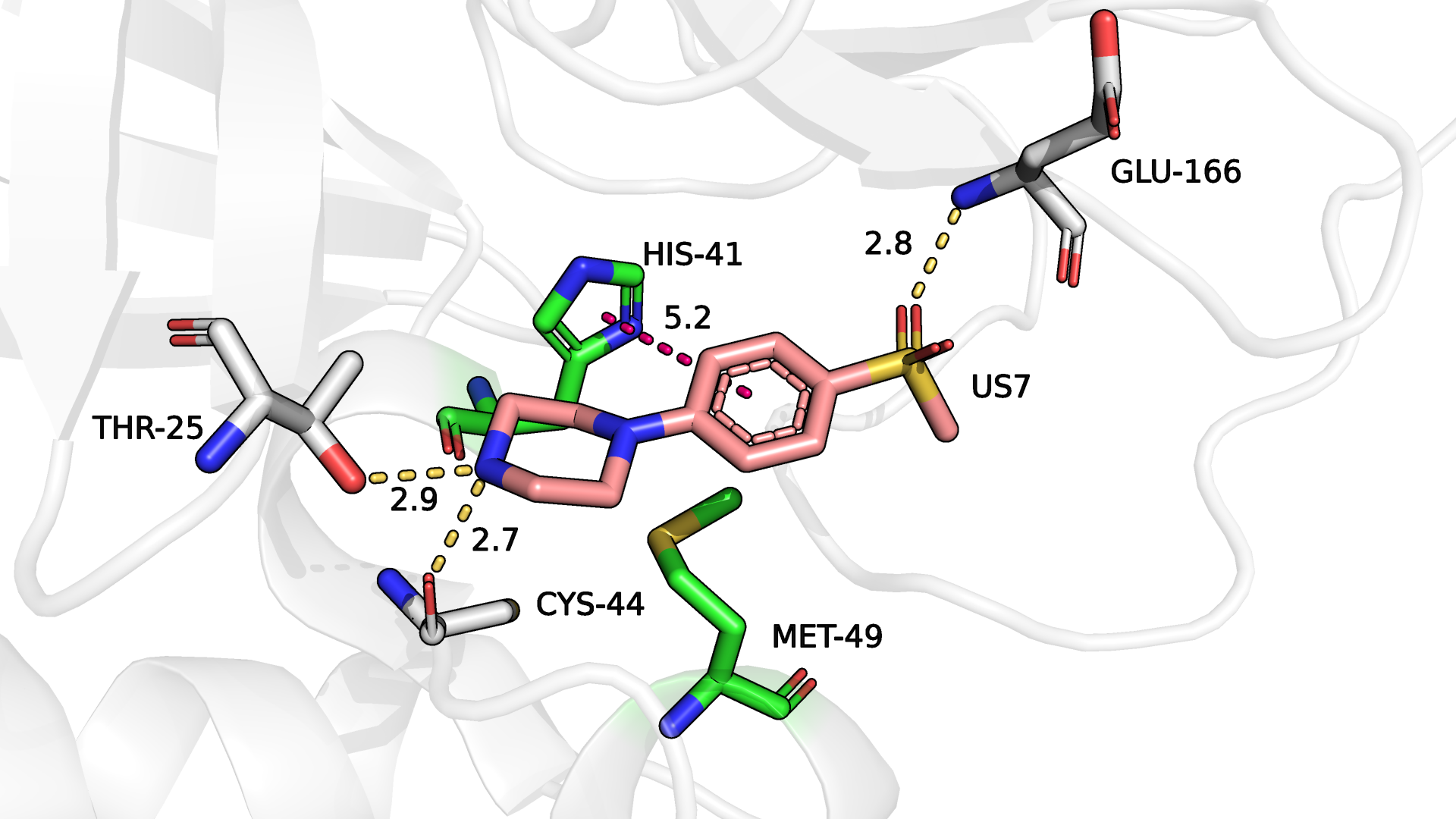
Рисунок 1.2. Отрендеренное изображение участка протеазы SARS-CoV-2 с лигандом US7. Желто-оранжевым цветом отмечены предположительные водородные связи, а розовым - предположительный стекинг. Зеленые остатки выведены на 2D диаграмму программой PoseView и определены ею как остатки, участвующие в гидрофобных взаимодействиях.
Гидрофобные взаимодействия приводят к тому, что связанной воды становится меньше, и фактически уменьшается площадь поверхности, доступной растворителю. Если посмотреть с surface и отображением связанной воды (рис. 1.3) на сайт и лиганд, то можно обратить внимание на то, что в сайте и вокруг лиганда около указанных PoseView остатков связанной воды меньше, чем в удалении от этих остатков.
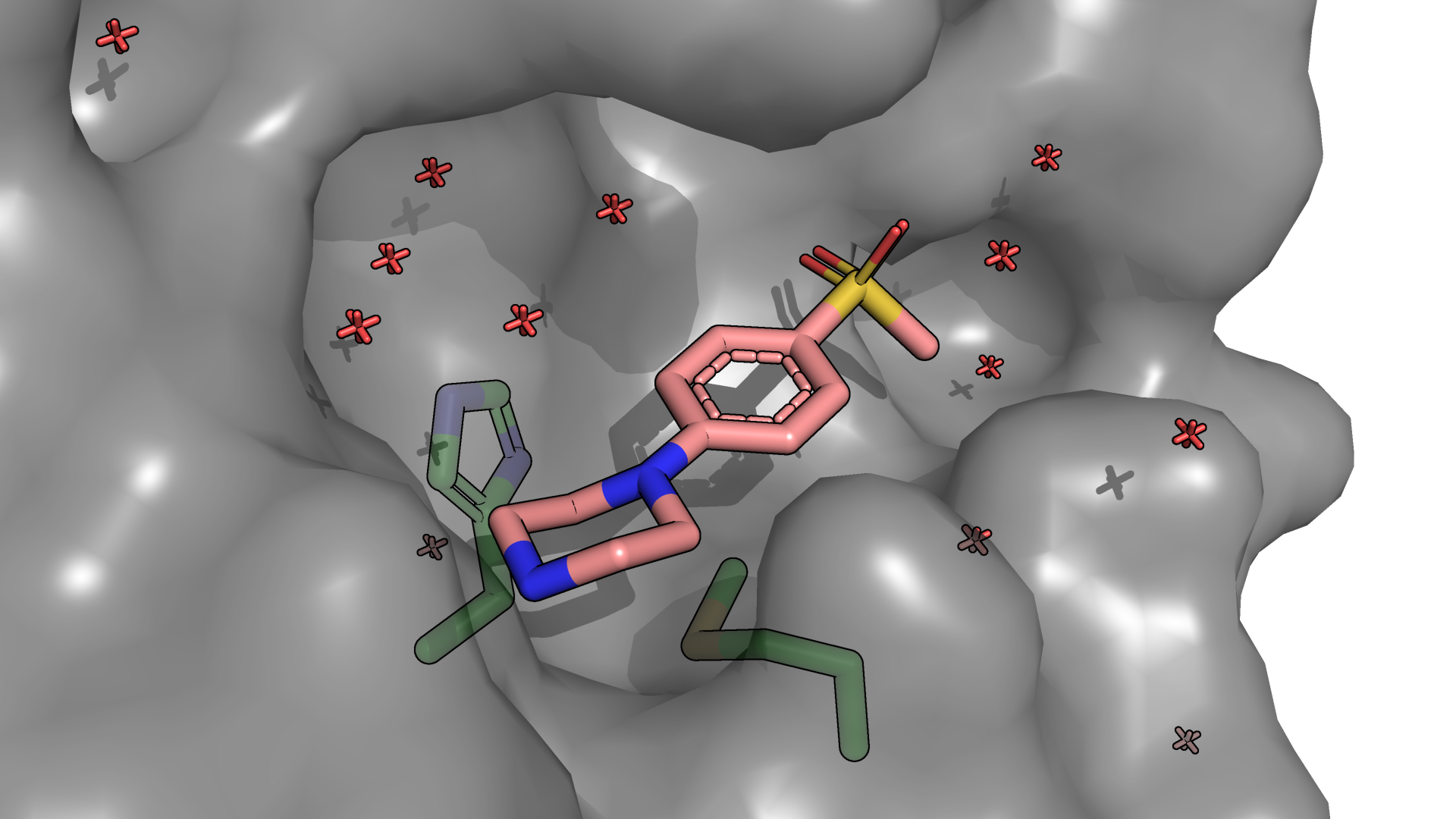
Рисунок 1.3. Отрендеренное изображение с surface участка протеазы SARS-CoV-2 с лигандом US7. Зеленые остатки определены PoseView как остатки, участвующие в гидрофобных взаимодействиях.
PDB IDs: 0003 и 0054.
В данном задании нужно было угадать, какой аминокислотный остаток вместо глицина
находился под номером 4 в цепи P в структуре 0003, а также под номером 9 в цепи R в структуре 0054.
Сначала рассмотрим окружение остатка в структуре 0003 (рис.2.1). Рис.2.1 немного загроможден, но я хотела показать, что
я обратила внимание на "ложбинку" в surface и довольно протяженный участок без связанной воды там же. Сначала мне показалось, что
там бы могла быть какая-нибудь ароматика, но ни один из вариантов не показался мне адекватным из-за высоких значений strain.
Тогда я подумала, что там могла бы быть какая-нибудь аминокислота с довольно удлиненным радикалом. Из рассмотренных вариантов оптимальным мне показался Glu (рис.2.2).
Как мне кажется, с учетом формы, значения strain (13.50), возможных водородных связей и представленности ротамера (16.2%) Glu неплохой кандидат на место 4 остатка в данной структуре и цепи.
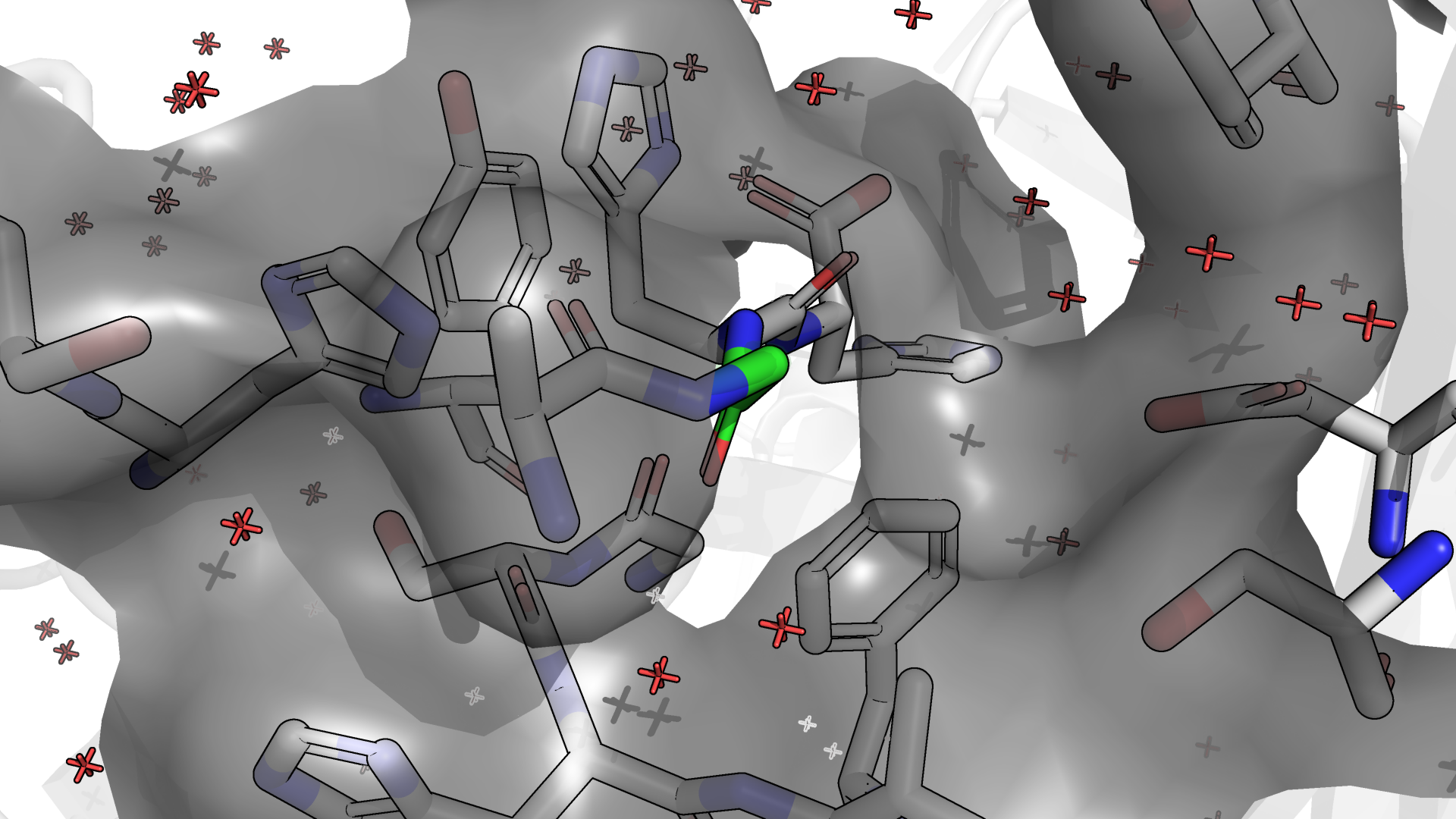
Рисунок 2.1. Изображение окружения 4-ого аминокислотного остатка (Gly) цепи P в структуре 0003 с surface. Зеленым отмечены углероды 4-ого остатка.
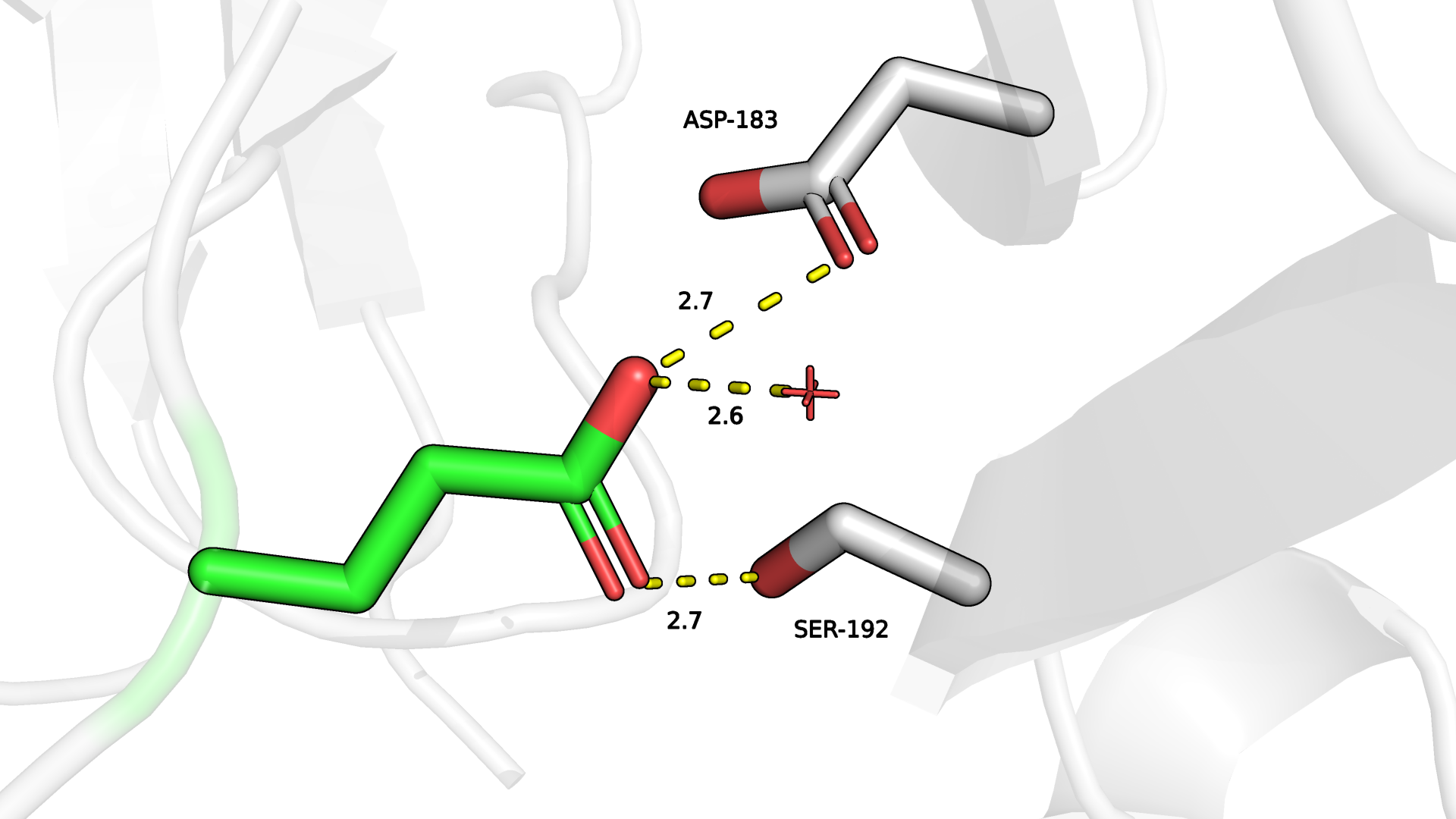
Рисунок 2.2. Изображение окружения 4-ого аминокислотного остатка (Glu) цепи P в структуре 0003 с surface. Зеленым отмечены углероды 4-ого остатка. Предположительные водородные связи с атомами радикала 4 а.о. отмечены желтым.
Далее рассмотрим остаток 9 в цепи R в структуре 0054. Из-за небольшого свободного пространства вокруг остатка 9 я подумала, что там должен быть остаток с каким-то совсем небольшим радикалом. В явном виде вокруг я не заметила обилие гидрофобных аминокислотных остатков, однако из-за малого количества связанной воды и направленности радикала 9 остатка пептидного антигена "вглубь" молекулы антитела я подумала, что, возможно, на позиции 9 может быть какая-нибудь аминокислота, проявляющая гидрофобные свойства. Из рассмотренных самым оптимальным кандидатом мне показался Thr (в лекции говорилось о его гидрофобных свойствах из-за торчащего метила), который имеет довольно низкое значение strain (9.42) и очень высокий процент представленности ротамера (аж 93.1%). Кроме того, как мне кажется, возможно, имеет место водородная связь с остовным кислородом Gly-101. Геометрия связи не является оптимальной, но из-за этого связь мне не кажется невозможной.
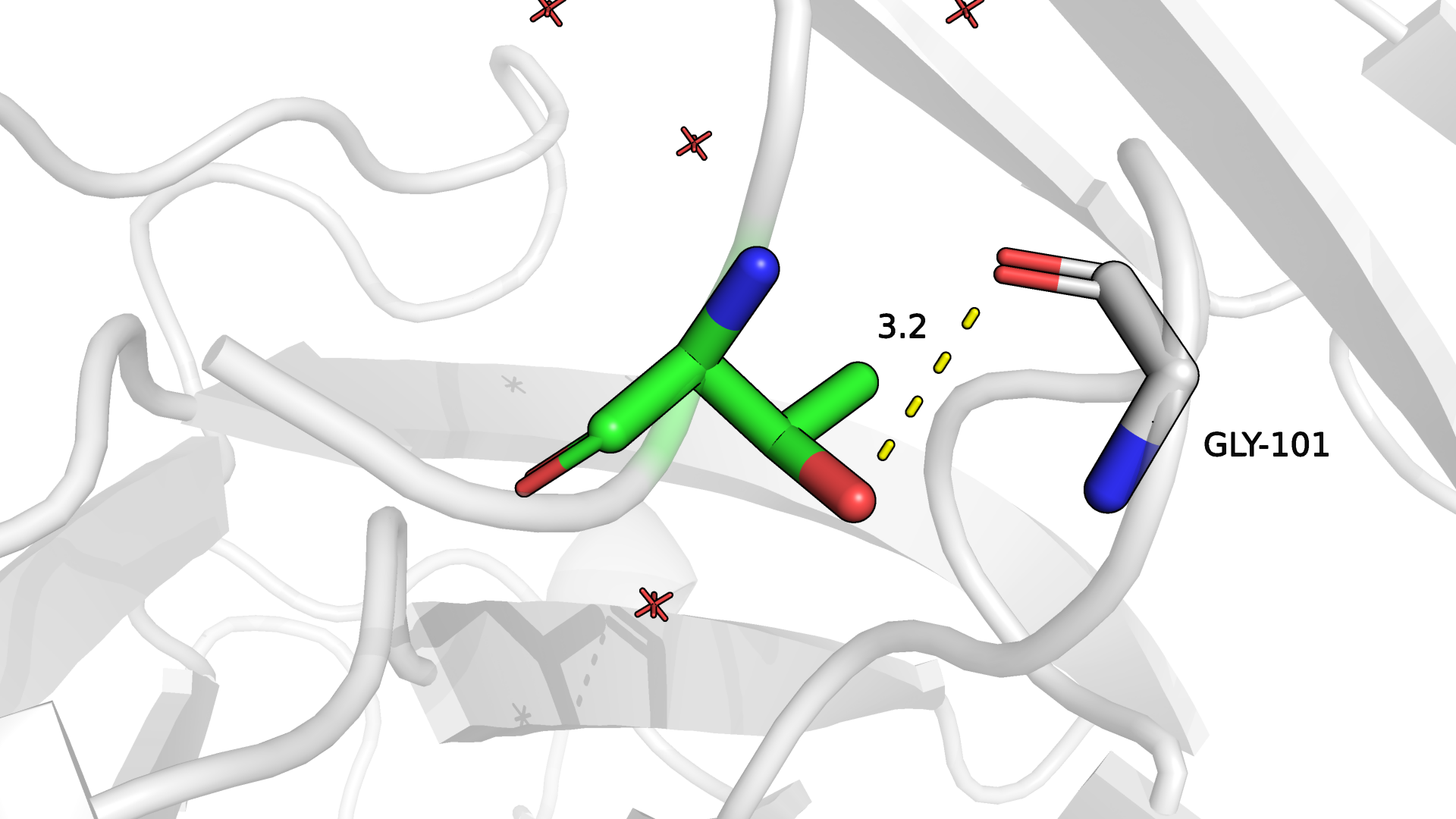
Рисунок 2.3. Изображение окружения 9-ого аминокислотного остатка (Thr) цепи R в структуре 0054. Зеленым отмечены углероды 9-ого остатка. Предположительная водородная связь с атомом радикала 9 а.о. отмечена желтым.
© Макиевская Кьяра, 2017-2020