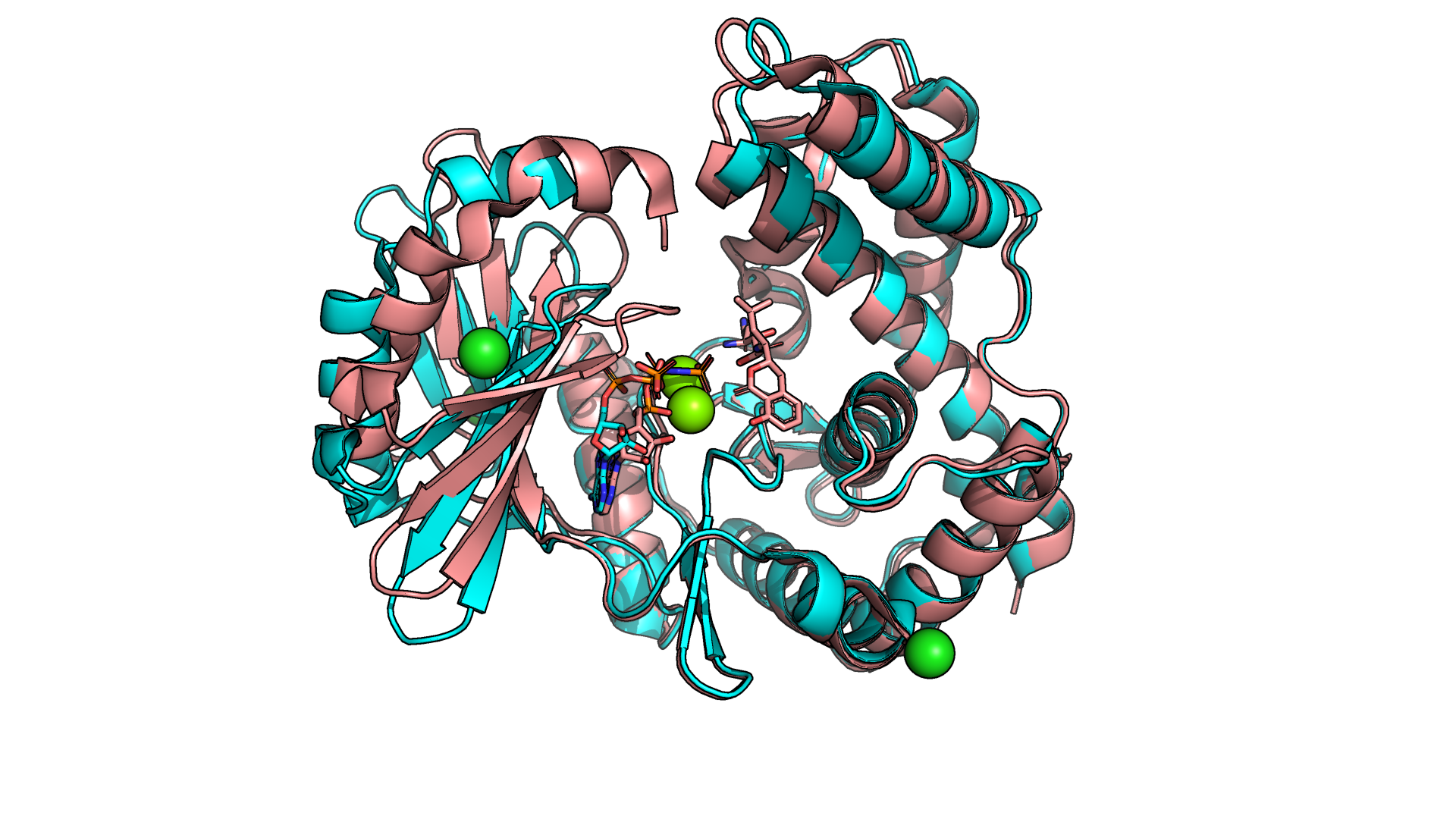
Рисунок 1.1. Наложение друг на друга двух структур белка. Открытой форме белка соответствует 6SV5 (голубая структура), закрытой - 6SUL (розовая структура).
PDB IDs: 6SUL и 6SV5.
В данном задании даны 2 PDB ID, один из которых соответствует открытой форме белка (6SV5, голубая структура на рис.1.1), второй - закрытой (6SUL, розовая структура на рис.1.1).
Необходимо определить визуальные отличия между данными структурами, а также
для обеих форм вычислить площадь молекулярной поверхности (MS) и площадь поверхности, доступной растворителю (SAS), и сравнить
между собой эти 4 числа (Табл.1.1).

Рисунок 1.1. Наложение друг на друга двух структур белка. Открытой форме белка соответствует 6SV5 (голубая структура), закрытой - 6SUL (розовая структура).
В целом обе структуры неплохо накладываются друг на друга (рис.1.1), однако сразу бросается в глаза, что некоторые элементы плохо наложились
и довольно сильно смещены друг относительно друга. Особенно это заметно на некоторых петлях и альфа-спиралях на переферии белка.
Пример плохого наложения структур можно наблюдать на рис.1.2. Кроме смещения участков друг относительно друга, можно заметить, что они в принципе в обеих структурах различаются:
у 6SUL весь участок, показанный на рис.1.2, представлен альфа-спиралью, в то время как у 6SV5 небольшой фрагмент представлен петлей.
Также я обратила внимание на разный состав лигандов для обеих структур - для 6SV5 представлен только ATP, а для 6SUL - ANP, UAM, Cl- и Mg2+. В статье
отмечено, что, например, ионы Mg2+ необходимы для стабилизации закрытой формы белка.
Стоит также отметить, что 6SUL больше на несколько аминокислотных остатков.
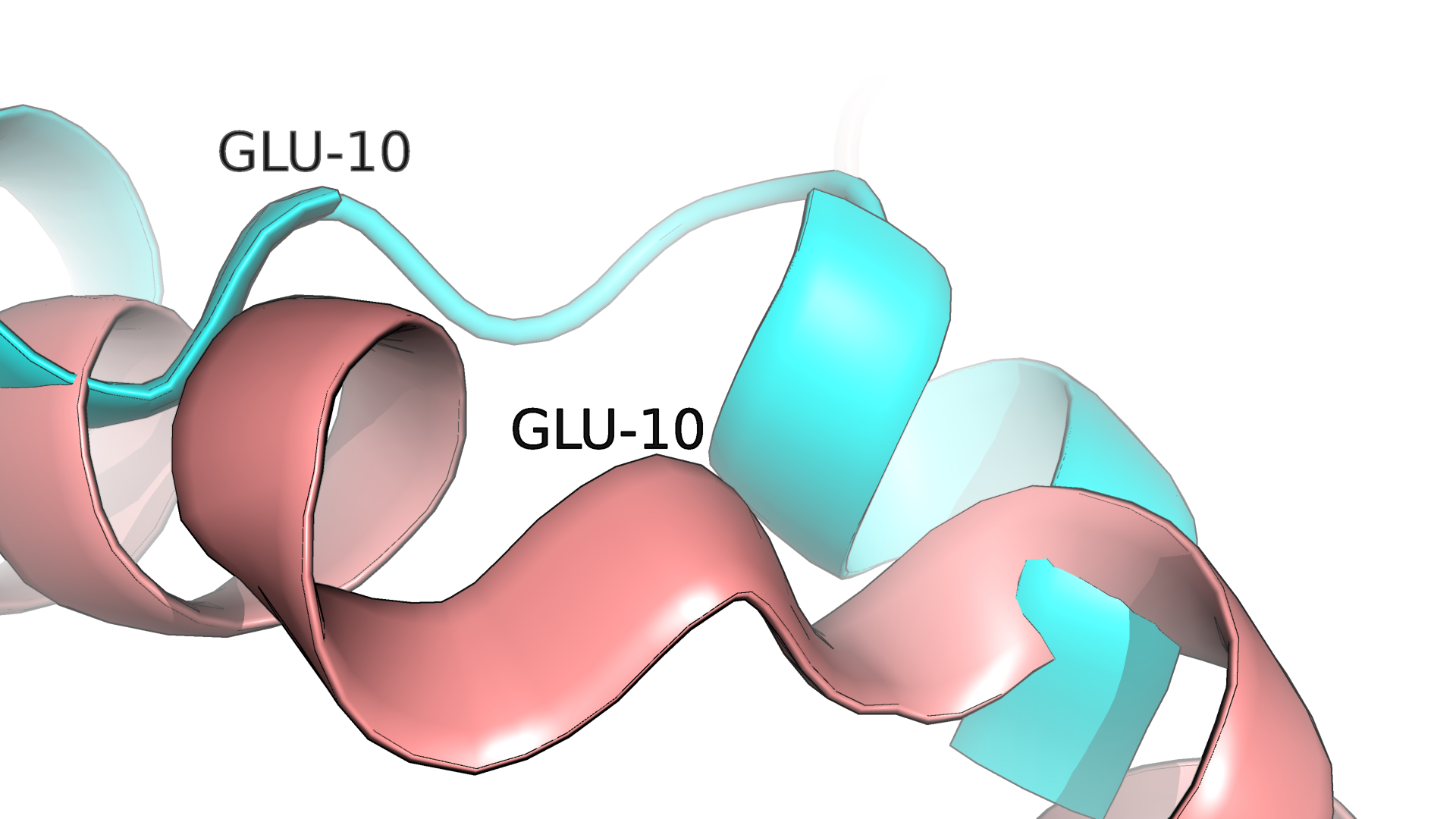
Рисунок 1.2. Фрагмент плохого наложение друг на друга двух структур белка. Открытой форме белка соответствует 6SV5 (голубая структура), закрытой - 6SUL (розовая структура).
Далее для обеих форм белка я вычислила площадь молекулярной поверхности (MS) и площадь поверхности, доступной растворителю (SAS) (Табл.1.1).
При расчете площадей растворитель и лиганды не учитывались, то есть площади подсчитывались только для белка.
Значения площадей MS для обеих структур оказались в 2 и более раз выше, чем значения площадей SAS, что может быть обусловлено
техническими деталями вычислений. Дело в том, что в SAS площадь рассчитывается с учетом радиусов молекул растворителя, находящихся в
наибольшей близости к белку, а в MS - как сумма поверхности контакта и дополнительной поверхности. Таким образом, в случае SAS
происходит "раздутие" молекулы, приводящее к тому, что некоторые полости, которые могли бы внести вклад в площадь поверхности,
просто перекрываются "раздутием" и не учитываются. В MS же, напротив, все это лучше учитывается, поэтому, видимо, значения больше.
Также стоит обратить внимание на то, что для закрытой формы в рассматриваемом случае вышло так, что
значение площади MS больше, чем для открытой, а значение площади SAS, напротив, меньше. Возможно, это может быть связано с экспонированностью/погруженностью
некоторых аминокислотных остатков наружу/внутрь при смене формы белка.
Таблица 1.1. Значения в ангстремах^2 площади молекулярной поверхности (MS) и поверхности, доступной растворителю (SAS), для 6SUL и 6SV5.
| Структура | Форма | MS | SAS |
|---|---|---|---|
| 6SUL | Закрытая | 35673.383 | 14672.305 |
| 6SV5 | Открытая | 34869.750 | 16336.406 |
PDB IDs: 6SUL и 6SV5.
Прежде всего необходимо было визуально определить положение основного кармана связывания. При включении surface и сравнении структур
с открытой и закрытой формой основной карман связывания хорошо заметен (рис.2.1).
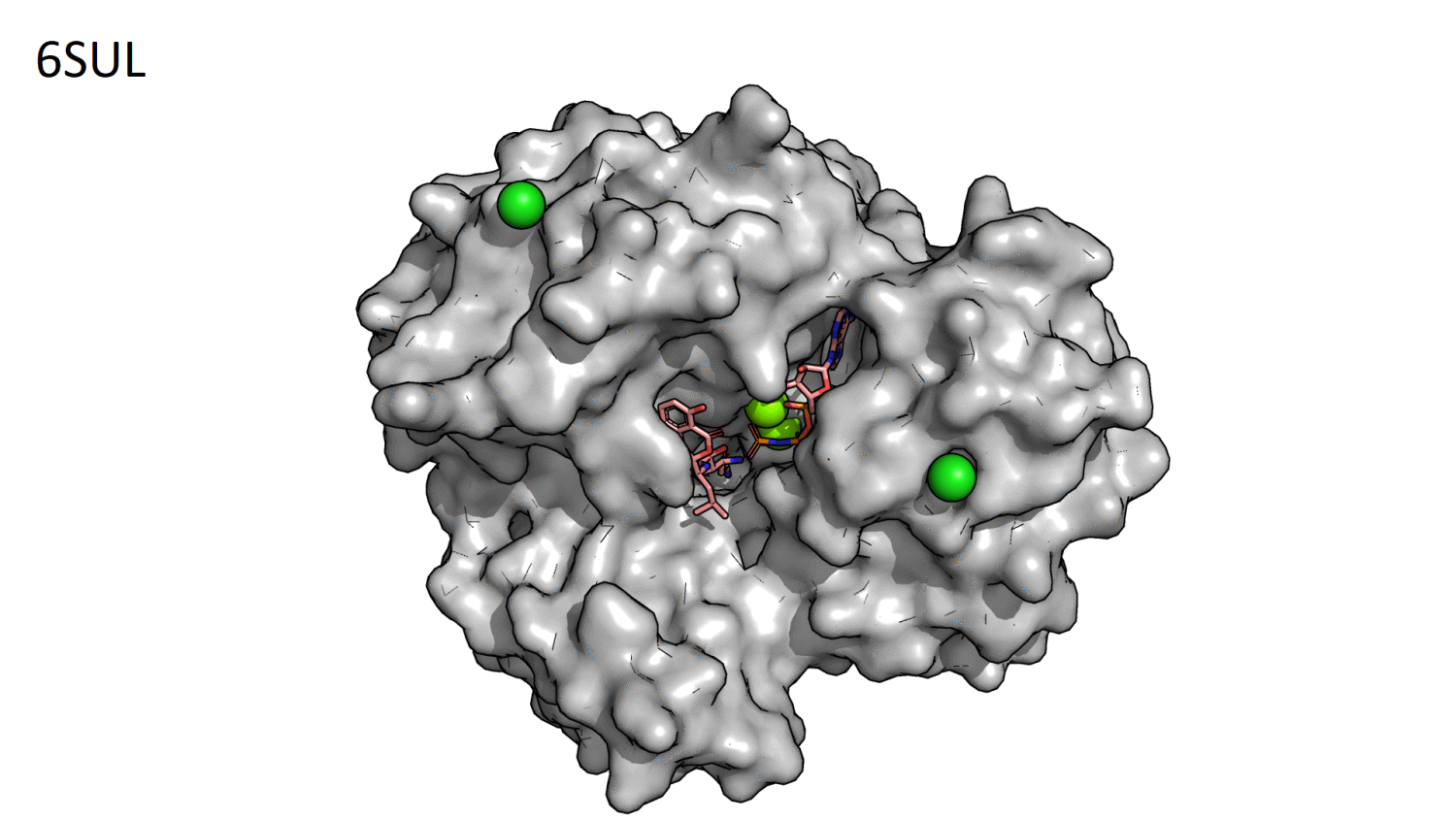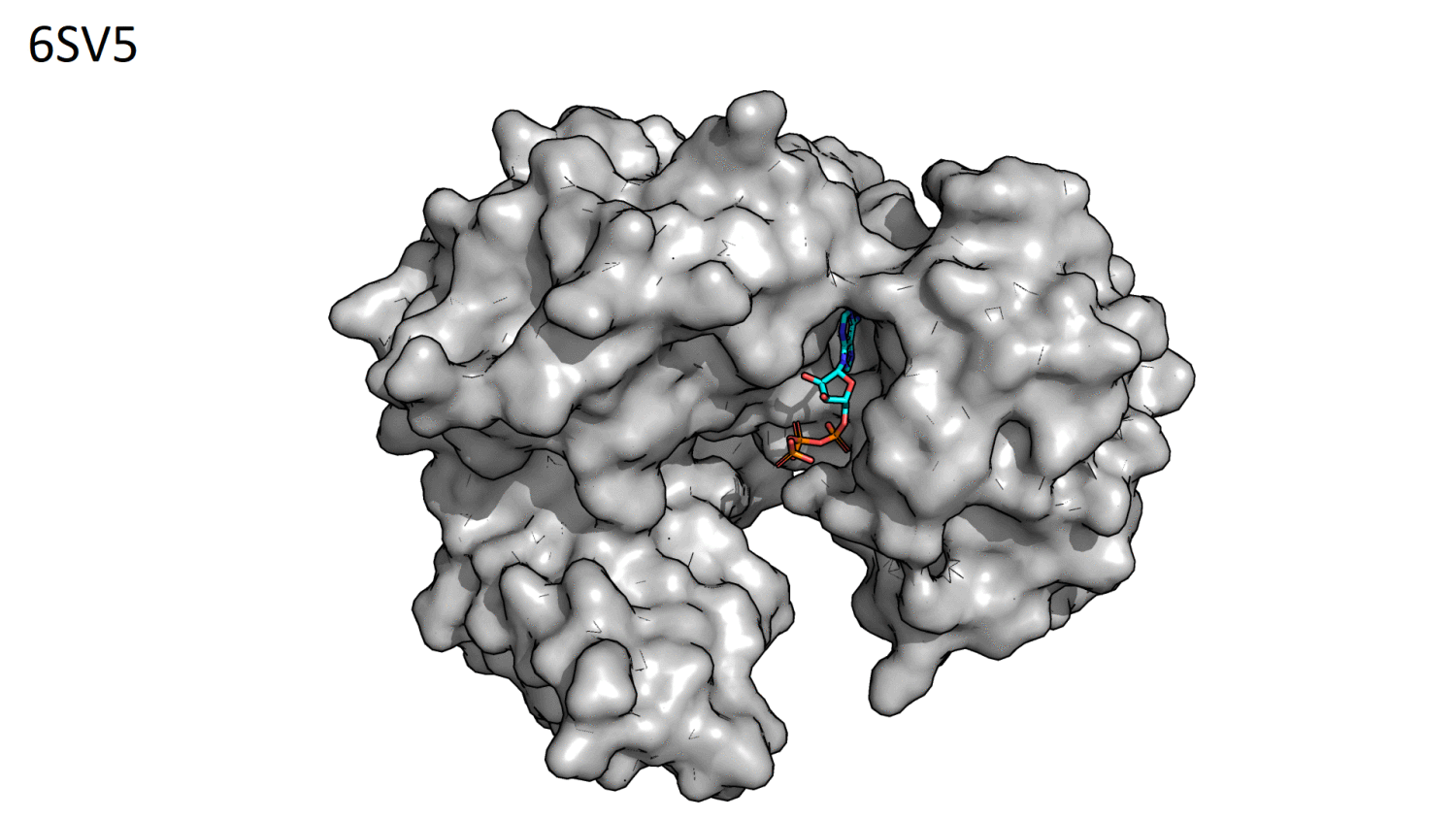
Рисунок 2.1. GIF-анимация сравнения структур 6SV5 (открытая форма) и 6SUL (закрытая форма) для визуального определения положения основного кармана связывания.
Стоит отметить, что в биологических сборках 6SUL - гомодимер, а 6SV5 - мономер, поэтому в случае 6SUL я работала с его chain A и в
web-сервис fpoсket подавала тоже именно мономеры, так как визуально я определила, что основной карман связывания находится не между
двумя мономерами, а внутри каждого из них.
Для 6SV5 fpocket предложила 24 кармана, а для 6SUL - 29. В обоих случаях наиболее визуально подходящими мне показались карманы под номером 1 (рис.2.2-2.3).
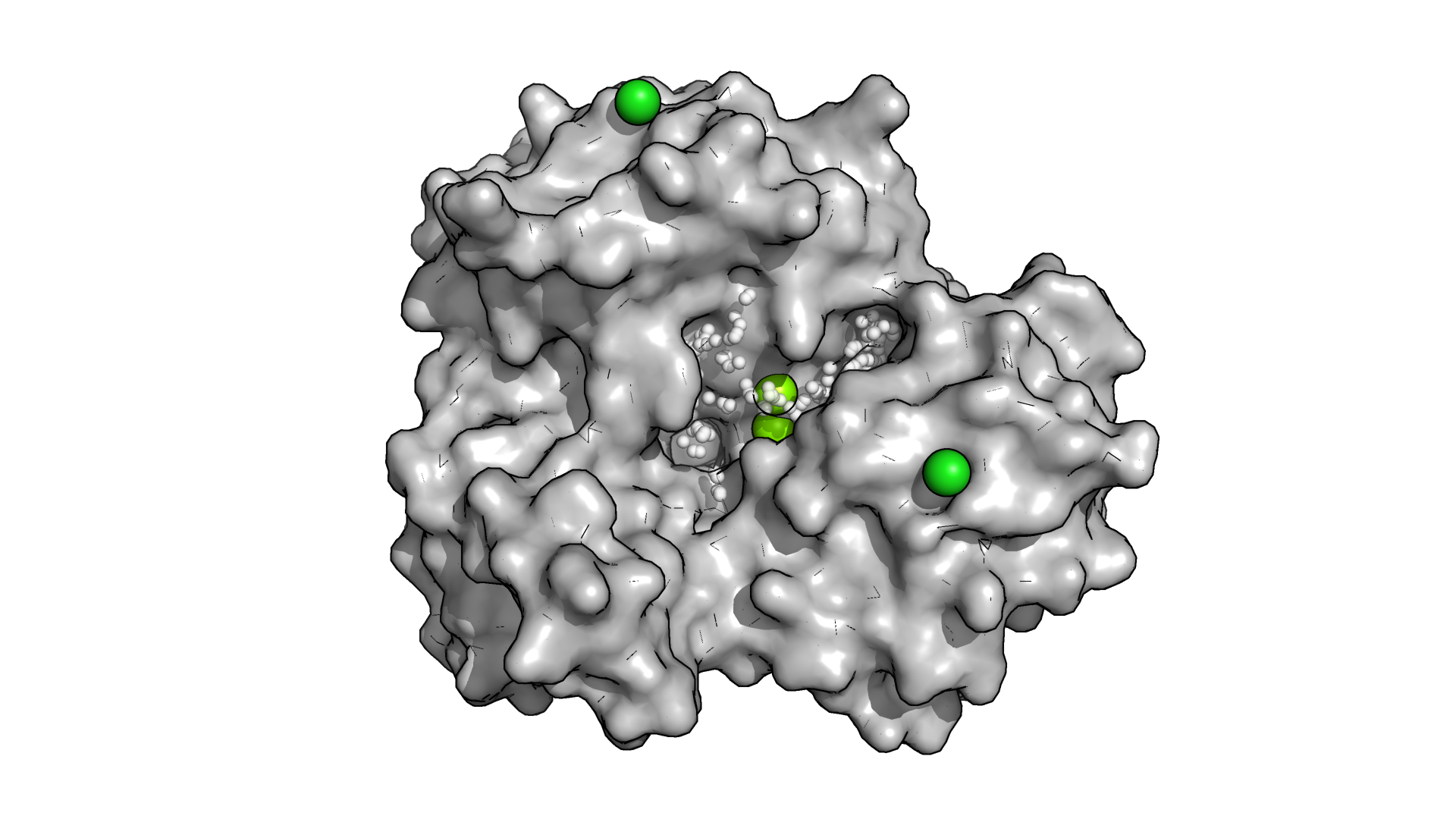
Рисунок 2.2. Карман №1 в структуре 6SUL.
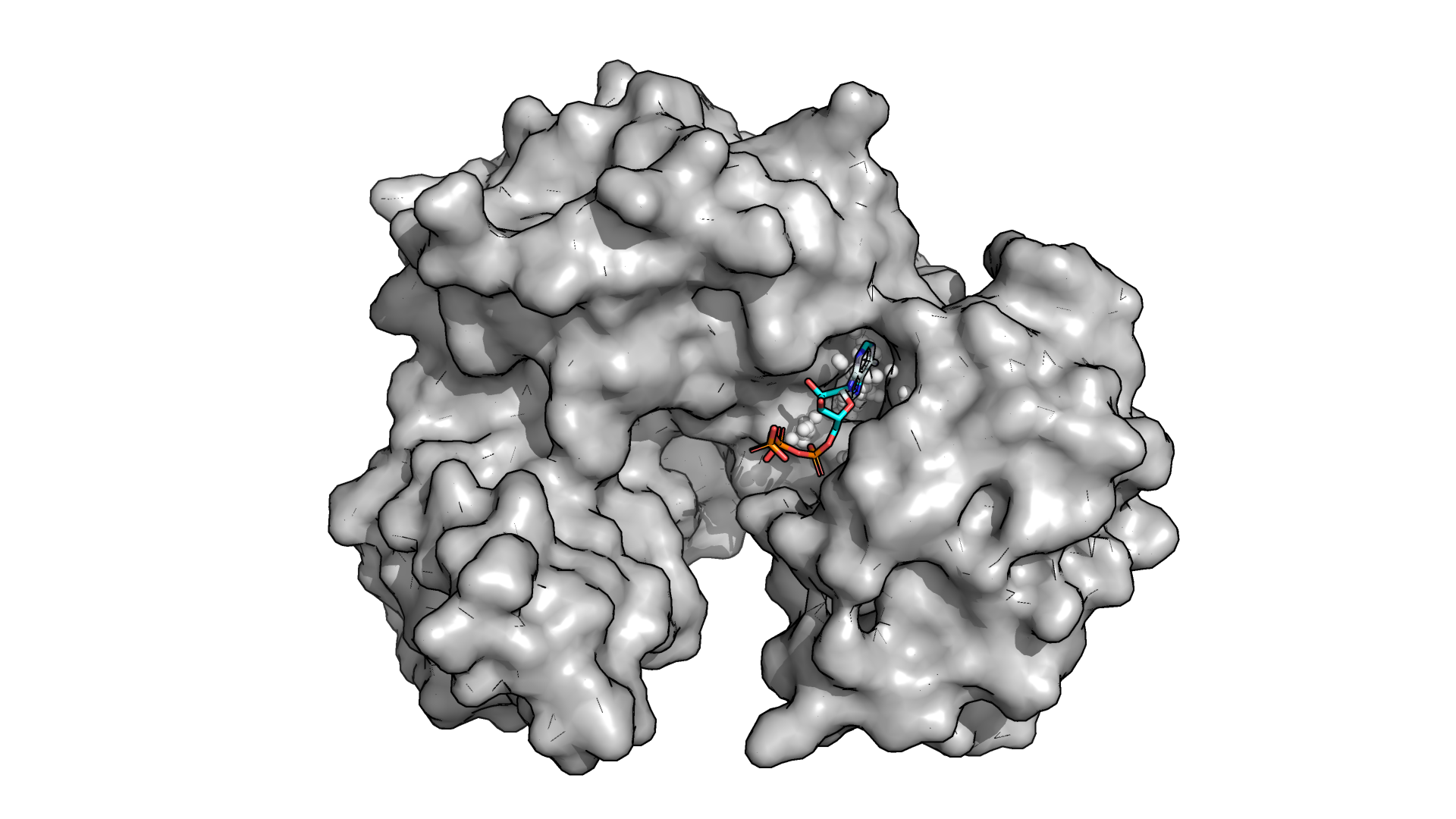
Рисунок 2.3. Карман №1 в структуре 6SV5.
Объем кармана в структуре с закрытой формой оказался заметно больше, чем в структуре с открытой формой (табл. 2.1). Даже без знания точных объемов на это можно было обратить внимание, визуально рассмотрев карманы. Например, сразу бросается в глаза то, что в закрытой форме у белка рядом с карманом есть фрагмент, напоминающий "дверцу", которая, по-видимому, в открытой форме открывается из-за экспонирования ряда аминокислотных остатков. В связи с таким "открытием дверцы" часть белка, которая образовывала углубление для кармана в закрытой форме, "выпячивается" наружу, переставая образовывать углубление (рис. 2.4).
Таблица 2.1. Значения в ангстремах^3 объема кармана №1 для 6SUL и 6SV5.
| Структура | Форма | № кармана | Объем |
|---|---|---|---|
| 6SUL | Закрытая | 1 | 3509.6541 |
| 6SV5 | Открытая | 1 | 2389.6882 |
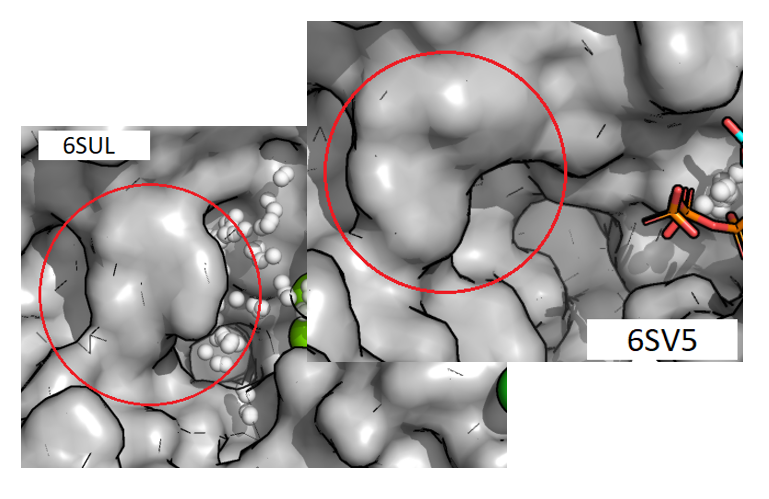
Рисунок 2.4. Сравнение фрагмента белка около предположительно основного кармана связывания в структурах 6SV5 и 6SUL.
PDB IDs: 6SUL и 6SV5.
В данном задании необходимо было сначала вычислить экспонированность аминокислотных остатков с помощью DSSP,
а потом сопоставить экспонированность остатка с его номером для обеих структур (исключая остатки, которых нет хотя бы в одной из структур),
после чего определить, какой остаток больше всего изменил свою экспонированность при "закрытии" белка.
После проведения всех вышеописанных манипуляций я сравнила экспонированность остатков из обеих структур друг с другом. Оказалось, что
самая большая разница экспонированности по модулю у GLU-159. У открытой формы белка значение экспонированности - 137, а у закрытой - 22, таким
образом, при "закрытии" белка экспонированность этого остатка снизилась на 115.
В структуре 6SUL (закрытая форма, рис.3.1) аминокислотный остаток GLU-159 смотрит внутрь белка, а петля, на которой он находится,
почти вплотную упирается в другую петлю. В целом низкая экспонированность этого остатка кажется логичной и интуитивно понятной.
В структуре 6SV5 (открытая форма, рис.3.2) аминокислотный остаток GLU-159 вроде как тоже смотрит внутрь белка, но никуда
сильно не упирается, а петля, на которой он находится, не прижимается в плотную к белковой глобуле, как в случае закрытой формы, и
находится на некотором удалении, более торчит наружу.
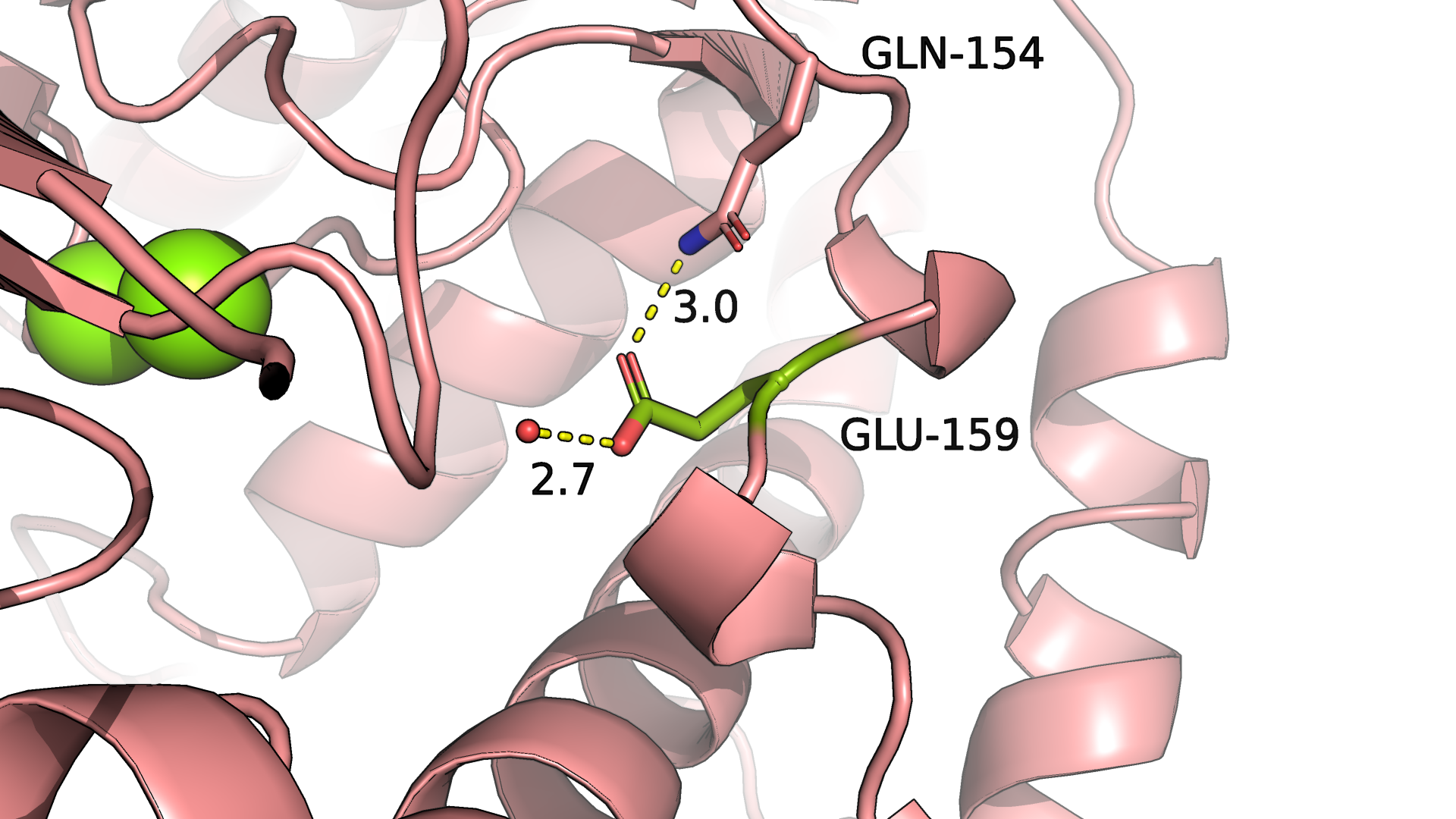
Рисунок 3.1. Аминокислотный остаток GLU-159 в 6SUL.
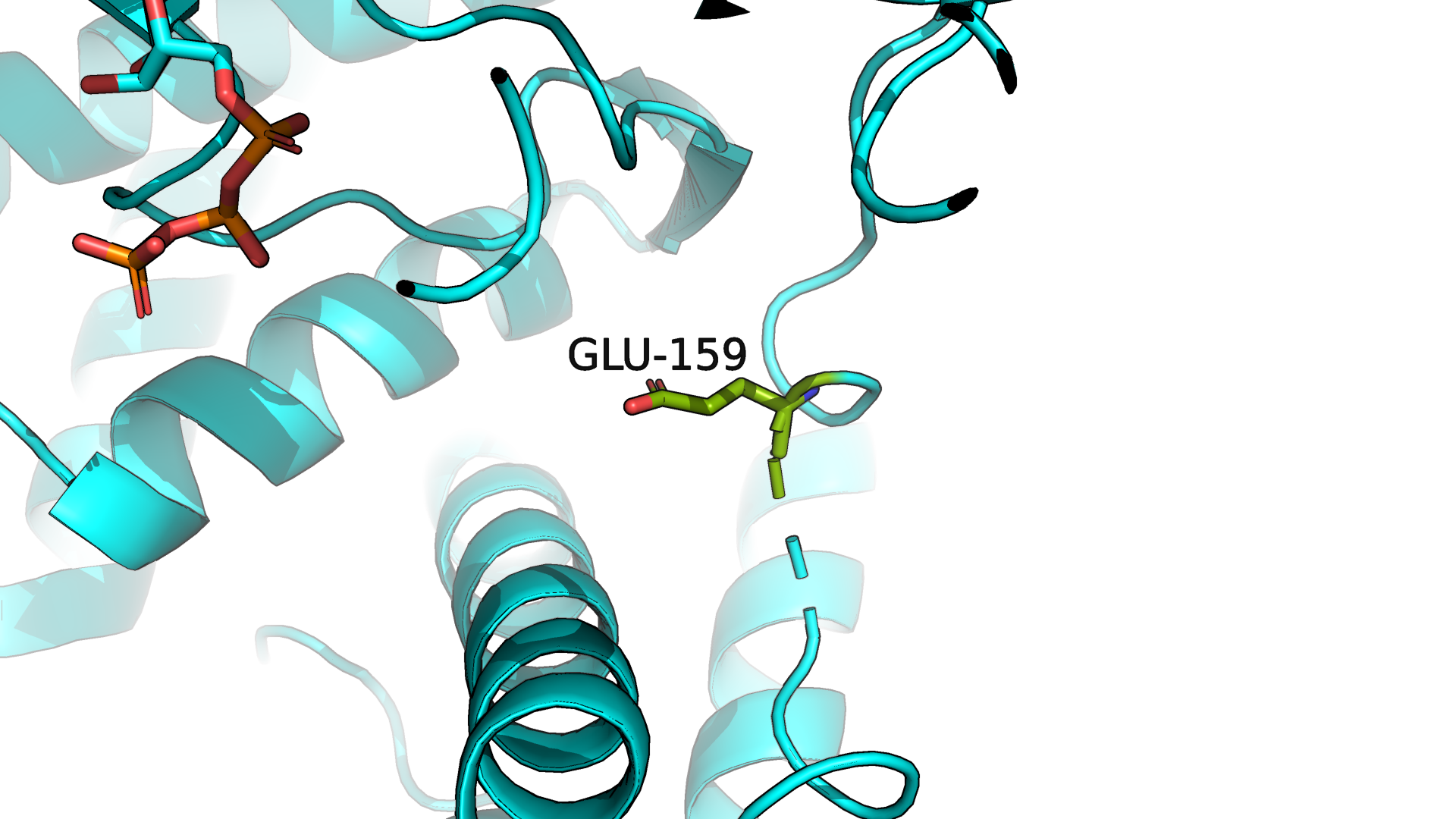
Рисунок 3.2. Аминокислотный остаток GLU-159 в 6SV5.
© Макиевская Кьяра, 2017-2020