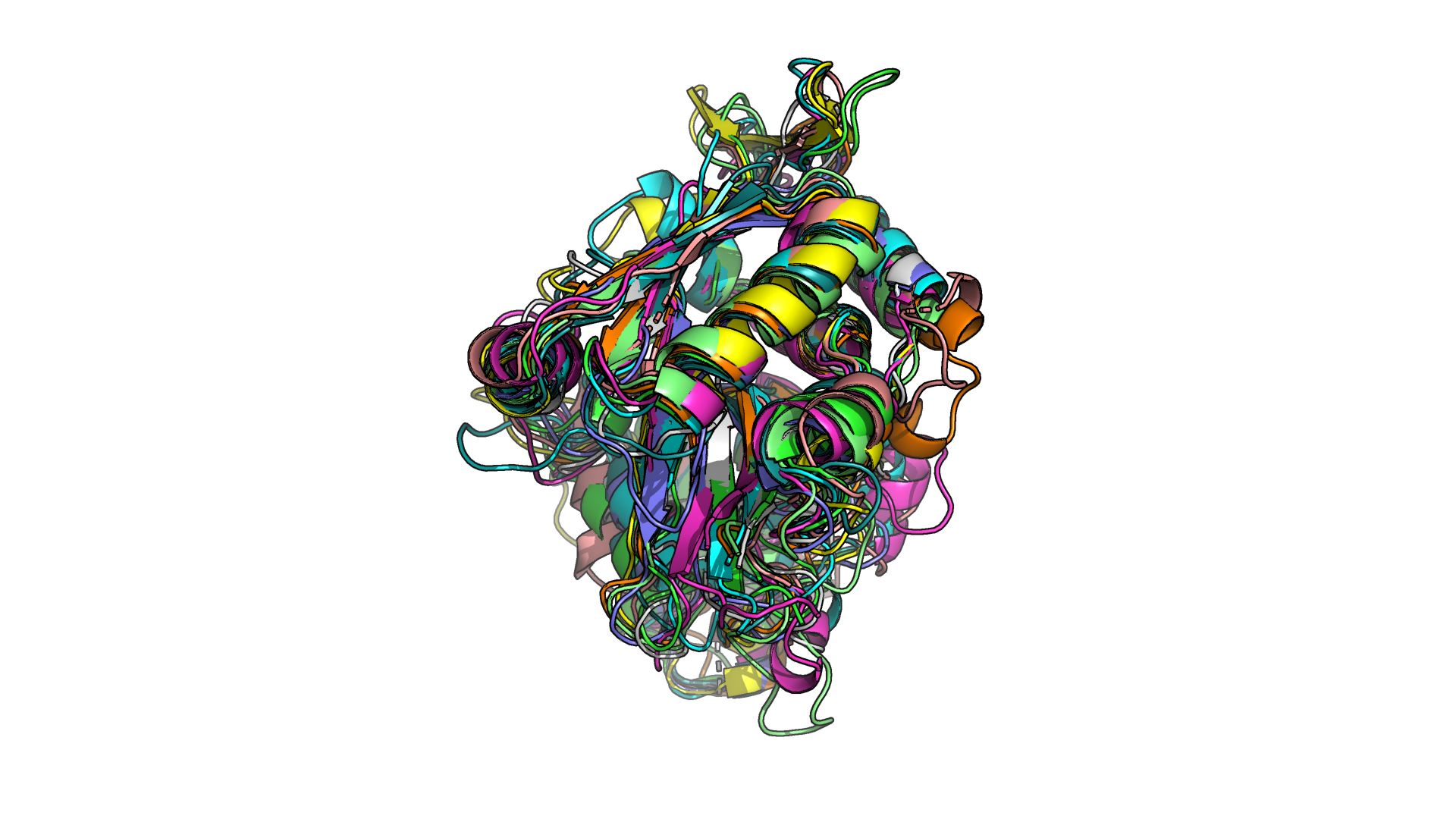
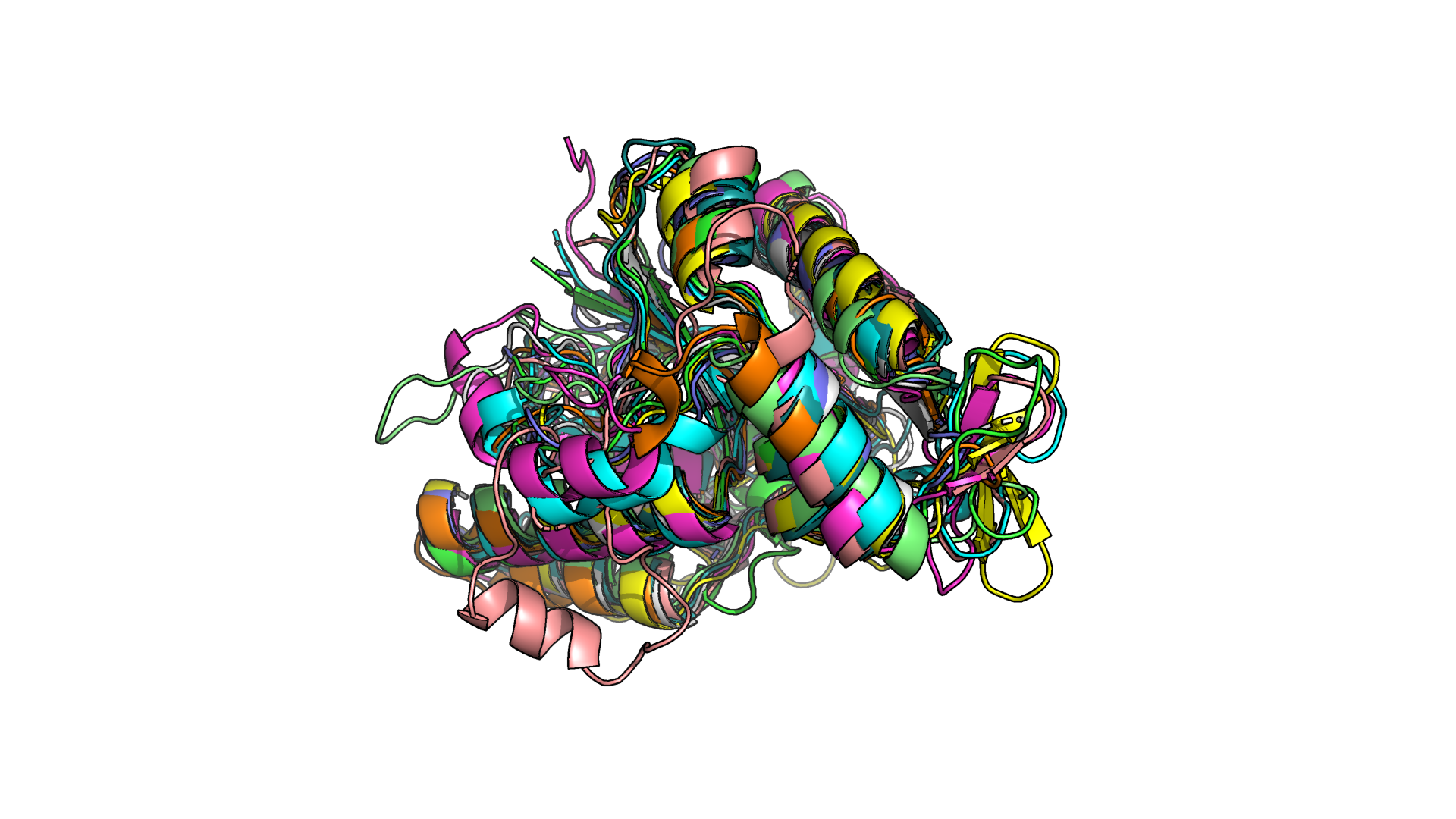
Рисунки 1.1 и 1.2. Наложение друг на друга 10 структур белка. Соответствующие этим структурам последовательности демонстрируют не более 40% попарного сходства.
В данном задании дано 10 записей PDB. Соответствующие этим структурам последовательности демонстрируют не более 40% попарного сходства. Необходимо было выровнять структуры по одной опорной из них и сравнить их, определив, имеют ли эти структуры одинаковую третичную структуру/укладку, что между ними общего, в чем они различаются (рис.1.1-1.2).


Рисунки 1.1 и 1.2. Наложение друг на друга 10 структур белка. Соответствующие этим структурам последовательности демонстрируют не более 40% попарного сходства.
В целом структуры неплохо накладываются друг на друга (рис.1.1-1.2), так как размеры и расположение элементов вторичной структуры более-менее похожи, то есть, по-видимому, имеет место схожая третичная структура. Различия особенно сильно наблюдаются в петлях - проявляется это как в их различном расположении друг относительно друга для разных структур, так и в том, что для некоторых структур на длинной петле может быть размечен небольшой участок альфа-спирали. Пример подобного можно наблюдать на рис.1.2, где светло-розовая петля снизу не выровнялась ни с одной структурой, а также ее фрагмент размечен как альфа-спираль.
В данном задании необходимо было для любой PDB пары из 10 предоставленных структур изучить разметку вторичной структуры,
которую PyMol сделал по умолчанию (внутри он использовал dssp),
найти участок, в котором участок одного белка, проходя через то же место в пространстве,
что и аналогичный участок второго белка, имеет отличную от него разметку вторичной структуры и
объяснить, оправдано ли это различие.
Я решила выбрать структуры 2d5wA03 (желтая) и 3tpaA03 (фиолетовая) и рассмотреть фрагмент, отображенный на рис.2.1., так как
на данном участке для структуры 2d5wA03 мы можем наблюдать небольшую альфа-спираль, а для 3tpaA03 - лишь петлю.
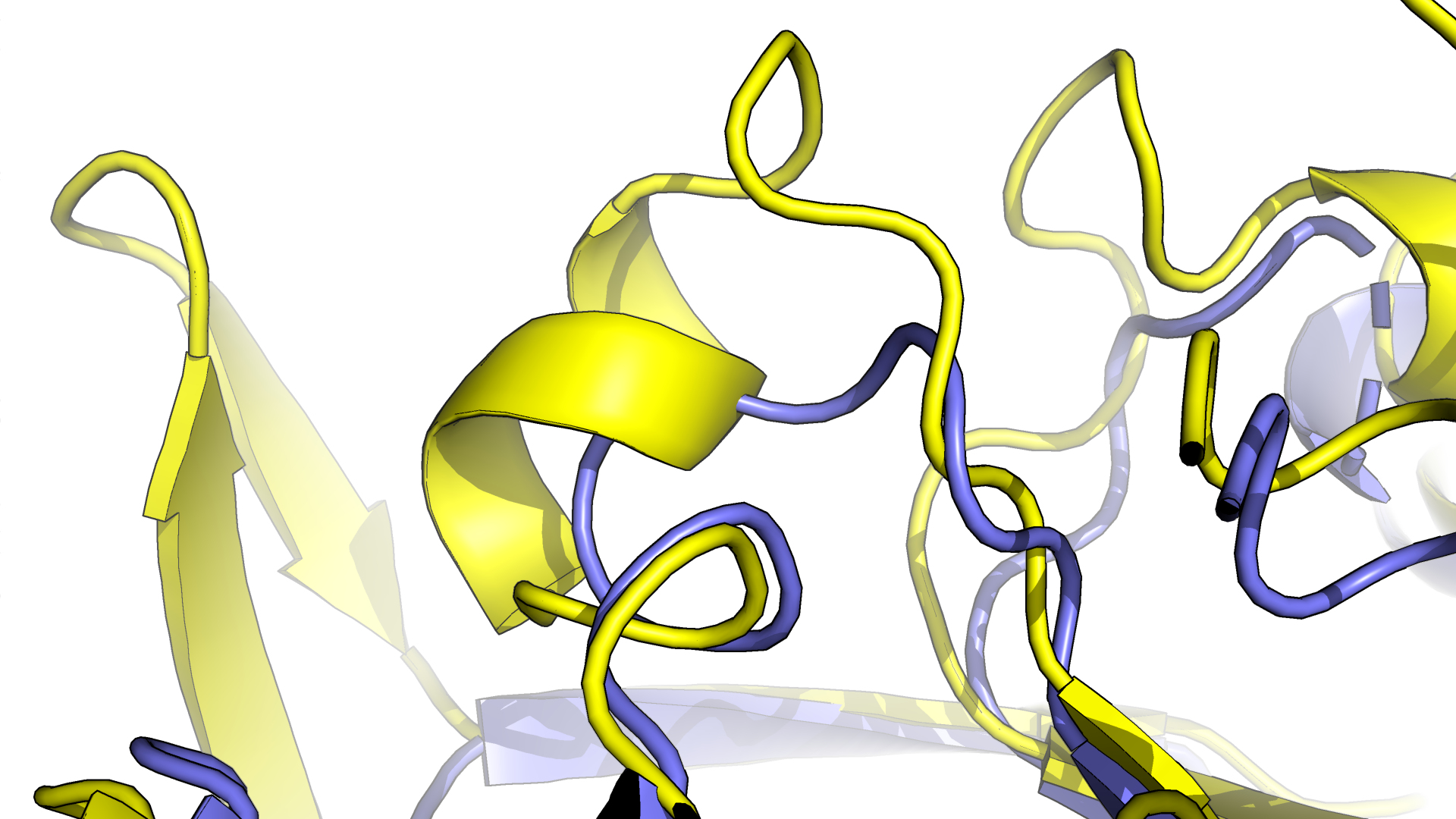
Рисунок 2.1. Наложение друг на друга структур 2d5wA03 (желтая) и 3tpaA03 (фиолетовая).
Сначала посмотрим на выбранный фрагмент структуры 2d5wA03 (желтая) поближе (рис. 2.2-2.3). Визуально и благодаря проведенным измерениям кажется,
что наличие на этом участке небольшой альфа-спирали вполне оправдано.
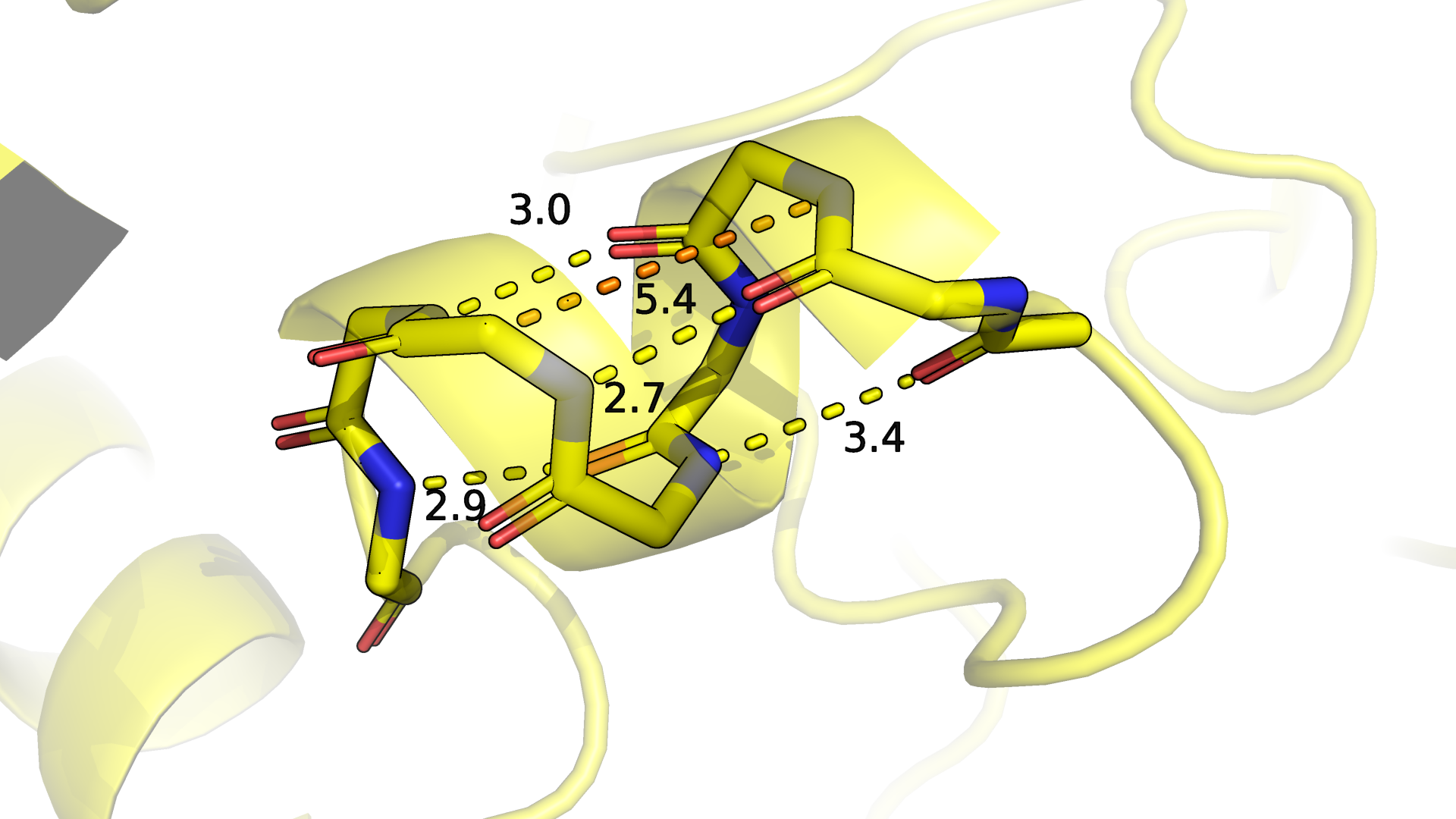
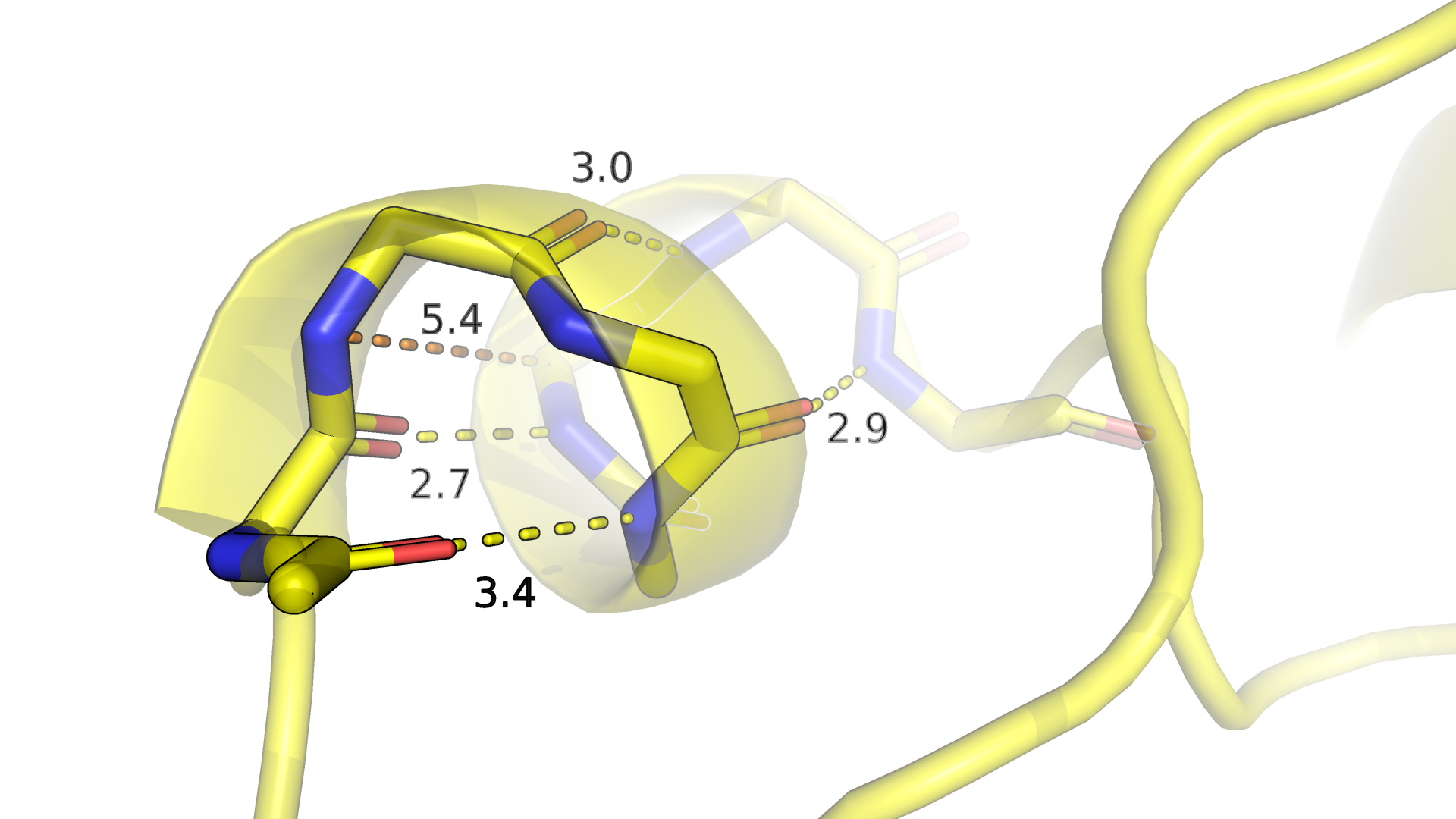
Рисунки 2.2 и 2.3. Фрагмент структуры 2d5wA03. Для удобства отображения скрыты атомы радикалов. Желтым цветом обозначены водородные связи между атомами остова, оранжевым - примерный шаг спирали.
Далее рассмотрим поближе выбранный фрагмент структуры 3tpaA03 (фиолетовая, рис.2.4). В этом случае очевидно, что на указанном участке
альфа-спираль никак не получится, а вот петля - да. Таким образом, мне кажется, что различие в разметке вторичных структур
для этих двух PDB структур оправдано.
Рисунок 2.4. Фрагмент структуры 3tpaA03 (фиолетовая).
В данном задании необходимо было сгенерировать разметку вторичной структуры всех 10-ти PDB структур. Далее по полученным данным надо было рассчитать склонности каждого типа аминокислотного остатка образовывать тот или иной тип вторичной структуры. Результаты приведены в табл.3.1.
Таблица 3.1. Аминокислотные остатки и их склонности образовывать бета-листы ("E"), альфа-спирали ("H") и петли ("C").
| C | E | H | all | P_C | P_E | P_H | |
|---|---|---|---|---|---|---|---|
| A | 79 | 20 | 106 | 205 | 0,769 | 0,739 | 1,410 |
| C | 6 | 0 | 1 | 7 | 1,711 | 0,000 | 0,389 |
| D | 98 | 6 | 51 | 155 | 1,262 | 0,293 | 0,897 |
| E | 46 | 17 | 71 | 134 | 0,685 | 0,960 | 1,445 |
| F | 58 | 16 | 38 | 112 | 1,033 | 1,081 | 0,925 |
| G | 124 | 10 | 13 | 147 | 1,683 | 0,515 | 0,241 |
| H | 15 | 5 | 15 | 35 | 0,855 | 1,081 | 1,168 |
| I | 51 | 33 | 53 | 137 | 0,743 | 1,823 | 1,055 |
| K | 65 | 18 | 87 | 170 | 0,763 | 0,802 | 1,395 |
| L | 66 | 29 | 94 | 189 | 0,697 | 1,162 | 1,356 |
| M | 15 | 8 | 18 | 41 | 0,730 | 1,477 | 1,197 |
| N | 99 | 8 | 35 | 142 | 1,391 | 0,426 | 0,672 |
| P | 85 | 12 | 9 | 106 | 1,600 | 0,857 | 0,231 |
| Q | 37 | 8 | 55 | 100 | 0,738 | 0,606 | 1,499 |
| R | 31 | 11 | 52 | 94 | 0,658 | 0,886 | 1,508 |
| S | 74 | 12 | 32 | 118 | 1,251 | 0,770 | 0,739 |
| T | 65 | 25 | 22 | 112 | 1,158 | 1,690 | 0,536 |
| W | 20 | 6 | 13 | 39 | 1,023 | 1,165 | 0,909 |
| Y | 54 | 25 | 25 | 104 | 1,036 | 1,820 | 0,655 |
| V | 50 | 31 | 43 | 124 | 0,805 | 1,893 | 0,945 |
Далее необходимо было проанализировать таблицу и ответь на ряд вопросов:
Какой тип остатка заметно чаще образует альфа-спирали, чем бета-листы и петли?
Здесь я бы отметила аланин, а также можно отметить глутамин и аргинин.
Какой тип остатка заметно чаще образует бета-листы, чем альфа-спирали и петли?
В этом случае я отметила бы изолейцин, тирозин и валин. Тирозин в этом списке показался мне странным, как мне кажется,
он может дестабилизировать структуру бета-листа.
Какой тип остатка заметно чаще образует петли, чем альфа-спирали и бета-листы?
В первую очередь здесь стоит отметить такие аминокислотные остатки как цистеин и глицин, они заметно чаще образуют петли.
© Макиевская Кьяра, 2017-2020