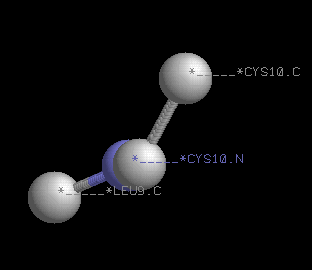
| Название двугранного угла
|
Угол определяется по координатам атомов
|
Данный угол описывает поворот вокруг связи
|
Результат измерения с помощью RasMol
|
| φ
|
- Leu9:A.C(карбонильный углерод 9-ого остатка цепи A)
- Cys10:A.N(азот аминогруппы 10-ого остатка цепи A)
- Cys10:A.Cα(Cα-атом 10-ого остатка цепи A)
- Cys10:A.C(карбонильный углерод 10-ого остатка цепи A)
|
N-Cα
|
-141'71"
|
| ψ
|
- Cys10:A.N(азот аминогруппы 10-ого остатка цепи A)
- Cys10:A.Cα(Cα-атом 10-ого остатка цепи A)
- Cys10:A.C(карбонильный углерод 10-ого остатка цепи A)
- Thr11:A.N(азот аминогруппы 11-ого остатка цепи A)
|
Cα-C
|
177'78"
|
| ω
|
- Cys10:A.Cα(Cα-атом 10-ого остатка цепи A)
- Cys10:A.C(карбонильный углерод 10-ого остатка цепи A)
- Thr11:A.N(азот аминогруппы 11-ого остатка цепи A)
- Thr11:A.Cα(Cα-атом 11-ого остатка цепи A)
|
C-N
|
-179'78"
|
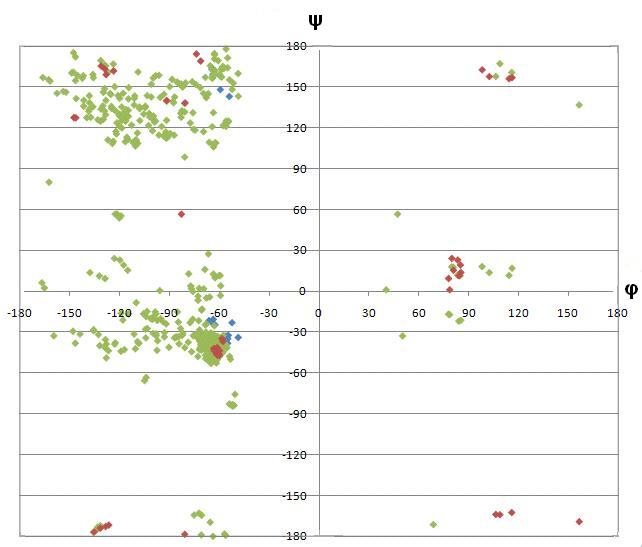
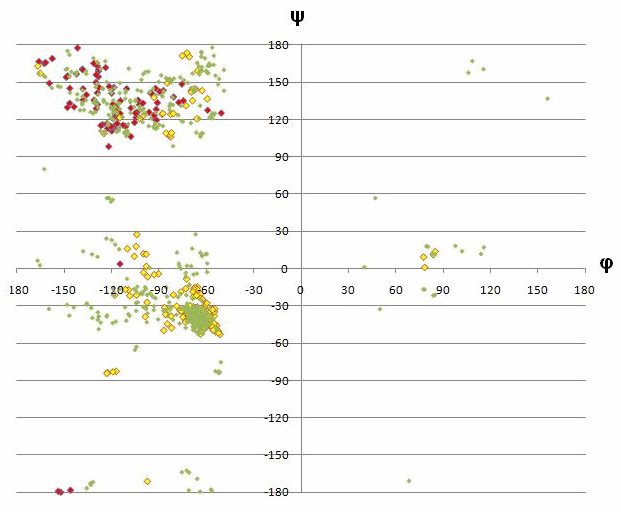
Разнообразие значений углов для пролина очень мало из-за особенностей строения молекулы - в иминокислоте нет атомов, вокруг которых может происходить сильное вращение. Глицин же разбросан практически по всей карте, так как его боковая группа очень просто устроена и может крутиться во все стороны.
© Свистунова Даша