Вторичная структура
В полипептидной цепи A данного белка 5 α-спиралей, 6 β-тяжа; в B - 4 α-спирали и 4 β-тяжа; в С - 4 α-спирали и 4 β-тяжа; в D - 6 α-спиралей и 4 β-тяжа. В белке присутствует 40 β-поворотов.
Мой белок является α/β белком.
α спираль: Thr 112 - Gly 138
β лист(параллельный): Lys 4 - Cys 10 и Trp 32 - Ile 39
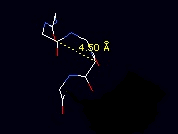
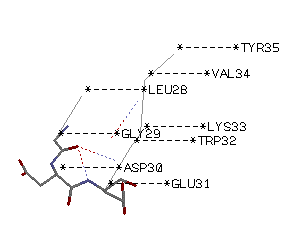
β поворот - Leu28 - Glu 31
β лист(антипараллельный): 1bs2.pdb Lys144-Glu148 Lys366-Val370 и Leu397-Val400
В выбранной мной α-спирали 23 водородных связи H(i,j), причем i и j связаны следующим образом: j=i+4. Это обусловлено тем, сколько аминокислотных остатков находится в одном витке спирали. Все Сβ атомы торчат наружу из спирали.
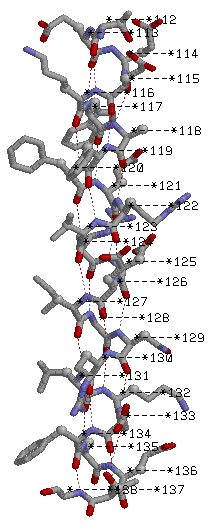
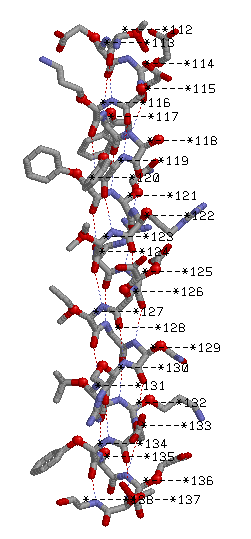
Друг под другом находятся атомы с номерами 119 и 130, расстояние между ними 16,53 A. Радиус спирали можно оценить только примерно: r<2,25 A. Такой вывод я сделала, измерив расстояние между двумя атомами, которые лежат ровно друг напротив друга по диагонали(см. рисунок):
Антипараллельный тяж.
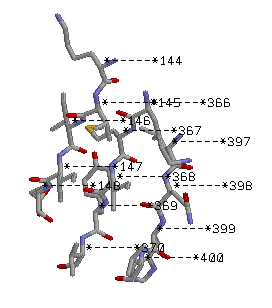
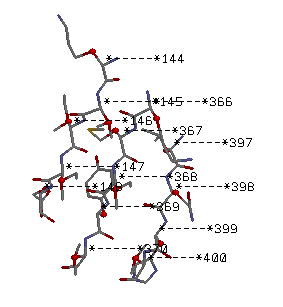
Боковые группы торчат вертикально из β-листа.
Параллельный тяж.
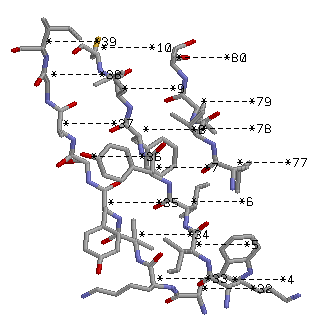
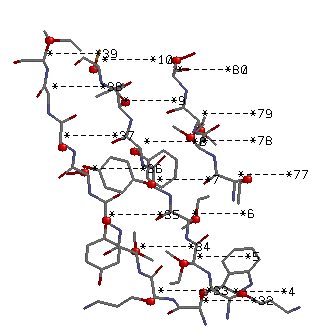
Боковые группы торчат вертикально из β-листа.
RasMol выделяет в поворот только 3 аминокислоты - Gly29Asp30Glu31. Этот поворот скреплен водородоной связью, образованной N-атомом Glu31 и O-атомом Gly29.
© Свистунова Даша