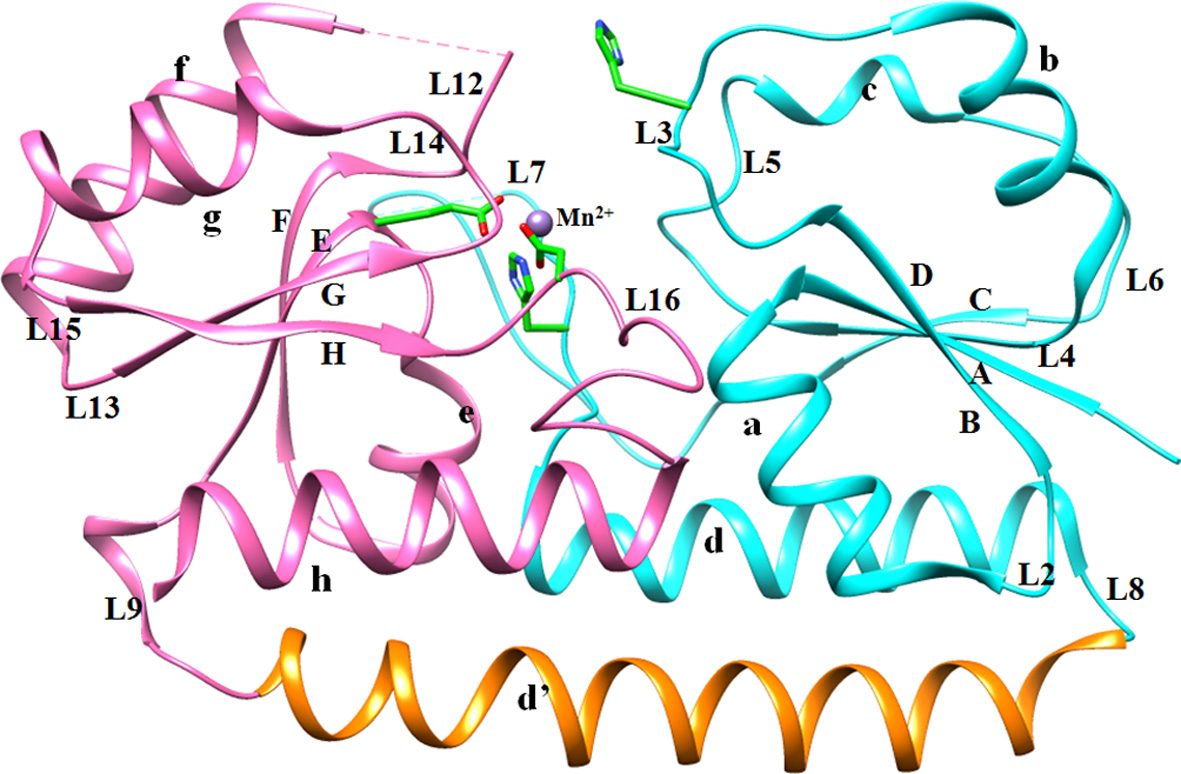
Рис.1. Структура 4cl2. β-листы обозначены буквами A-H, α-спирали обозначены буквами a-h, петли - как L2-L16. Остатки, координирующие ион металла, отображены стиками.
Для задания был выбран периплазматический металл-связывающий белок (PDB
4CL2)
из бактерии Candidatus Liberibacter asiaticus длиной 264 а.о с разрешением 1.63Å, имеющий достаточно структурных
гомологов (RMSD 0,8-3 Å и N_align 50-90%), судя по поиску в PDBeFold (14 штук).
Белок принадлежит к семейству АТФ-связывающих кассетных транспортеров (АВС-транспортеров)
и переносит ионы цинка и марганца в составе комплекса с трансмембранным и АТФ-связывающим белками.
Структурно переносчик состоит из N- и C-концевых доменов, представляющих собой (α/β)4-сэндвичи,
соединенные длинной α-спиралью. Доступные растворителю границы доменов образуют сайт связывания иона металла
(His39, His106 из N-концевого домена, Glu172 and Asp247 - из C-домена).[1]

Рис.1. Структура 4cl2. β-листы обозначены буквами A-H, α-спирали обозначены буквами a-h, петли - как
L2-L16. Остатки, координирующие ион металла, отображены стиками.
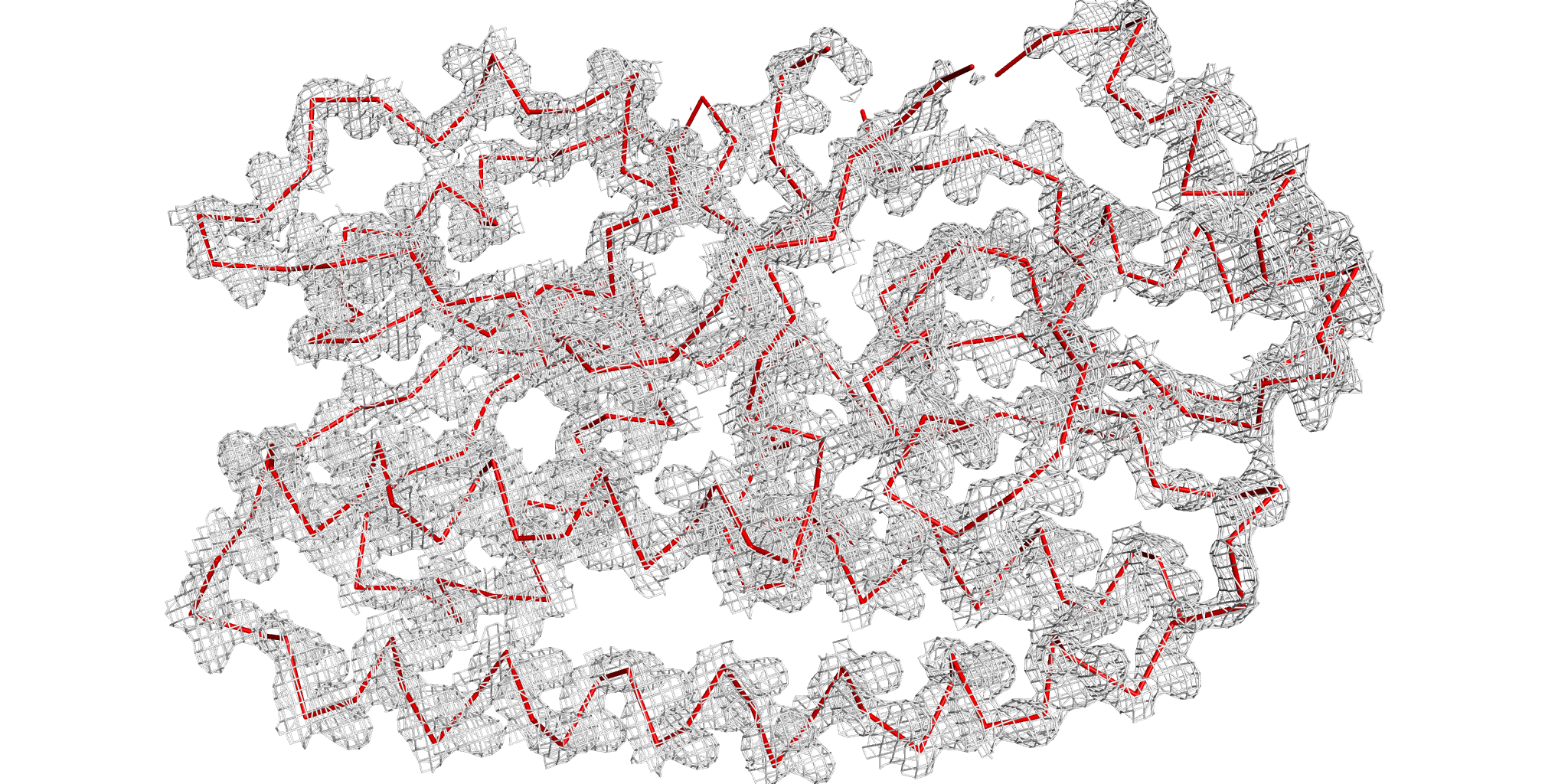
С помощью программы для визуализации молекулярных данных PyMOL(команды isomesh) были получены изображения электронной плотности для остова белка на разных уровнях подрезки (параметр σ).
 Уровень подрезки 1. |
 Уровень подрезки 1,5. |
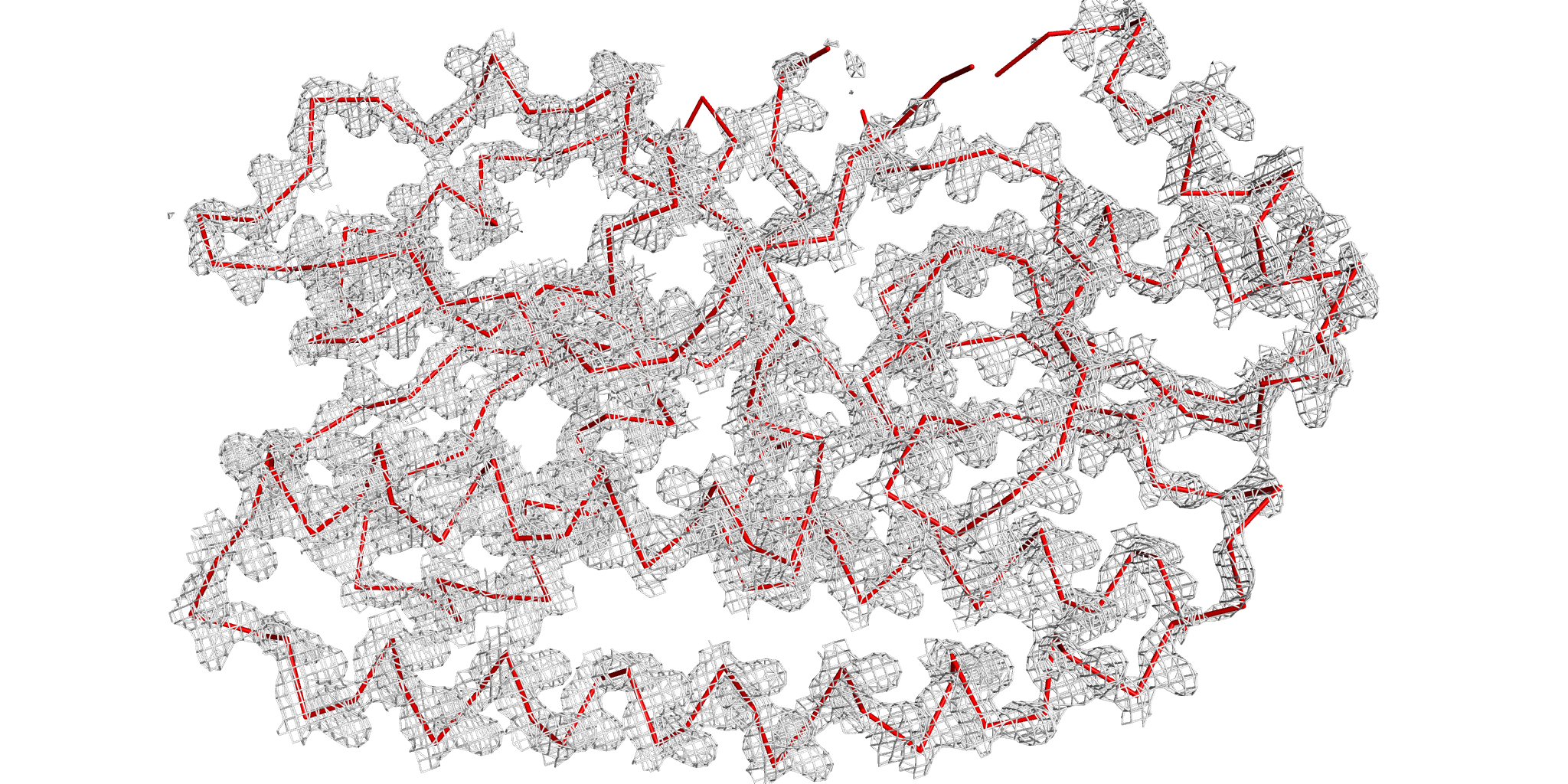 Уровень подрезки 2. |
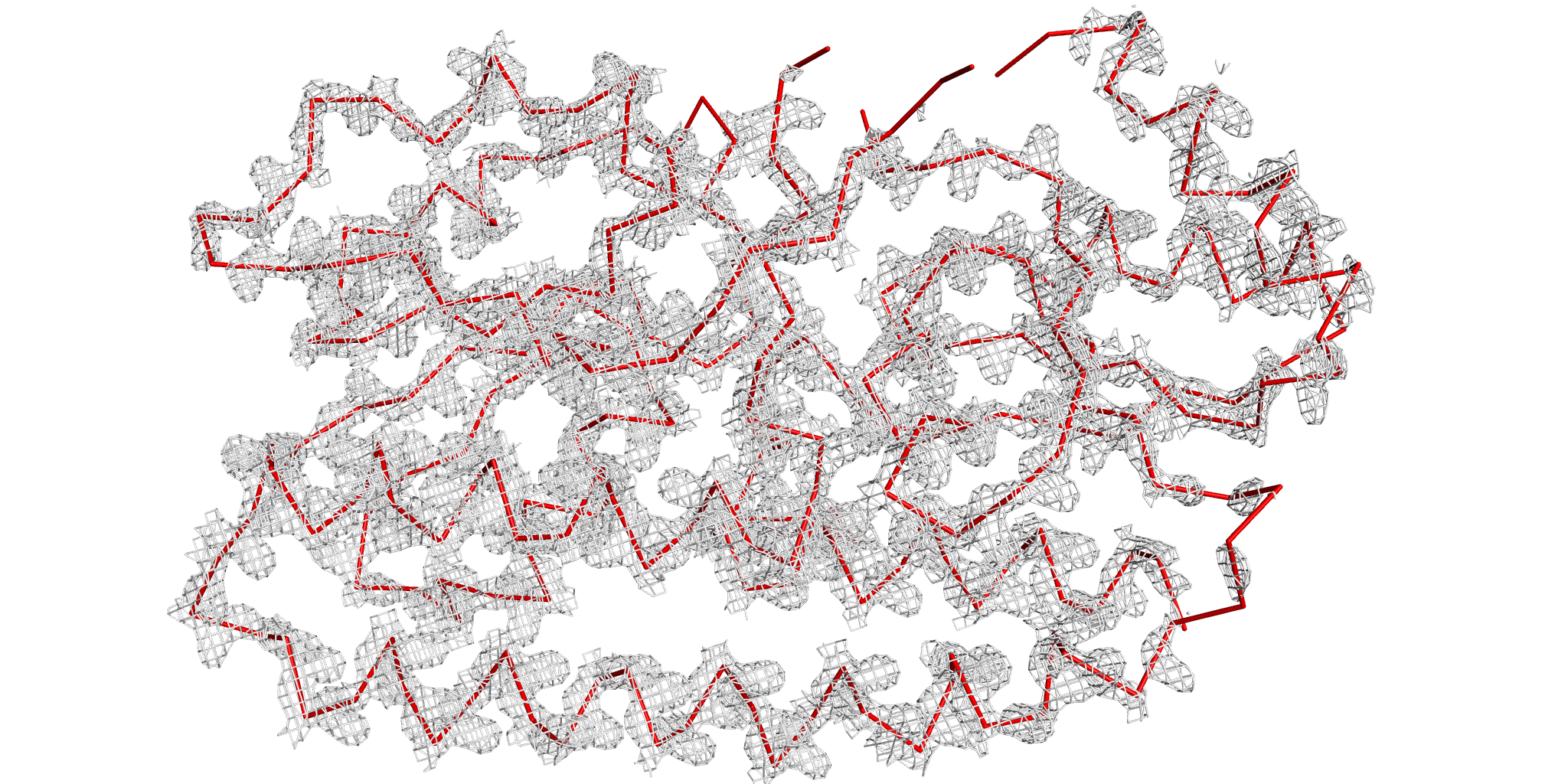 Уровень подрезки 2,5. |
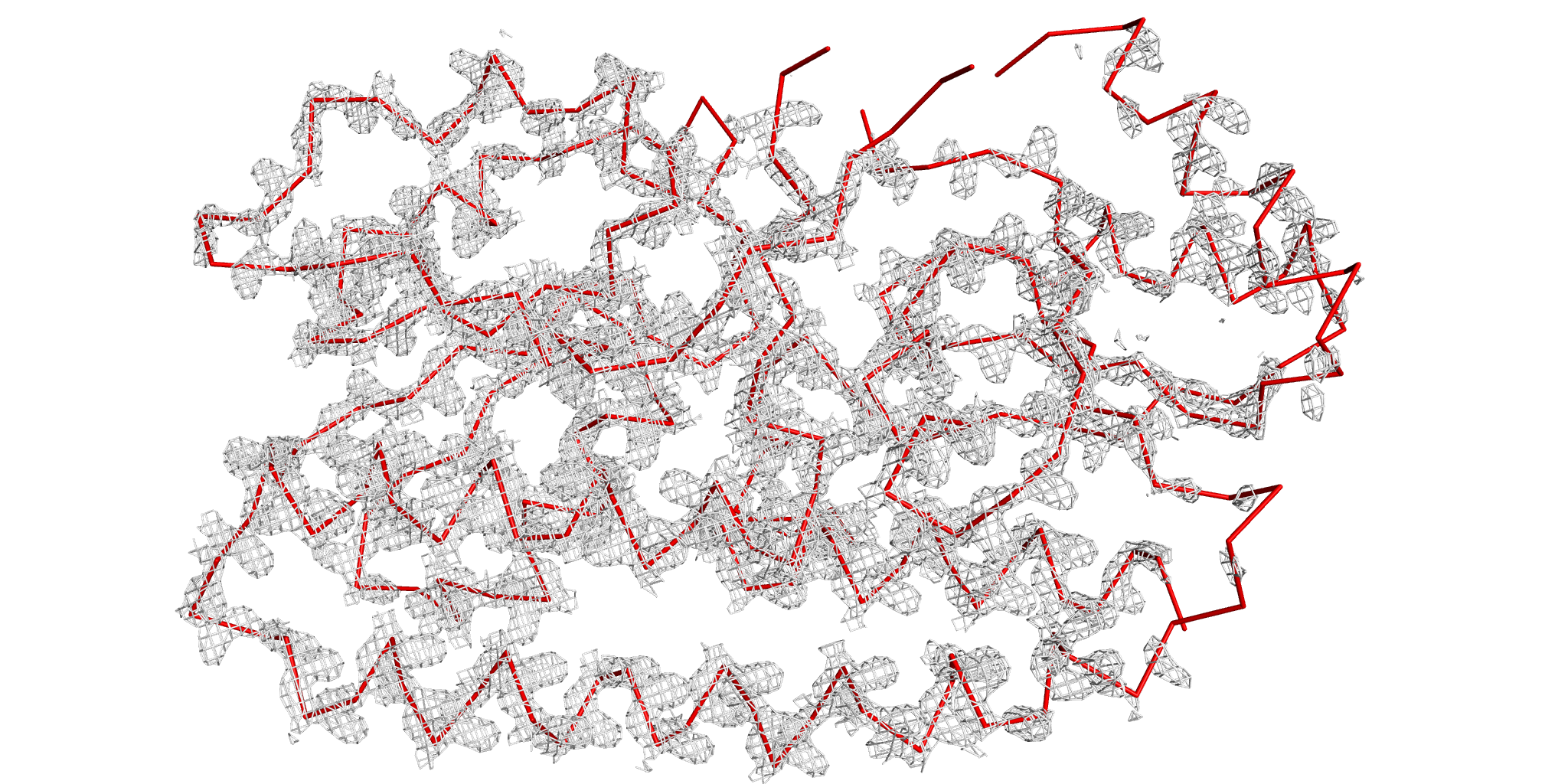 Уровень подрезки 3. |
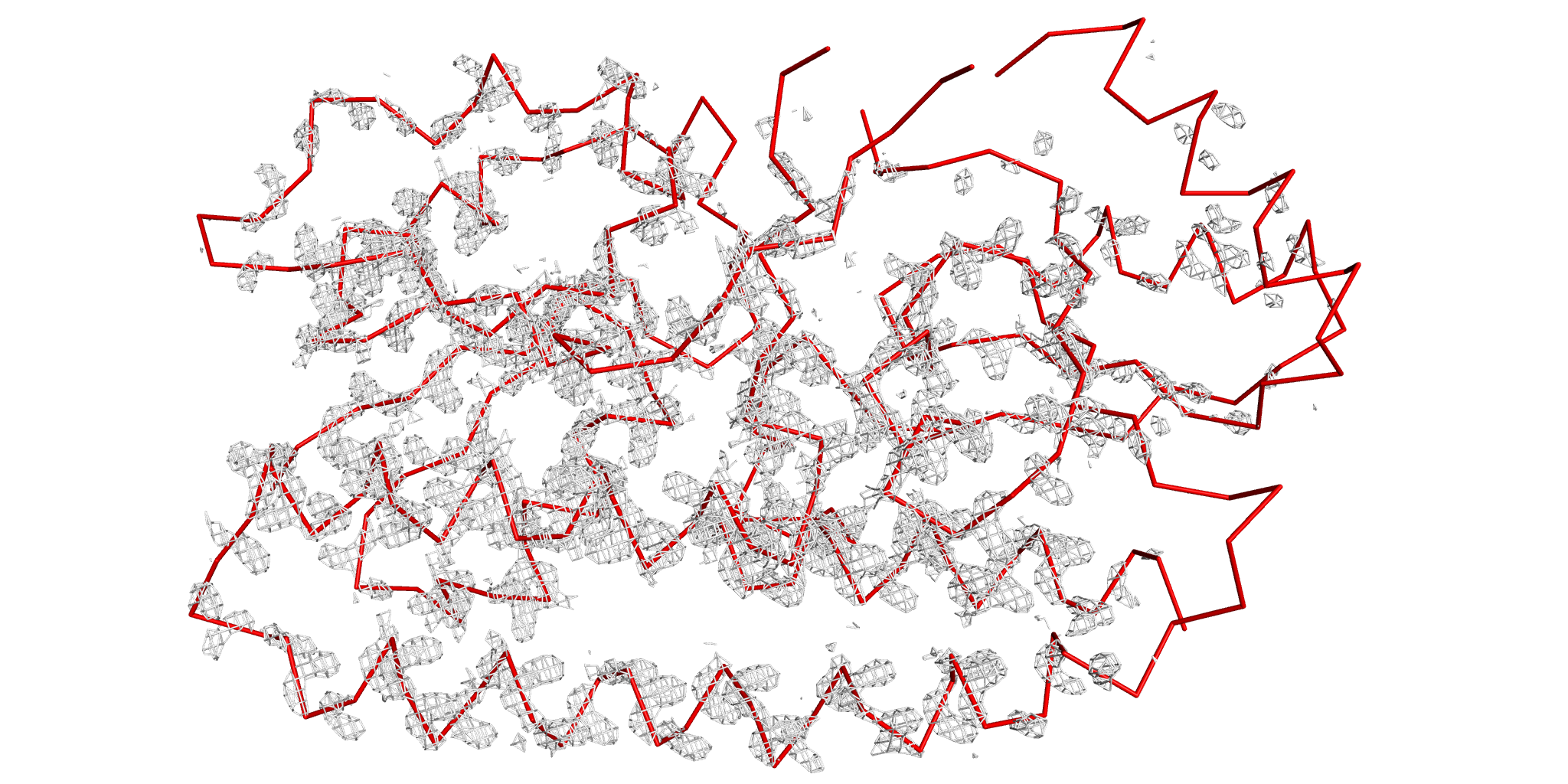 Уровень подрезки 4. |
При малых значениях σ все атомы остова отлично соответсвуют сетке электронной плотности. Однако с увеличением значения параметра, появляется все больше атомов, не вписанных в нее, что может быть объяснено бОльшей подвижностью этих регионов белка, т.к. в первую очередь "оголяются" именно петли.
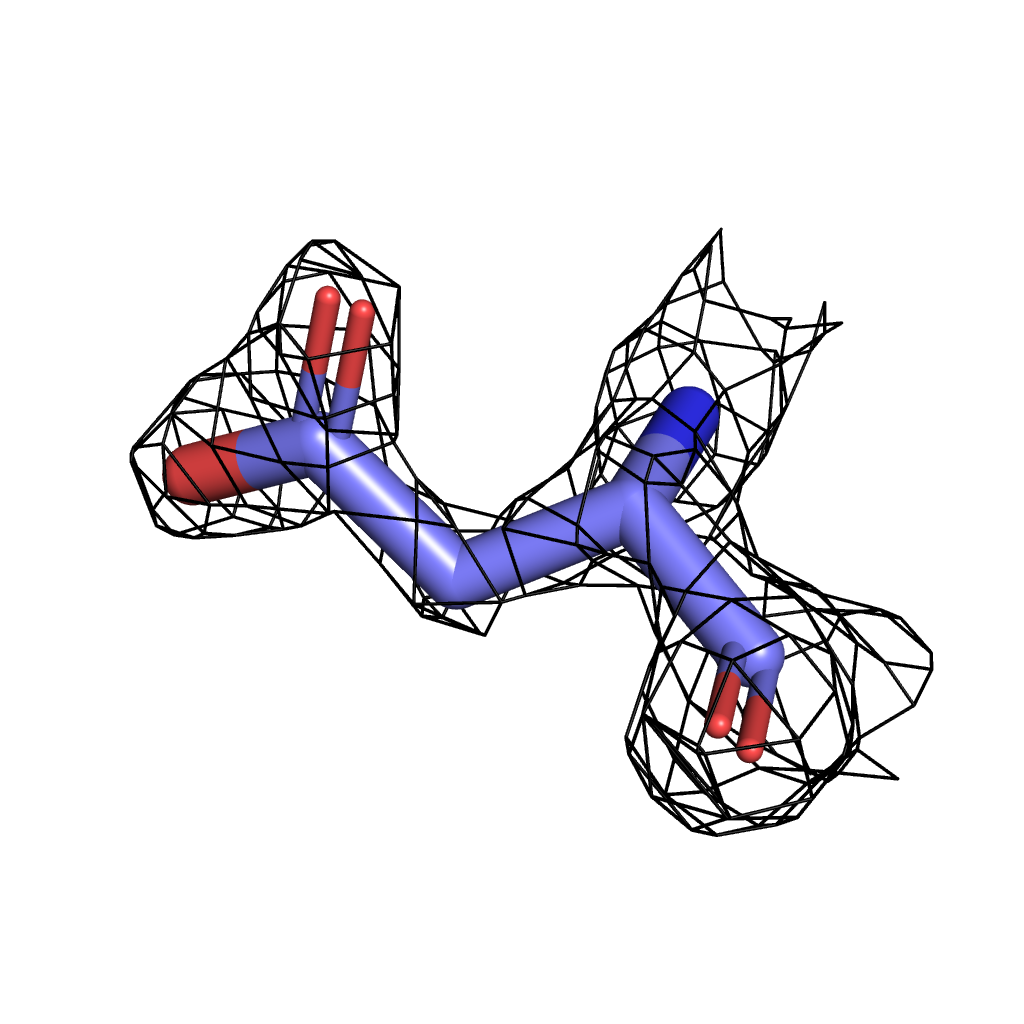 Asp σ=3 |
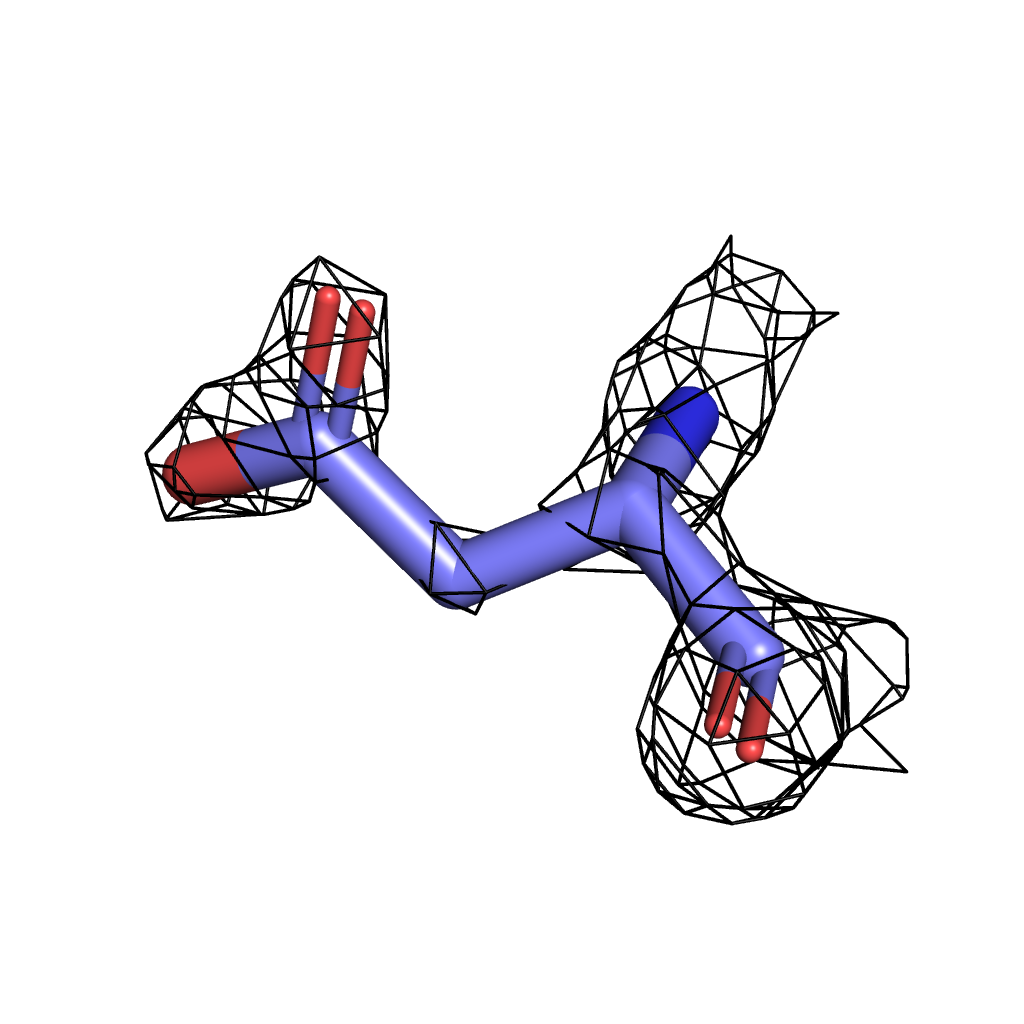 Asp σ=3.5 |
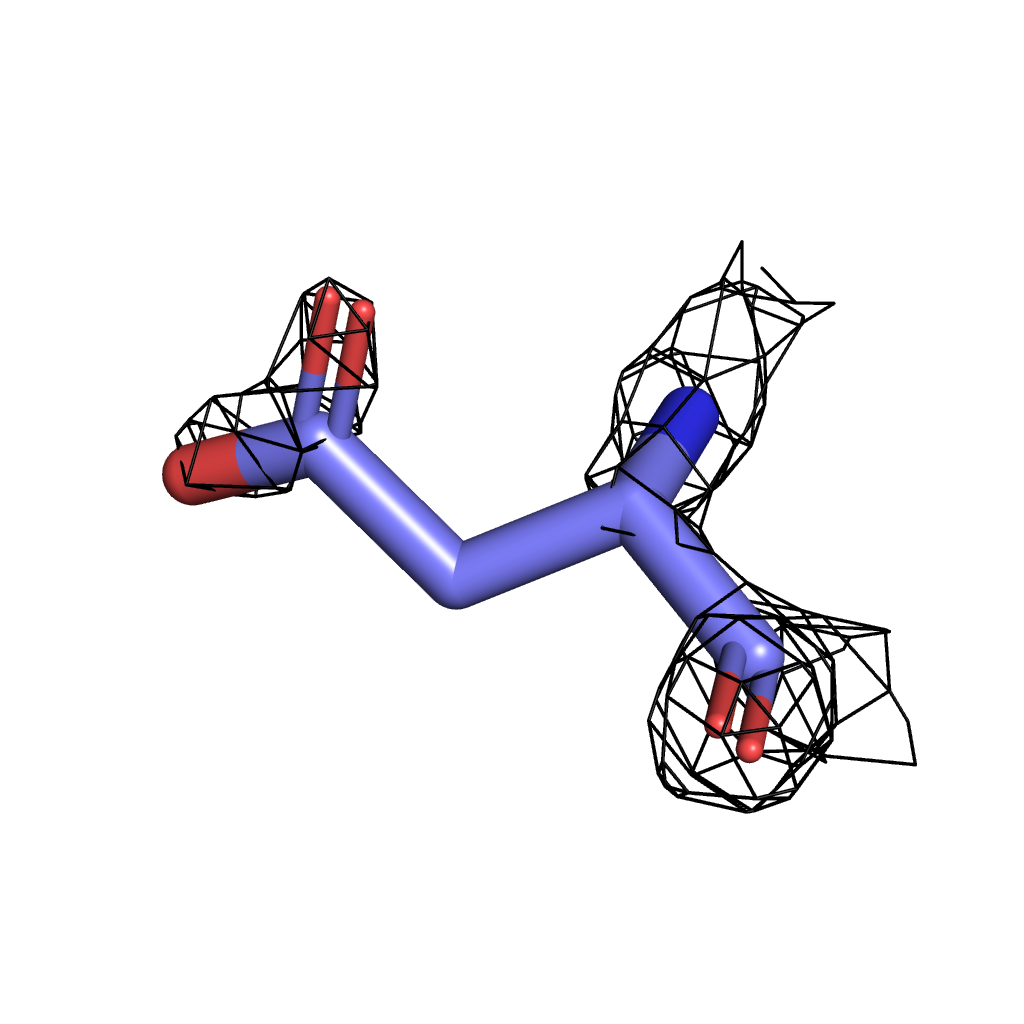 Asp σ=4 |
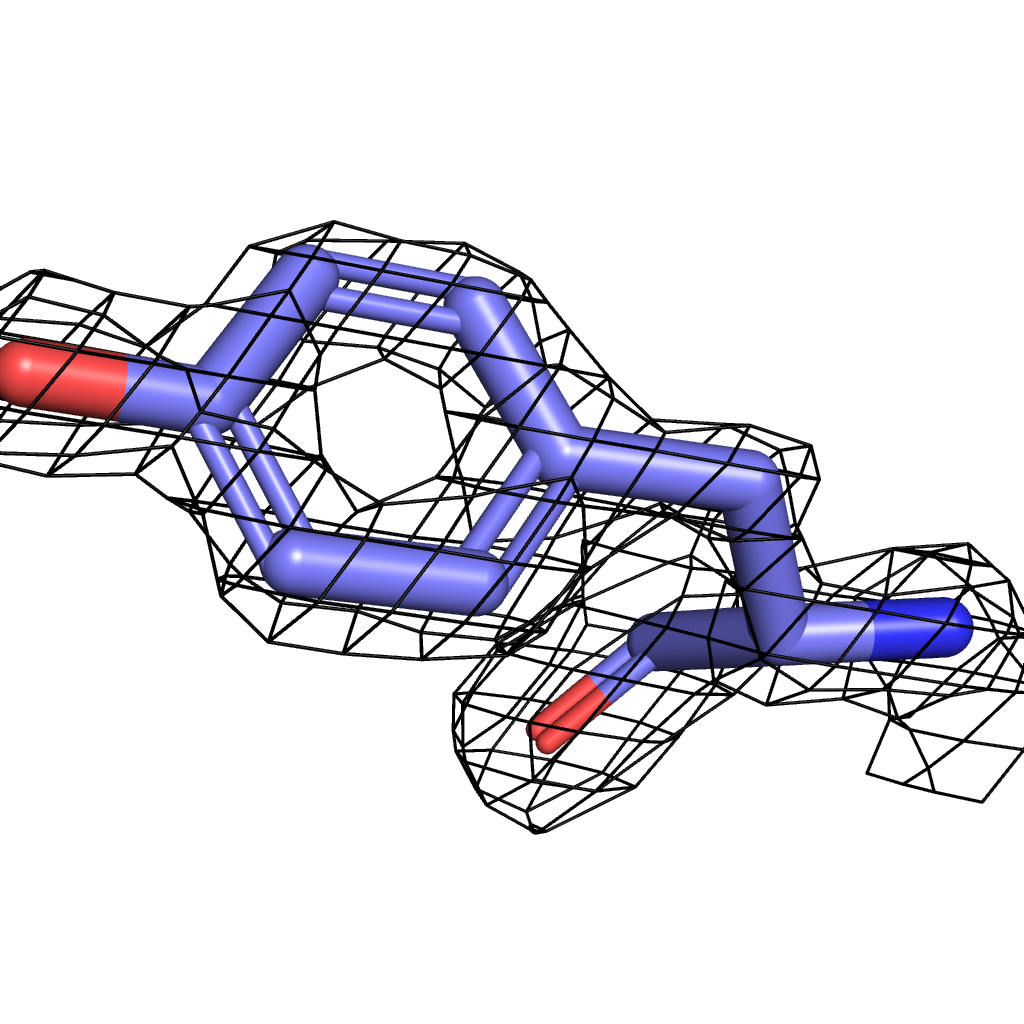 Tyr σ=3 |
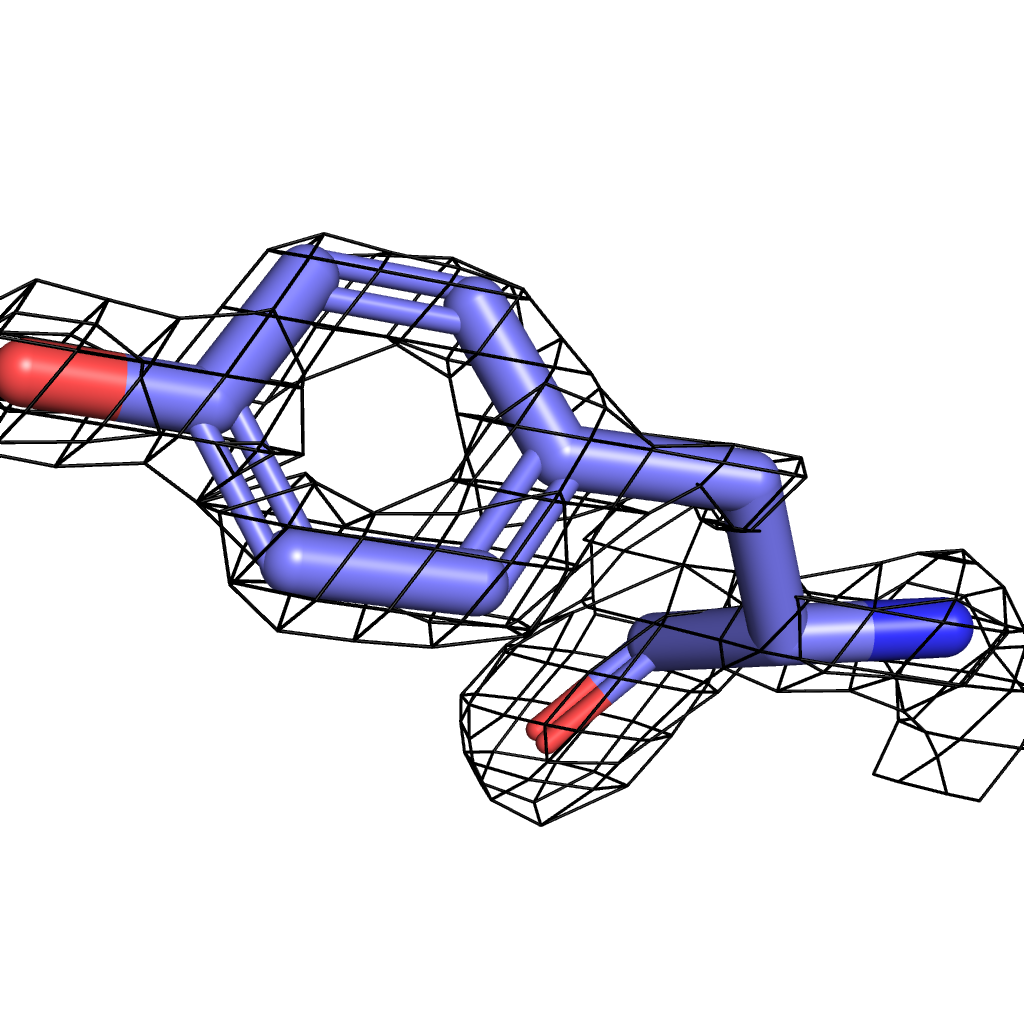 Tyr σ=3.5 |
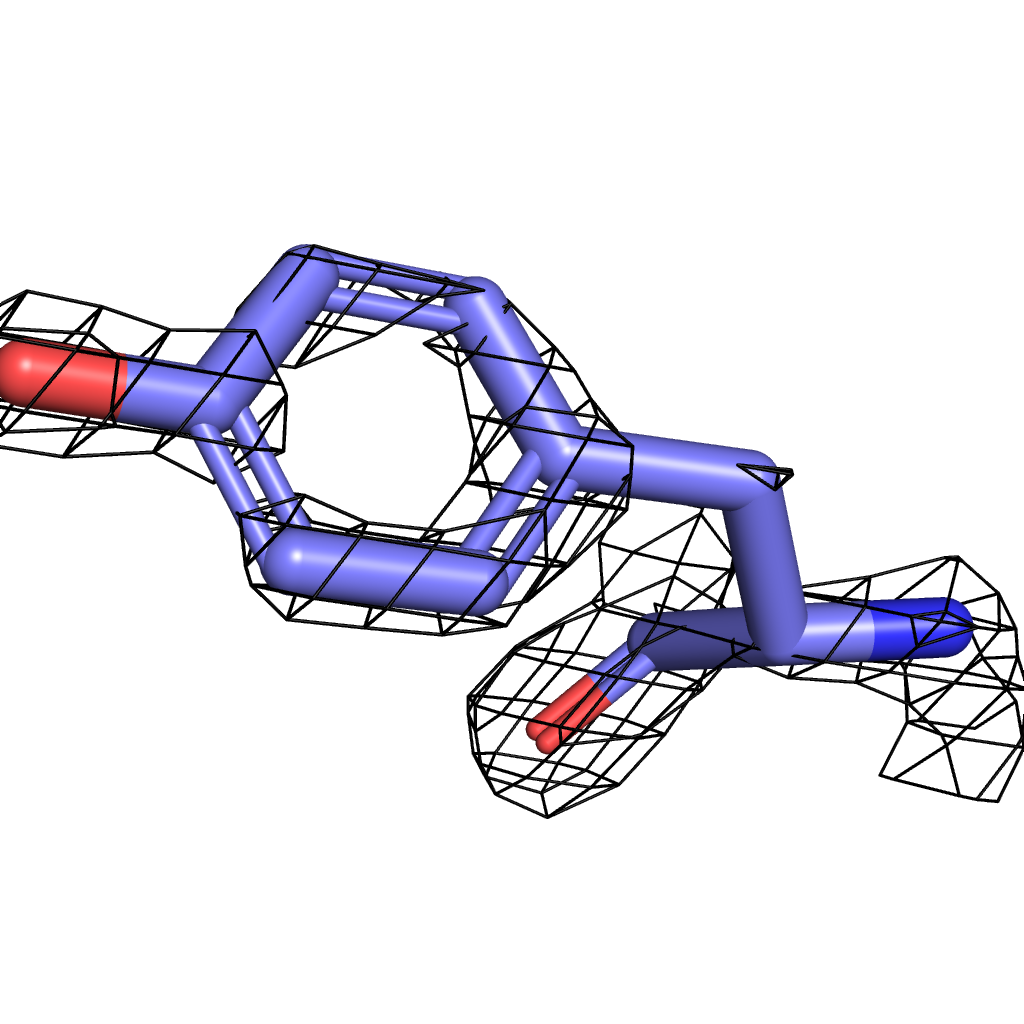 Tyr σ=4 |
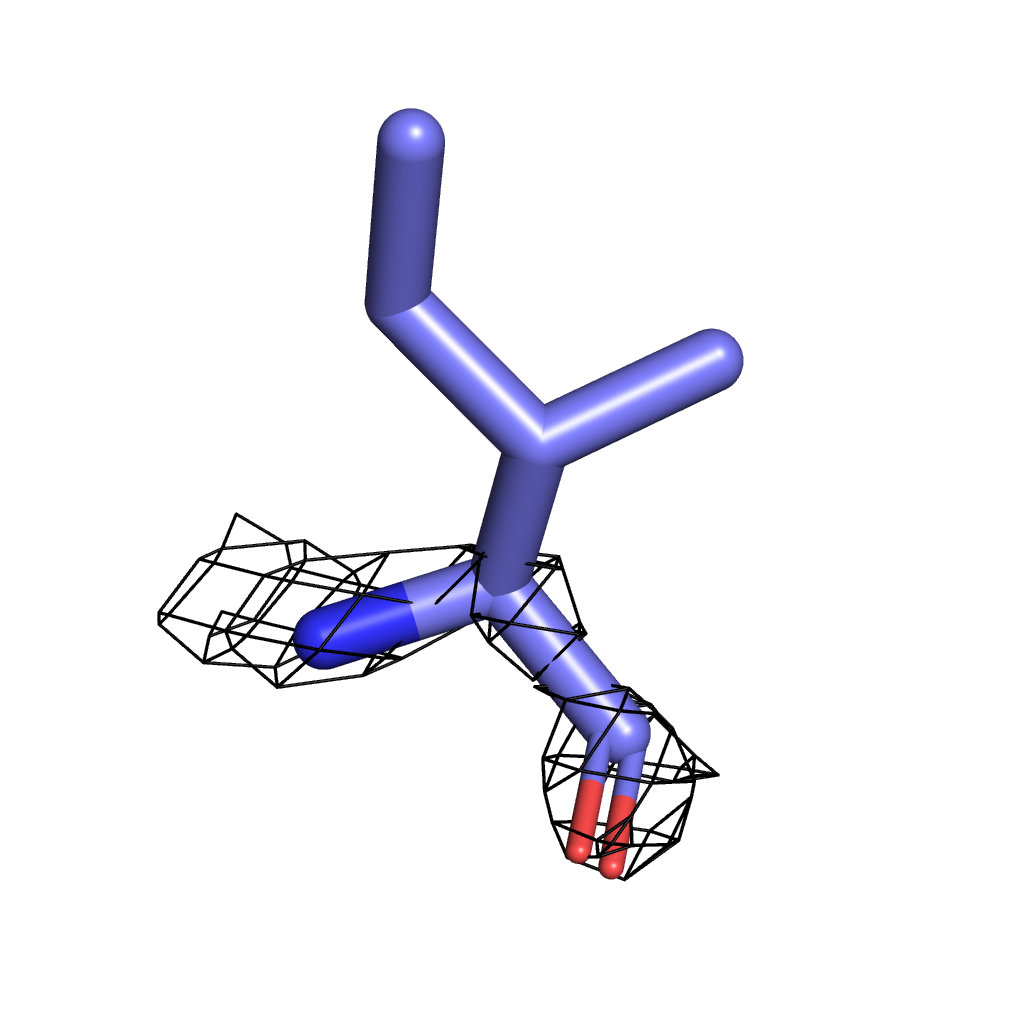 Ile σ=3 |
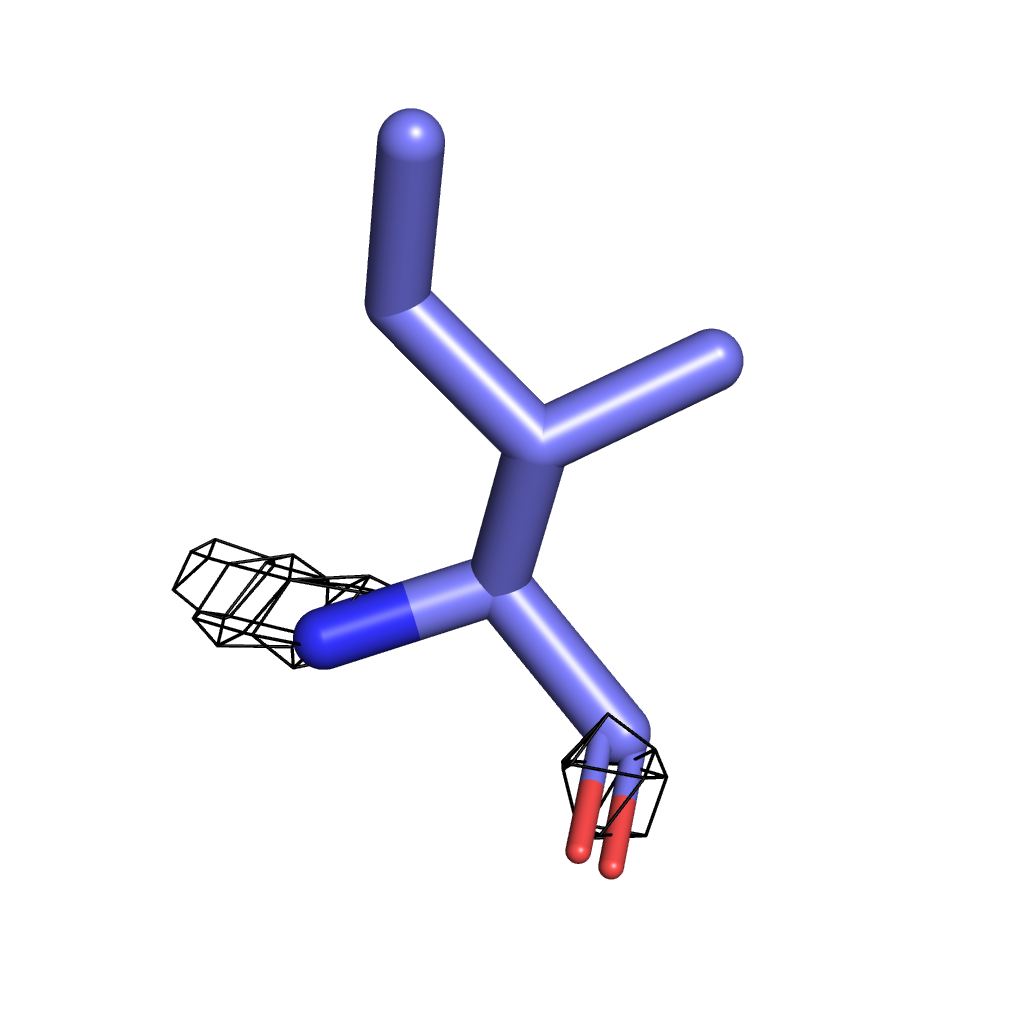 Ile σ=3.5 |
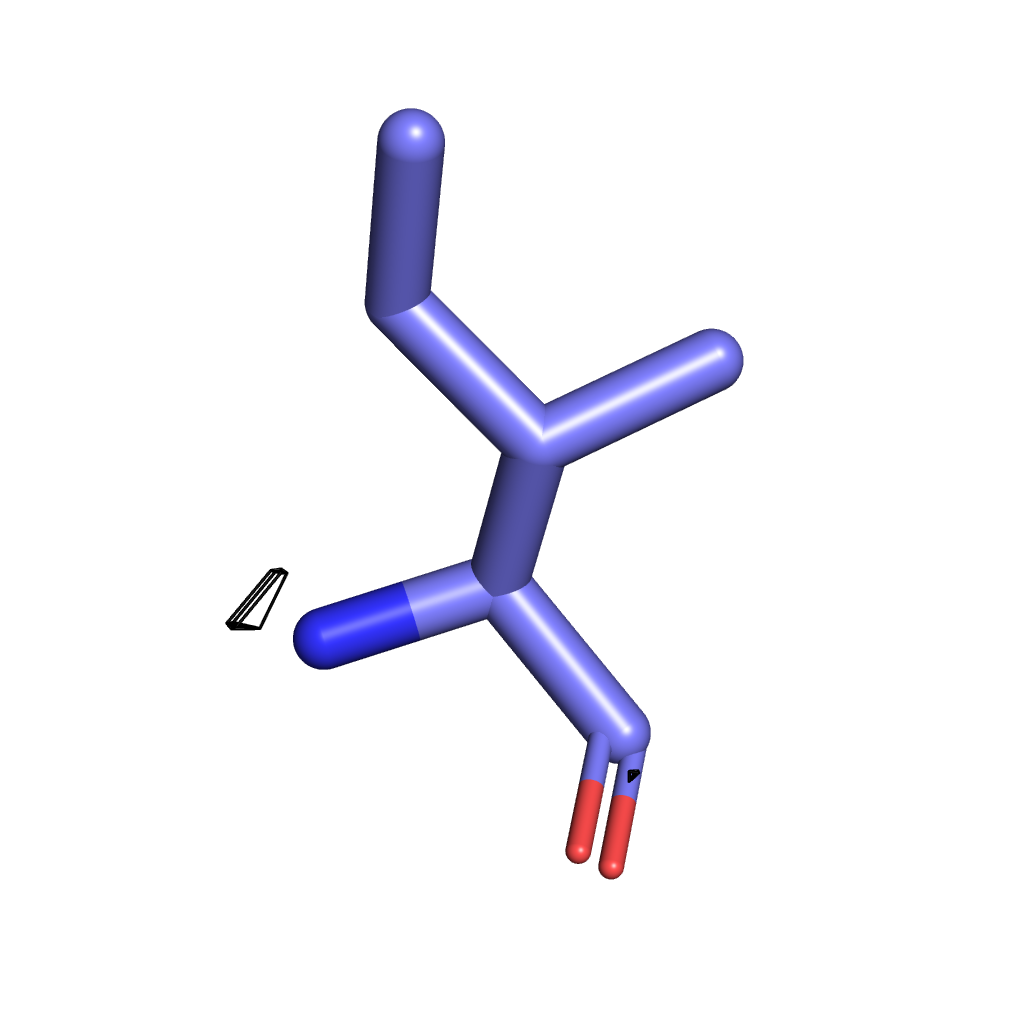 Ile σ=4 |
Для визуализации были выбраны три значения σ - 3, 3.5, 4. Здесь мы можем наблюдать ту же картину, что и в предыдущем задании: при меньшем значении сигмы в сетку ЭП вписаны почти все атомы, однако с повышением уровня подрезки атомы выходят за ее "пределы". При всех выбранных уровнях лучше всего соответвуют сетке атомы азота и кислорода из-за своей большой электроотрицательности по сравнению с углеродом (хуже всего поверхности ЭП соответсвует боковая цепь изолейцина - даже на минимальном выбранном уровне подрезки сетке соответствуют только атомы, участвующие в полипептидной связи). Однако "устойчивыми" оказались атомы кольца тирозина, т.к. атомы углерода в нем имеют sp2-гибридизацию, т.е. более электроотрицательны.
[1]. Sharma N. Selvakumar P., Bhose S., Ghosh DK., Kumar P., Sharma AK., 2015. Crystal structure of a periplasmic solute binding protein in metal-free,
intermediate and metal-bound states from Candidatus Liberibacter asiaticus. J Struct Biol. 189(3), 94-184.
© Кучеренко Варвара 2019