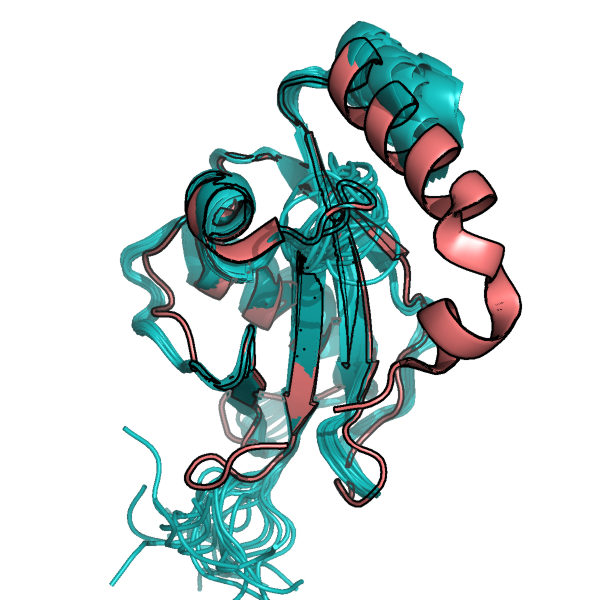
Наложенные структуры 1GNU (красный) и 1KLV (зеленый,показаны все 20 моделей)
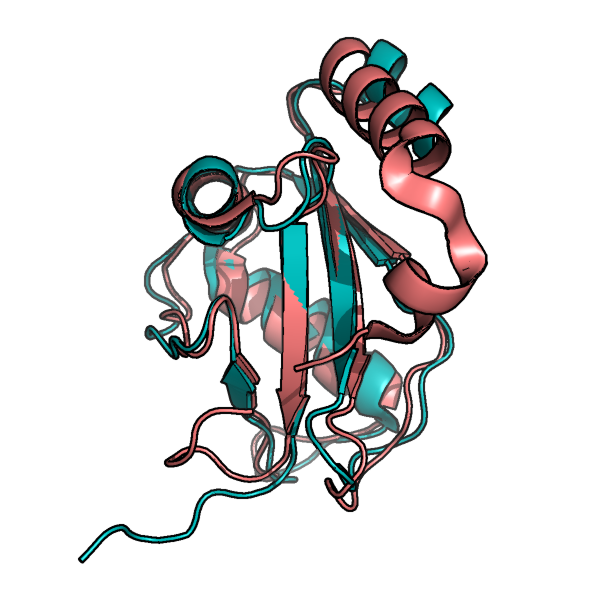
Наложенные структуры 1GNU(красный) и 1KLV (зеленый, одна модель)
Для выполнения задания из таблицы был выбран белок GABARAP (белок, ассоциированный с ГАМК-рецептором). Его структура была определена как методом РСА (PDB ID 1GNU с разрешением 1.75Å), так и методом ЯМР (PDB ID 1KLV с 20 моделями структуры).
 Наложенные структуры 1GNU (красный) и 1KLV (зеленый,показаны все 20 моделей) |
 Наложенные структуры 1GNU(красный) и 1KLV (зеленый, одна модель) |
Элементы вторичной структуры в целом имеют схожее положение, однако не совпадают полностью. Самые больше расхождения наблюдаются в области петель, что логично в виду их большей подвижности.
Будем считать, что между донором протона и акцептором есть водородная связь, если расстояние между ними меньше 3,5 ангстрем. Условие на углы проверяется визуально: воображаемый водород должен быть на линии донор-акцептор или отклоняться от этой линии не более чем на 70 градусов.
В задании требуется сравнить три связи для ЯМР- и РСА-структур: (1)остовную в ядре белка, в альфа-спирали или бета-листе,
(2)водородную связь боковых цепей в ядре белка, (3) водородную связь в петлях, выходящих на поверхность глобулы.
В таблице ниже приведены выбранные из структуры РСА для иллюстрации случаев (1), (2) и (3) примеры и представленность
этих связей в ямр-моделях. Водородной связи в ядре белка
не нашлось, поэтому в итоге была выбрана наиболее удаленная от поверхности водородная связь.
|
Связь |
Положение |
Длина связи, Å (РСА) |
Доля конформеров со связью, % (ЯМР) |
Минимальная длина связи, Å (ЯМР) |
Средняя длина связи, Å (ЯМР |
Максимальная длина связи, Å (ЯМР) |
|
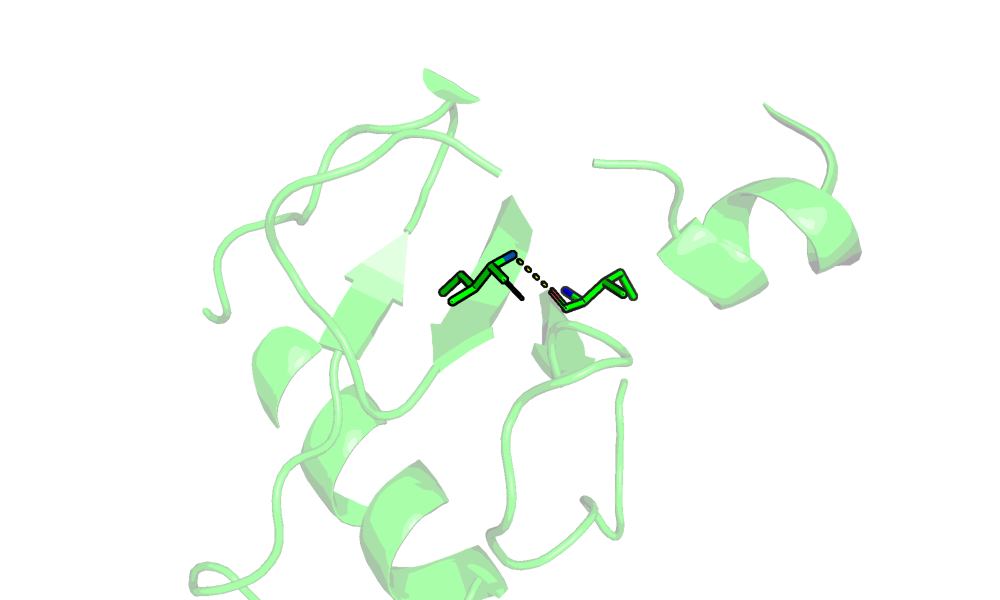
ILE32.O--ILE107.N |
бета-тяж, остовная, в ядре |
2.9 |
100 |
2.84 |
3.17 |
3.1 |
|
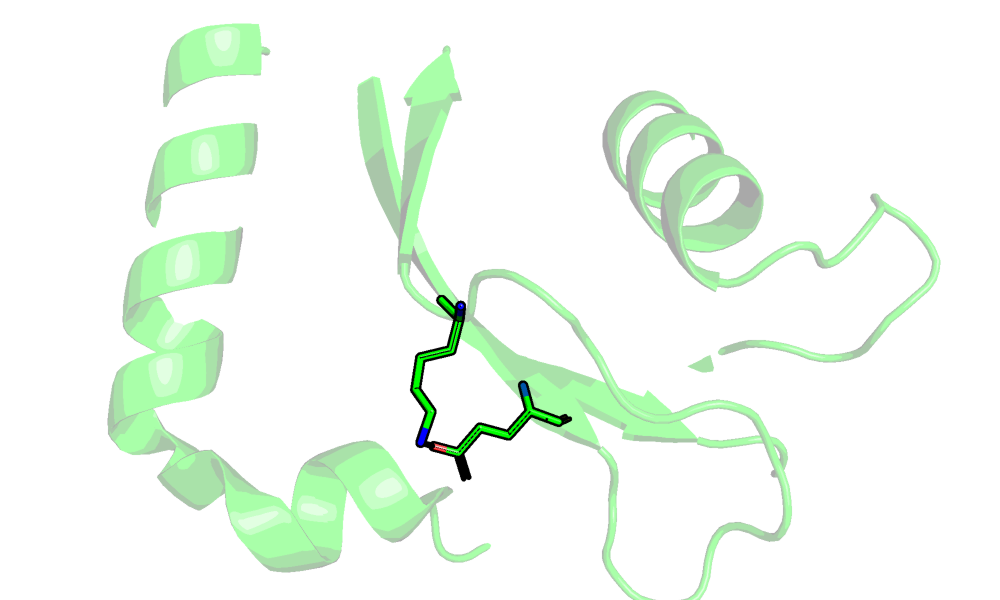
GLU34.OE2--LYZ47.NZ |
связь боковых цепей, на границе бета-тяжа, +- в ядре |
2.8 |
0 |
- |
- |
- |
|
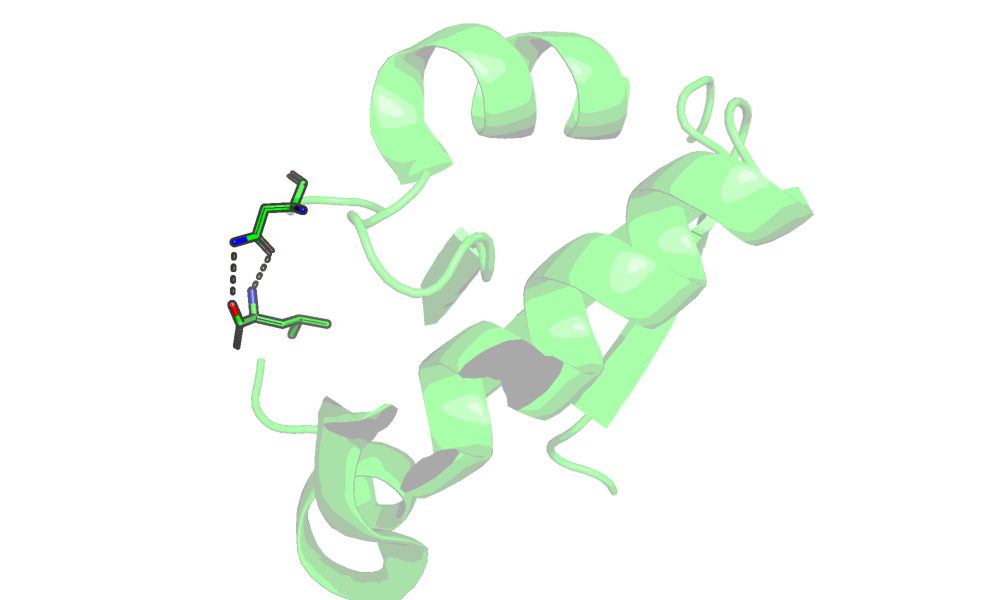
ASN82--LEU117 (ND2--OXT) (OD1--N) |
петля, на поверхности, связь боковых цепей |
3.2 2.8 |
0 0 |
- |
- |
- |
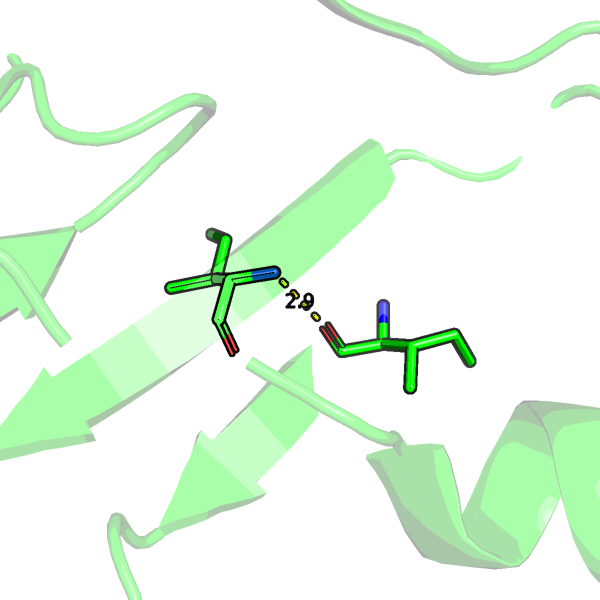 |
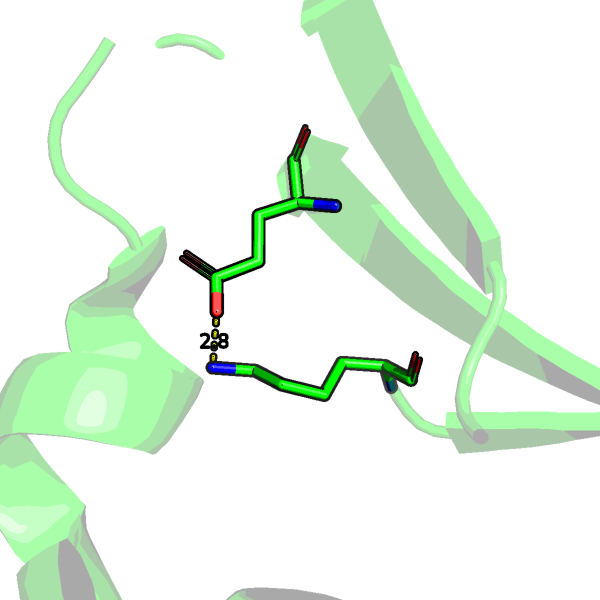 |
 |
| Остовная водородная связь в ядре белка (ILE32.O--ILE107.N) | Водородная связь боковых цепей в ядре (GLU34.OE2--LYZ47.NZ) | Водородная связь боковых цепей на поверхности (ASN82--LEU117) |
 |
 |
 |
Таким образом только остовная связь в ядре белка также присутствует во всех моделях ЯМР-структуры.
Остальных выбранных связей вовсе не оказалось в моделях ЯМР в виду того, что на поверхности у структур
бОльшая подвижность. В эксперименте ЯМР белок находится в растворе, т.е. находится во множестве
различных состояний, в то время как в эксперименте РСА белок фиксирован (закристаллизован), поэтому
поэтому положения остатков, при которых между связанными в модели РСА атомами возможна водородная связь,
встречаются не во всех моделях.
Связей конкретно в ядре глобулы не
обнаружилось, поэтому я решила выбрать наиболее отдаленный от поверхности контакт. Возможно причина
отсутствия соответствия в ЯМР-моделях этой связи в том,
что выбранные мной остатки находятся на подвижном конце бета-тяжа слишком близко к поверхности.
Контакты в петлях на поверхности глобулы ожидаемо не нашлись в ЯМР-конформерах, т.к. это наиболе
подвижные элементы структуры.
© Кучеренко Варвара 2019