Мембранные белки
Задание 1. Анализ множественного выравнивания трансмембранных белков
Целью первого задания было убедиться в корректности предсказаний сервиса TMHMM, предсказывающего трансмембранные цепи, и проверить консервативность различных частей трансмембранных белков. Мне выдали белок 4u9l_A - одну из цепей белка человека, представляющего домен магниевого канала MgtE.
Для поиска гомолоов я запустил blastp на сайте EBML EBI со следующими параметрами: база данных - UniProt Clusters 50%; количество белков в выдаче - 250, остальные параметры по умолчанию. Е-value худшей находки в выдаче - 1.2E-26. Белки выдачи были выровнены на сайте EBML EBI с помощью утилиты Muscle. Fasta-файл с выравниванием доступен здесь. После этого из выравнивания были удалены гэпы, добавлена последовательность исходного белка, и полученный файл был еще раз выровнен в jalview. Fasta-файл с выравниванием доступен здесь. При покраске этого выравнивания методом ClustalX заметны несколько крупных консервативных блоков, содержащих в себе преимущественно гидрофобные остатки. Были удалены последовательности, кардинально отличающиеся от остальных: D8TJJ5, A8J2E0, C1EFX7, AOA087SPW8, AOAG1I, Q5E349, R6GEG6, Q7P346, R6KSK2, AOA140K2J6 и ещё около 30 других с длинными идентификаторами (то есть скорее всего аннотированные автоматически). Исходный белок примерно вдвое короче большинства остальных, и выровнялся только с двумя консервативными блоками. Позиции, соответствующие трансмембранным спиралям, в основном представлены гидрофобными аминокислотами и являются довольно хорошо консервативными (правда, в случае гидрофобных остатков иногда сохраняется только функциональная консервативность).
Трёхмерная структура белка была ассоциирована с ним в выравнивании и покрашена согласно гидрофобности (Рис.1). Можно заметить, что в спиралях белка преобладают гидрофобные учатки (красный), но также заметны и продолжительные гидрофильные учаски. Это можно легко объяснить, если вспомнить, что белок - часть магниевого канала.
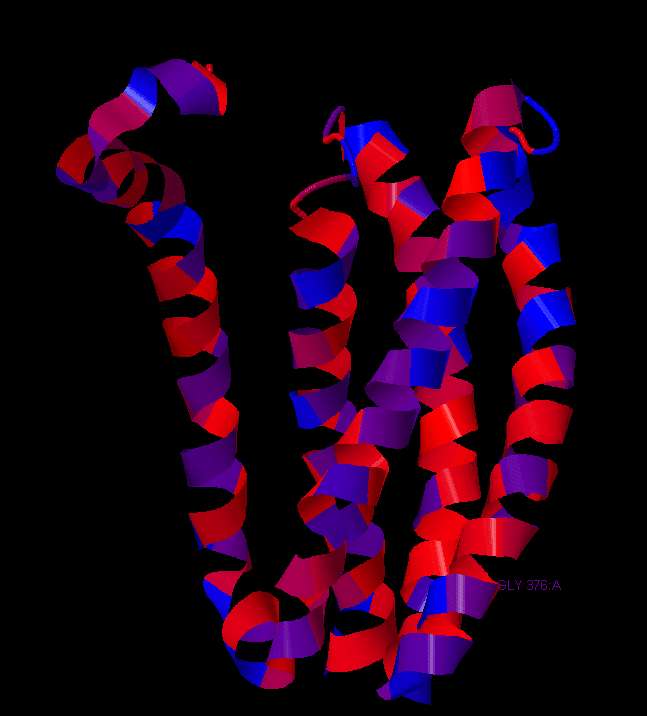
Структура белка была также раскрашена согласно заряду боковой цеми аминокислотных остатков (рис.2). Спирали белка практически полностью заряжены нейтрально, но есть несколько заряженных остатков. Присутствие заряженных остатков в трансмембранных гидрофобных участках может быть обусловлено функцией белка, а именно взаимодействием с ионами.
Участки белка, однозначно поределенные как гидрофобные, были размечены в выравнивании (ряд TM_REAL). С помощью сервиса TMHMM было получено предсказание трансмембранного участка для гомолога исходного белка D1Y2V3. Предсказанные трансмембранные участки были размечены в выравнивании (ряд TM_PREDICTEDб пометка Р). Сервис предскказал пять трансмембраннх участков, которые относительно хорошо прекрываются с определенными из трехмерной структуры. Один из таких участков, скорее всего, был определен ошибочно, так включает в себя большое количество гидрофильных остатков. В ряду TM_PREDICTED он отмечен буквой F (false). Jvp-проект доступен здесь.
В целом, предсказание самих участков совпадает с реальностью. Ошибка сервиса, скорее всего, связана с его установкой определять преимущественно участки одинаковой длины, что не всегда отражает действительность вследствие разности в пространственной укледке тех или иных белков.
Назад к странице семестров