Визуализация молекул
| № | атомы | длина связи (Å) | угол N-O-C (°) |
| альфа-спирали | |||
| 1 | N(75LEU) - O(71ASP) | 2.95 | 154.2 |
| 2 | N(18GLN) - O(14LEU) | 2.96 | 155.4 |
| 3 | N(73ARG) - O(69SER) | 2.98 | 157.8 |
| бета-слои | |||
| 1 | N(34VAL) - O(82GLY) | 2.84 | 131.5 |
| 2 | N(81ILE) - O(34VAL) | 2.81 | 159.8 |
| 3 | N(82GLY) - O(34VAL) | 3.57 | 133.2 |
Базовая инофрмация о белке
Данный практикум посвещён исследованию структуры восстановленой формы солюбилизированного домена свиного цитохрома b5. Надо пояснить, что солюбилизация - это коллоидное растворение, сопровождающееся проникновением обычно неполярного вещества внутрь мембран. В данном случае этот процесс использовался для экстрацкии цитохрома b5 из мембран эндоплазматического ретикулума.
Цитохром b5 - это гемопротеин, способный существовать в окисленном и восстановленном состояниях. Благодаря этому он является участником большого количества биохимических путей, начиная превращением насыщенных жирных кислот в ненасыщенные и заканчивая синтезом холестерола. Рассматриваемая структура принадлежит белку в восстановленной форме.[1]
Характеристика водородных связей данного белка
Говорить о средней длине и среднем угле водородной связи в данном случае было бы некорректным. Три измерения в случае альфа-спирали были сделаны для двух разных спиралей из-за малого количества водородных связей, приходящихся на одну спираль. Однако, если не придавать этому большого значения, можно обобщить, что в среднем длина водородной связи в бета-слоях (3.07 Å) больше, чем в альфа-спиралях (2.963 Å). Средний угол составляет 155.8° для альфа-спиралей, 141.5° для бета-слоя. Данные показатели более-менее согласуются с литературой (средняя длина связи (N..O): 2.878 Å, угол - от 140° до 160°)[2].
Регуляция редокс-статуса гема
Исследование водородных связей в белке может не только снабдить нас сведениями об устройстве альфа-спиралей и бета-слоёв. В статье [3] заявлено, что в данном белке присутствует водородная связь между азотом кольца His68 и карбонильным кислородом Phe63, и, более того, существует вариативность длины данной связи в зависимости от окисленного/восстановленного состояния белка. Это показывает, что система водородных связей вокруг His68 могла бы участвовать в регуляции состояния гема [4]. В данной работе и была получена структура, рассматриваемая в данном практикуме. Были опубликованы pbd файлы для двух структур в окисленном и восстановленном состояниях.
Рассматриваемая в данном практикуме структура принадлежит структуре №2 в востановленном состоянии. Исследователи измерили разность между длиной связи в окисленном и восстановленном состояниях для структуры №1 и сделали вывод о влиянии на функцию белка длины этой связи.
Так как в работе не рассматривалась эта водородная связь для структуры №2, я решила проверить, изменяется ли длина водородной связи в данной структуре. Ниже представлено воспроизведённое мной измерение для структуры №1, результаты совпадают с тем, что есть в статье.
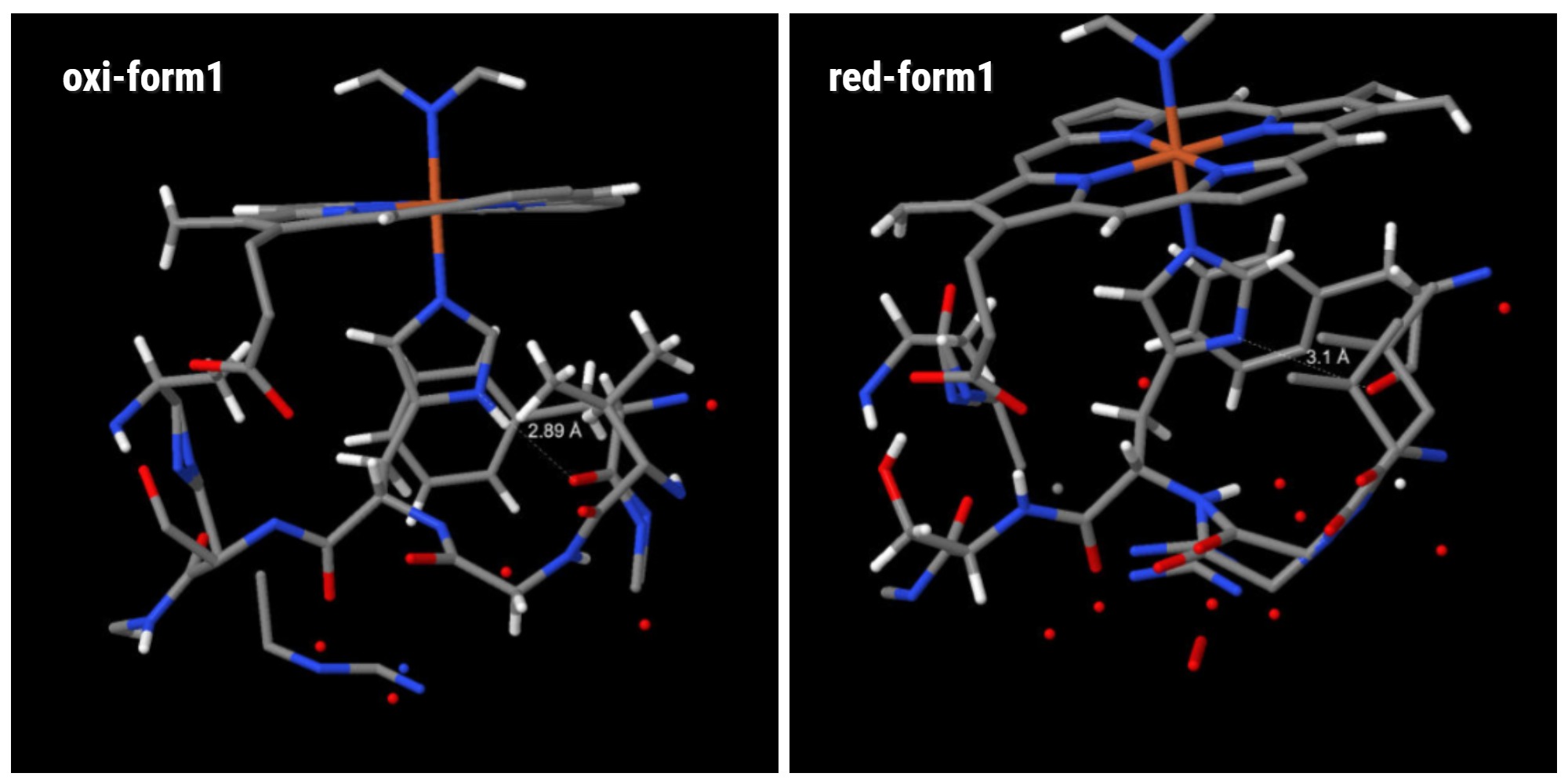
Аминокислоты белка в радиусе 5 ангстрем от His68. Длина водородной связи для структуры №1. Слева: окисленное состояние, справа: восстановленное состояние.
Разность составляет около 0.2 Ангстрем (рис.1). Затем было измеренно растояние для структуры №2.
.jpg)
Аминокислоты белка в радиусе 5 ангстрем от His68. Длина водородной связи для структуры №2. Слева: окисленное состояние, справа: восстановленное состояние.
Разность составляет 0.01 Ангстрем, причём связь в окисленной форме короче, чем в востановленной. В чём может быть причина данного явления?
Приготовление образца двух структур происходило по-разному. Структура №1 была растворена в буфере с pH 7.43, структура №2 - с pH 5.5 [2]. При низком pH длина связи приближена к длине связи в окисленной форме в нормальном pH.
Из этого делаем важный вывод: всякий раз, работая со структурой в Jmol/PyMOL/ect надо помнить не только об особенностях строения белка, но и об условиях, в которых была получена его структура.
Ссылки на использованные источники
- [1] Molecular modeling database (MMDB) NCBI
- [2] Taylor, R., Kennard, O. & Versichel, W. (1984). Acta Cryst. B40, 280-288.
- [3] Hirano Y, Kimura S, Tamada T. High-resolution crystal structures of the solubilized domain of porcine cytochrome b5. Acta Crystallogr D Biol Crystallogr. 2015;71(Pt 7):1572-81.
- [4] Poulos, T. L. (1996). J. Biol. Inorg. Chem. 1, 356–359