Множественное выравнивание
Для выполнения практикума я выбрала известный белок миозин, а именно тяжёлую цепь его девятой изоформы.

Рис. 1: Домены в исследуемом белке.
Для выравнивания были взяты первые 20 белков выдачи BLAST, включая человеческий миозин-9, по которому производился поиск.
При приведении результатов выравнивания в порядок была удалена последовательность
тяжёлой цепи не-мышечного мизозина дрозофиллы, который играет роль в формировании
межклеточных контактов, а также специфичного для насекомых джонстонова органа.
Были удалены и другие последовательности. После выполнения всех операций
в выравнивании осталось 10 последовательностей (рис.2).
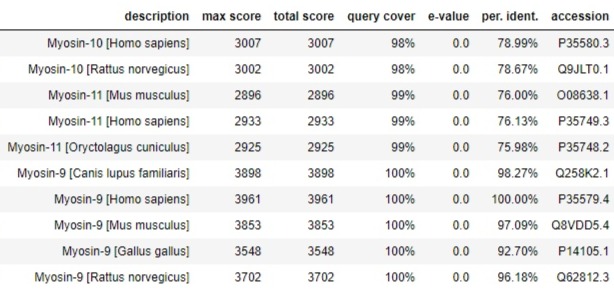
Рис. 2: Последовательности, оставшиеся в выравнивании.
Было найдено 11 больших блоков в выравнивании. Так как последовательность белка
длинная, и консервативных позиций много, я сознательно пренебрегала небольшими блоками.
Получившиеся блоки имеют координаты:
27-207, 212-845, 894-975, 1134-1176, 1313-1333, 1410-1496, 1514-1592, 1645-1657,
1731-1750, 1777-1830, 1881-1913.
Бластом в pfam было найдено два основных функциональных домена исходного человеческого миозина-9.
Это головка миозина (pfam00063) c координатами 83-764 и хвост (pfam01576) с координатами 841-1921.
Также особо важен участок 174 – 181, в котором происходит связывание АТФ.
Как мы видим, эти интервалы хорошо согласуются с найденными блоками.
Однако мы не можем объединить блоки 27-207, 212-845 так, чтобы головка миозина
находилась в пределах одного блока из-за небольшого разделяющего их участка с делециями.
Очень интересно то, что данные делеции есть только у миозина-9 из разных организмов, причём они встречаются у всех белков миозина-9 в одних и тех же сайтах.
Последовательность АТФ-связывающего участка содержит только 100% консервативные сайты.
скачать проект Jalview
скачать изображение выравнивания