 |
 |
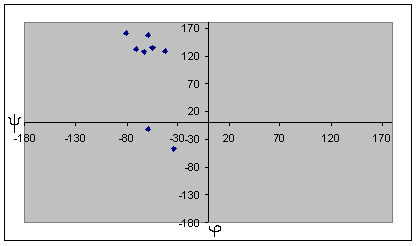
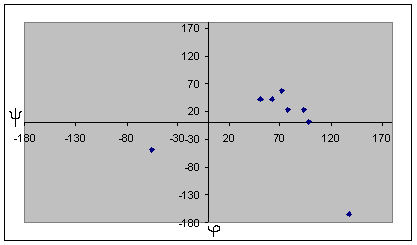
| Карта для пролина | Карта для глицина |
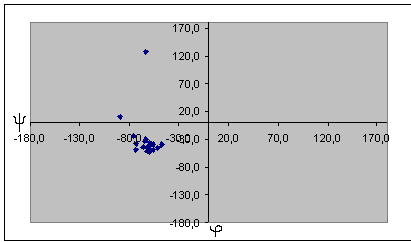 |
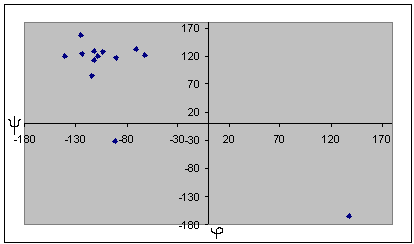 |
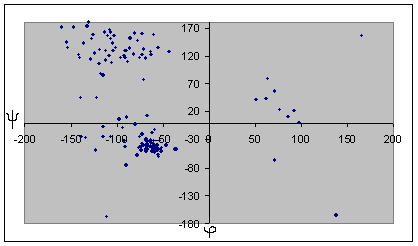
| Альфа-спираль | Бета-структура |
Для глицина характерен большой разброс значений торсионных углов, что может быть обьясненено его небольшими размерами и простым радикалом. Наиболее вероятно, что торсионные углы глицина определяются соседними аминокистотами. Для альфа-спирали и бета-листа заметно, что все углы имеют сходные значения, и из общей группы выделяются только концевые аминокислоты. По-этому мы отбрасываем эти значения при подсчете средних, наибольших и наименьших углов. Для бета-листа, в отличие от альфа-спирали, эти отличия не такие сильные, можно отбросить только один угол, но расчеты осложняются тем, что среди углов есть как положительные, так и отрицательные, по-этомы мы сначала прибавляем к отрицательным по 360 градусов, а затем выясняем истинный знак полученного угла. В целом, в белке большинство аминокислотных остатков, имеют отрицательный угол фи. Положительный этот угол в основном у глицина, как у аминокислотного остатка без боковой группы. Для альфа-спирали и бета-листа также можно отметить, что характерные углы альфа-спирали лежат в III четверти координатной плоскости, ближе к началу координат, и собраны очень плотоно. Торсионные углы бета-листа лежат в IV четверти и для них характерен больший разброс значений