Выбор белка
При поиске по запросу "Citrobacter freundii" получается чуть меньше 200000 результатов. Для удобства дальнейшей работы с белком отберём те, у которых оценка аннотации 5/5. Здесь выбор сокращается всего до 79 вариантов. Из них выбрали дигидроксиацетон-киназу по принципу наилучшего понимания функций белка. К тому же эта запись из курируемой базы данных (Swiss-Prot).
Информация о белке
AC:P45510
Название: Dihydroxyacetone kinase
Длина белка: 552
Ген: dhaK
Функция: катализирует фосфорилирование дигидроксиацетона
Кофакторы: Mg2+ или Ca2+ координируют фосфатные группы
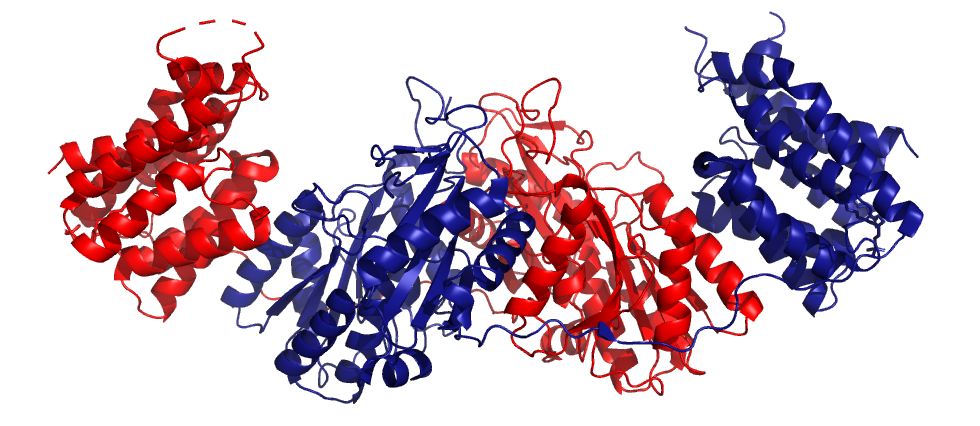
Структура: состоит из 2 идентичных цепей. С-концевой домен представлен восьмиспиральным α-бочонком, который образует карман с плотно связанным фосфолипидом. N-концевой домен состоит из 2 α/β-складок (β-лист, окруженный шестью или тремя спиралями). Два домена разделены линкером (остатки 331-349). Они чередуются так, что С-концевой домен одной субъединицы связывается с N-концевым доменом второй.

Расширенный поиск
Посмотрим, как часто встречается белок с такими функциями по запросу (ec:2.7.1.29). 6053 результата. Можно заметить, что белки с данной функцией встречаются как в прокариотических организмах, так и в эукариотических, что не удивительно, ведь белок катализирует достаточно распространённую реакцию. По запросу (ec:2.7.1.29) AND (taxonomy_name:Bacteria) получим 1215 результатов, это показывает, что функционально более распространён среди эукариот.
По запросу (gene:dhaK) AND (taxonomy_name:Bacteria) мы видим, что существует много вариаций гена, кодирующего данный белок (5492 результата). Но хорошо аннотированы из них только 5. По ним мы видим, что ген может кодировать субъединицы данного белка в группе с другими генами.
По запросу (keyword:KW-0418) AND (taxonomy_id:544) AND (keyword:KW-0319) посмотрим, какие еще варианты киназ катализируют данную реакцию у представителей рода Citrobacter. Получаем ещё один белок, отличающийся по своей структуре от исходного.
Источники