Практикум 4: поиск взаимодействий между аминокислотными остатками
В данном практикуме была продолжена работа со структурой белка триптофанил-тРНК-синтетазы, выделенного из бактерии Geobacillus stearothermophilus. Задачей практикума стал поиск в данном белке следующих типов контактов между аминокислотными остатками: водородных связей, солевых мостиков, дисульфидных связей и стекинговых взаимодействий.
Были найдены следующие типы взаимодействий:
а. Водородные связи между атомами главной цепи, участвующие в формировании вторичной структуры белка - альфа-спиралей и бета-листов. Данный тип водородных связей формируется между атомом водорода в NH-группах и между атомом кислорода в CO-группе аминокислотных остатков главной цепи. Пример таких взаимодействий приведен на рисунке ниже:
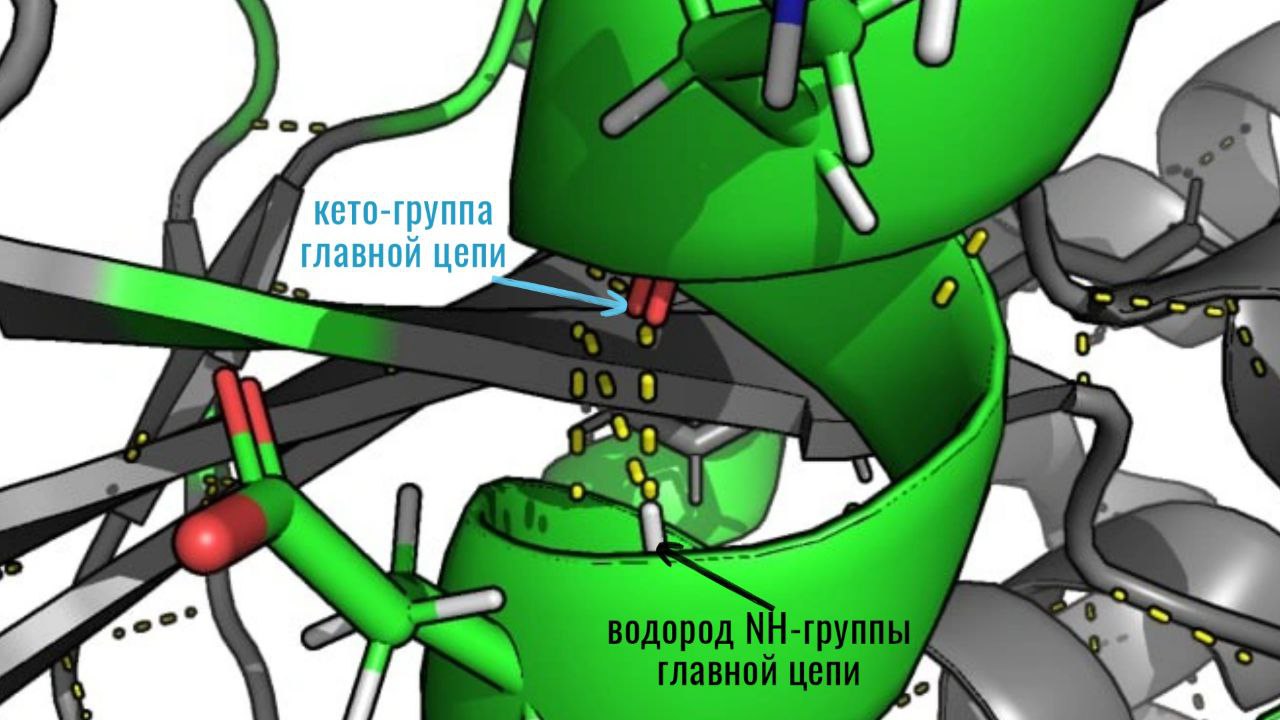
б. Водородные связи между атомами в боковых радикалах. Такие связи формируются между атомами водорода и азота, а также между атомами водорода и кислорода. На рисунке ниже приведен пример таких взаимодействий:
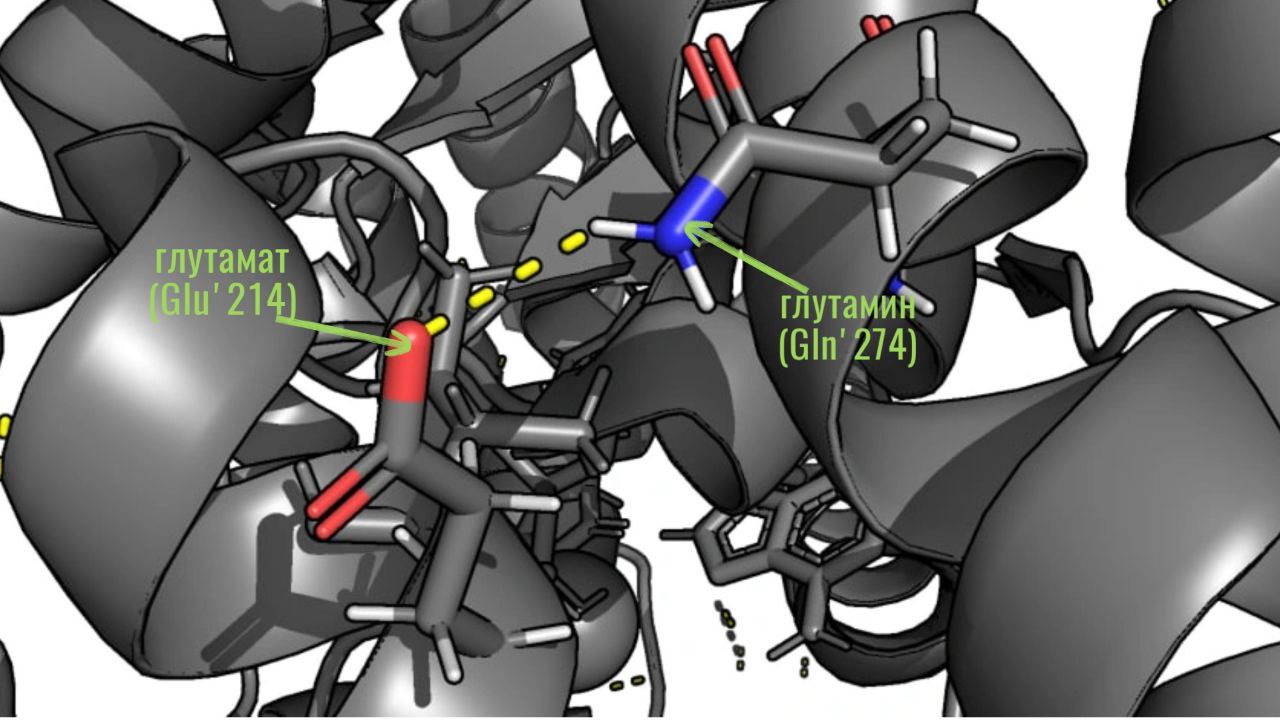
в. Дисульфидные мостики в исследуемом белке найдены не были. На рисунке ниже показаны все цистеины белка и видно, что дисульфидных мостиков между ними не формируется.
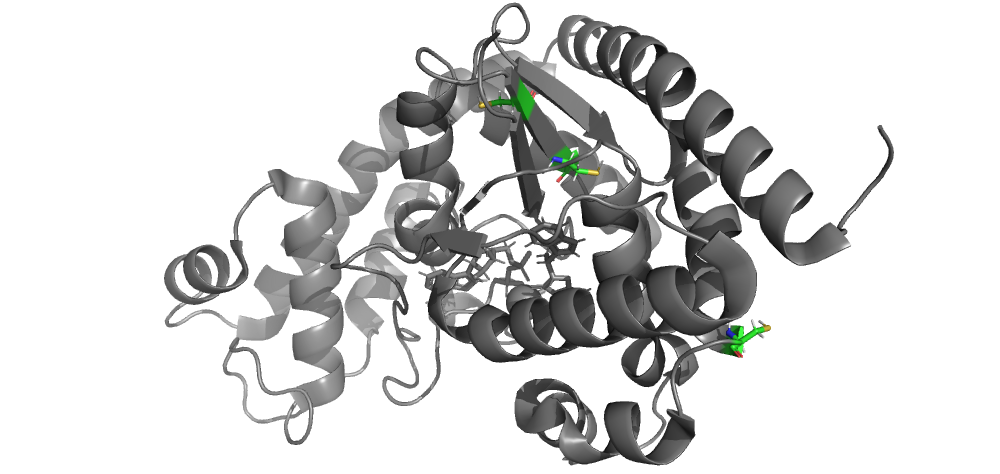
г. Солевые мостики: формируются между боковыми радикалами положительно заряженных аминокислот (аспартата и глутамата) и отрицательно заряженных аминокислот (лизина, аргинина, гистидина). На рисунке ниже приведен пример таких взаимодействий в исследуемом белке:

д. Стекинг - тип взаимодействий между радикалами ароматических аминокислот (фенилаланина, тирозина, триптофана). На рисунке ниже приведен пример таких взаимодействий в исследуемом белке:

Использованные ресурсы:
Страница данного белка в Protein Data Bank