Практикум 5: изучаемый белок как фермент
В данном практикуме была продолжена работа со структурой белка триптофанил-тРНК-синтетазы, выделенного из бактерии Geobacillus stearothermophilus. Задачей практикума стало изучение различных аспектов ферментативной активности белка.
Согласно данным базы PDB, белок имеет следующий EC номер: 6.1.1.2. По данным базы EXPAZY (см. ссылки в разделе "Использованные ресурсы" внизу страницы), белок катализирует реакцию присоединения аминокислоты L-триптофана к тРНК с затратой энергии АТФ:
ATP + L-tryptophan + tRNA(Trp) <=> AMP + diphosphate + H(+) + L-tryptophanyl-tRNA(Trp)
При рассмотрении подробной аннотации последовательности в базе PDB было выявлено, что активный центр для данного фермента не размечен. Поэтому для детального рассмотрения был взят сайт связывания (binding site). В состав сайта связывания входят следующие аминокислотные остатки: 10 (глутамин), 11 (пролин), 12 (серин), 18 (глицин), 19 (аспарагин), 145 (глицин), 146 (глутамат), 147 (аспартат), 184 (изолейцин), 193 (лизин) и 194 (селенометионин).
Изображение сайта связывания, полученное с помощью Pymol, показано на рисунке 1 ниже. Водородных связей между боковыми радикалами, стекинговых взаимодействий и дисульфидных связей в структуре сайта связывания обнаружено не было, но был найден солевой мостик между остатками 146 (аспартат) и 192 (лизин).

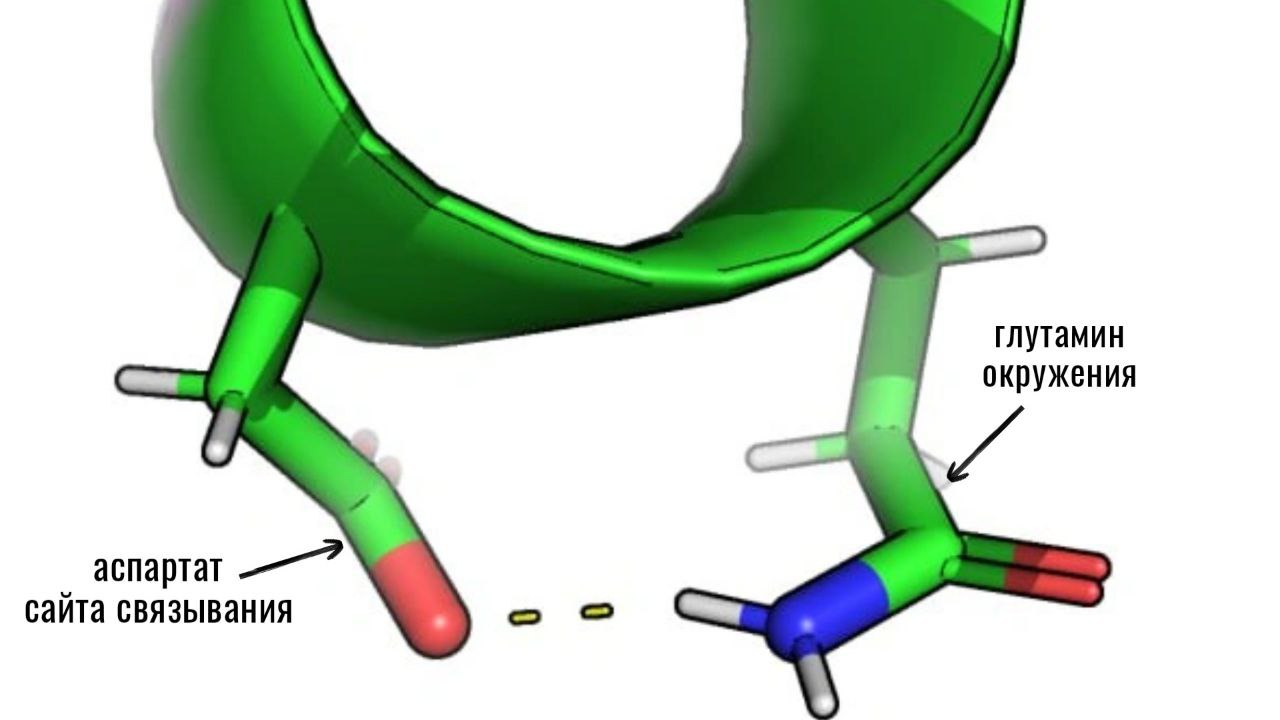
Далее с помощью Pymol были рассмотрены взаимодействия аминокислотных остатков сайта связывания с их окружением (остатками на расстоянии до 5 ангстрем). Было найдено несколько водородных связей, в том числе связь между аспартатом сайта связывания и глутамином окружения, показанная на Рисунке 2.
В анализируемой структуре с ферментом связан ингибитор индолмицин, блокирующий каталитическую активность фермента. Связывание ингибитора происходит на расстоянии 2,9 ангстрем от ближайшего аминокислотного остатка (указано кратчайшее расстояние, измеренное с помощью инструментов PyMol)
Использованные ресурсы:
Страница данного белка в Protein Data Bank
Страница данного фермента в базе EXPAZY