DSSP, вторичная структура белка
Для работы был взят файл PDB с ID 1I78 (1i78.pdb).Данный файл был подан на вход программе DSSP, в результате чего получен выходной файл 1i78.dssp, который был импортирован в Excel (1i78.dssp.xls).
PDB-файл содержит информацию о двух полипептидных цепях A и B.
Они идентичны по первичной структуре, но имеют немного разную
вторичную стуктуру структуру, которая
по выдаче файла DSSP содержит лишь бета-тяжи (обозначено буквой E).
Участки бета-тяжей представлены в таблице:
| A | ||
| №№ | Начало | Конец |
|---|---|---|
| 1 | 12 | 31 |
| 2 | 37 | 58 |
| 3 | 64 | 73 |
| 4 | 77 | 85 |
| 5 | 97 | 122 |
| 6 | 126 | 144 |
| 7 | 147 | 149 |
| 8 | 169 | 189 |
| 9 | 192 | 213 |
| 10 | 219 | 242 |
| 11 | 245 | 267 |
| 12 | 272 | 296 |
| B | ||
| №№ | Начало | Конец |
|---|---|---|
| 1 | 12 | 31 |
| 2 | 37 | 59 |
| 3 | 64 | 73 |
| 4 | 77 | 85 |
| 5 | 97 | 100 |
| 6 | 104 | 123 |
| 7 | 126 | 143 |
| 8 | 147 | 150 |
| 9 | 159 | 162 |
| 10 | 170 | 189 |
| 11 | 192 | 212 |
| 12 | 219 | 240 |
| 13 | 245 | 267 |
| 14 | 272 | 296 |
При сравнении с вторичной структурой, указанной в PDB-файле, были
обнаружены небольшие отличия (с разницей в 1 аминокислотный остаток),
такие позиции подчёркнуты в таблице.
Кроме того, есть крупное отличие. В PDB-файле указаны две альфа-спирали
на цепи B, содержащие остатки 32-35 и 214-218.
Угол φ, изображение
В таблице по цепям показаны остатки, имеющие положительный угол φ.
| A | ||
| Номер остатка | Тип остатка | Угол φ |
|---|---|---|
| 19 | G | 170,60 |
| 34 | E | 168,40 |
| 35 | G | 78,00 |
| 36 | G | 79,30 |
| 48 | N | 39,60 |
| 75 | G | 103,60 |
| 93 | G | 146,60 |
| 145 | G | 47,00 |
| 146 | G | 86,40 |
| 157 | R | 48,90 |
| 166 | G | 101,70 |
| 185 | G | 177,30 |
| 190 | E | 65,70 |
| 214 | D | 168,80 |
| 227 | D | 54,10 |
| 271 | N | 51,90 |
| 278 | N | 60,30 |
| B | ||
| Номер остатка | Тип остатка | Угол φ |
|---|---|---|
| 19 | G | 179,90 |
| 35 | G | 73,00 |
| 36 | G | 62,70 |
| 48 | N | 45,10 |
| 70 | G | 175,30 |
| 75 | G | 163,60 |
| 93 | G | 103,90 |
| 145 | G | 47,80 |
| 146 | G | 101,00 |
| 157 | R | 48,80 |
| 161 | G | 173,80 |
| 166 | G | 91,20 |
| 168 | R | 43,50 |
| 190 | E | 70,90 |
| 217 | G | 153,70 |
| 227 | D | 41,70 |
| 271 | N | 14,60 |
| 278 | N | 52,20 |
Интересно заметить, что некоторые остатки с положительным углом φ входят в бета-тяжи (например, остаток 185 цепи А). Как известно, такие значения угола не свойственны остаткам бета-тяжей. Одним из объяснений этого факта может быть то, что алгоритм DSSP не учитывает торсионные углы при определении вторичной структуры белка.
Изображение цепи А белка в остовной модели (создано в PyMOL):
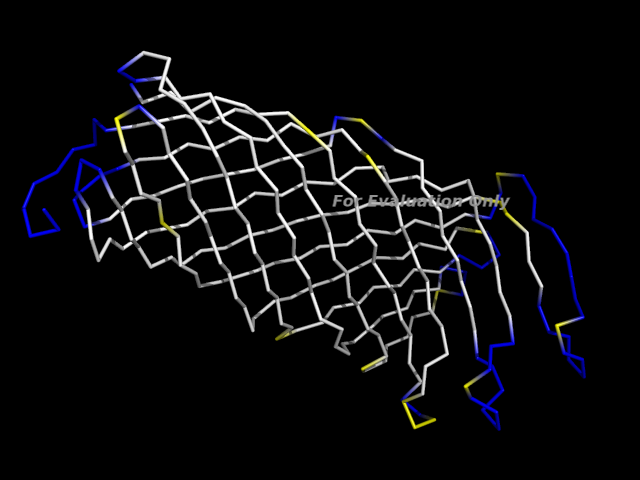
| Бета-тяжи | Остатки с углом φ > 0 | ||
| Остальные | |||
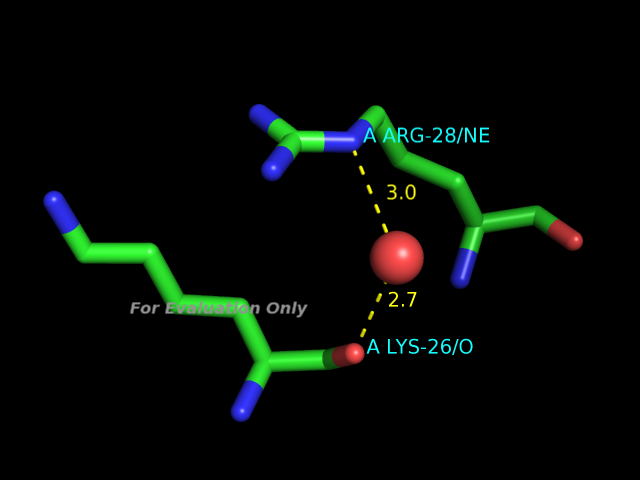
HBPlus, водородные связи
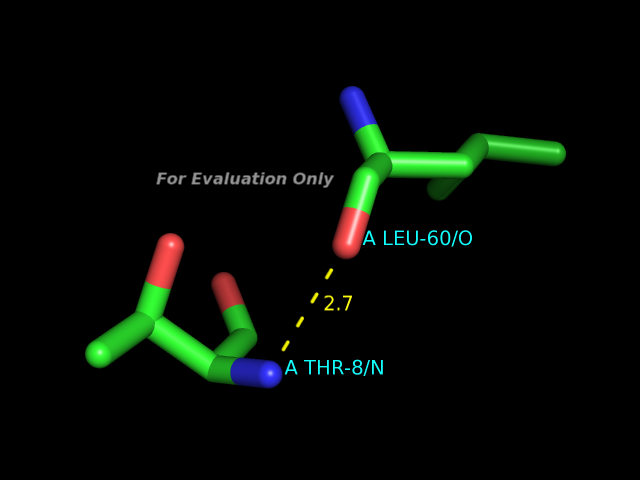
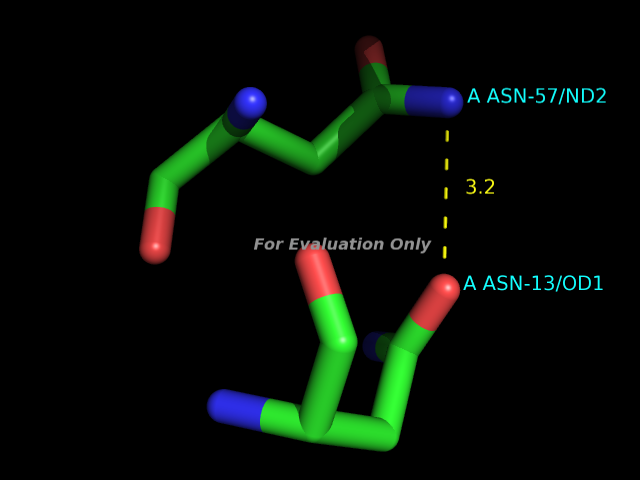
С помощью программы HBPlus были определены водородные связи в данной записи PDB. В программе PyMOL были получены изображения следующих примеров водородных связей:- участвующие в стабилизации вторичной структуры
- между боковыми цепями аминокислотных остатков
- между боковой цепью одного остатка и остовным атомом другого
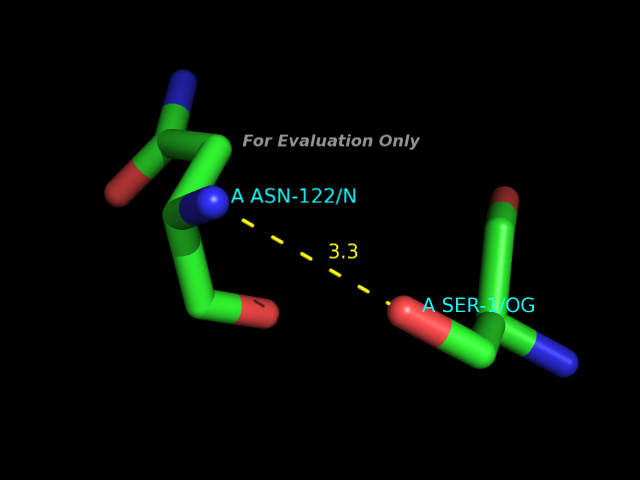
- между белком и каким-либо лигандом (малой органической молекулой)
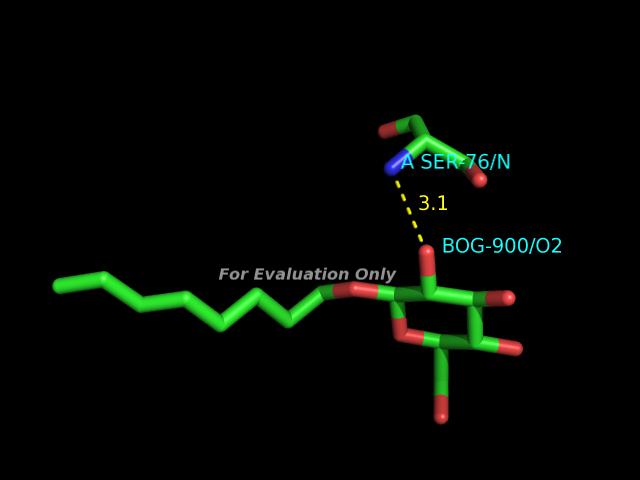
- участвующие в образование водяного мостика