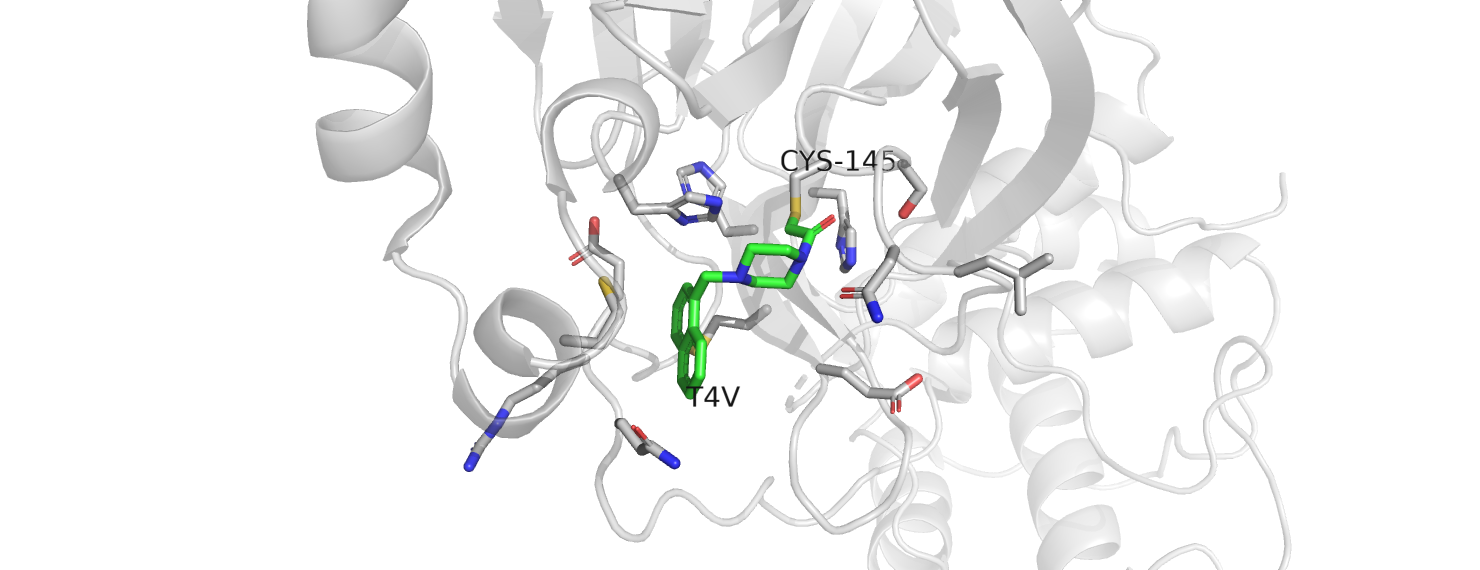
Структура с pdb id 5REX получена в ходе работы консорциума PanDDA над способами связывания низкомолекулярных фрагментов с главной протеазой коронавируса Sars-COV-2. Эта информация позволяет исследователям "собирать" из отдельных хорошо связавшихся фрагментов перспективные ингибиторы. В данном случае, протеаза коронавируса связывается с лигандом, имеющим короткое название T4V.
Рассмотрим фрагмент структуры, с которым контактирует данный лиганд. Для этого выделим все остатки, находящиеся от него на расстоянии не более 5 Å.

Лиганд ковалентно связан с цистеином 145. Все остальные остатки слишком далеко и неподходяще расположены для того, чтобы объяснять их положение наличием вазимодействия с лигандом. Впрочем, возможно, есть небольшое электростатическое взаимодействие с глутаминовой кислотой за счёт второго азота.
Два PDB ID 6L27 и 5B61 соответствуют двум кристаллографическим расшифровкам одного и того же белка (GFP). На глаз видно, что структуры имеют несколько отличий. Во-первых, в 5B61 представлена не одна молекула белка, а сразу шесть. Во-вторых, в 6L27, помимо атомов белка, попадают ещё атомы воды. В-третьих, если отображать структуры в виде палочек, в 6L27 видны водороды, так что в данном случае очевидно, что 6L27 имеет лучшее разрешение. Действительно, в pdb для 5B61 указано разрешение 3.12 Å, в то время как для 6L27 - 0.77 Å.
Скачав 2fofc файлы, получаем для каждой структуры карты электронной плотности (ЭП). Для демонстрации различий я выбрала участок FKTRAEVKF (106-114). При помощи следующих команд получаем карту электронной плотности для рассматриваемого фрагмента
isomesh mesh1_1, 5b61_2fofc, 1.8, site1, carve=2.2
isomesh mesh2_1, 6l27_2fofc, 1.8, site2, carve=2.2
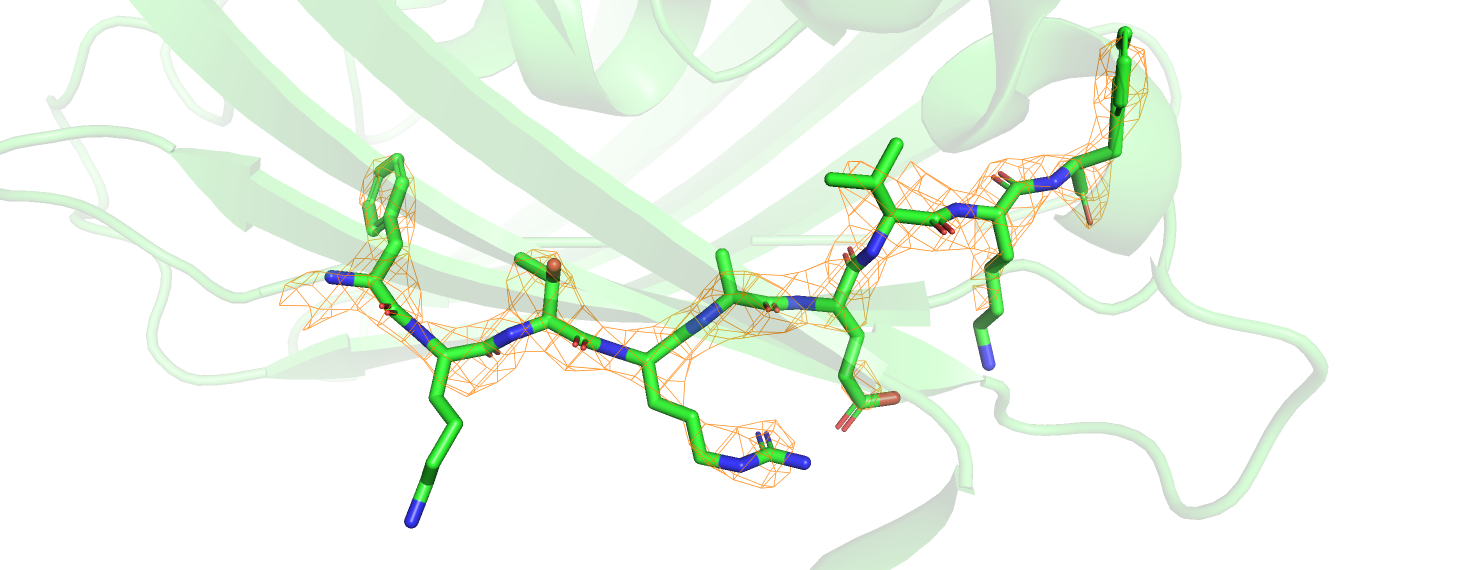
В 6L27 выделенная последовательность отличается на одну аминокислоту: вместо первого фенилаланина стоит тирозин (на рисунке не показан). Для структуры 6L27 видна электронная плотность отдельных атомов, в то время как для 5B61 ЭП выглядит как облако. В структуре 5B61 плохо покрыты боковые группы: особенно длинные и неароматические. Лизины 107 и 113, например, вообще почти не покрыты, и это не меняется при уменьшении уровня подрезки. В глутаминовой кислоте и аргинине есть электронная плотность на кислороде и азоте боковых групп, углеродная часть также покрыта плохо. В 6L27 лизин 107 сильно изменил своё положение по сравнению с тем же лизином на предыдущей структуре. Лизин 113 имеет неопределённое положение: его длинный хвост болтается в пространстве. В целом, заметно, что хуже всего разрешаются нестабильные в плане своей геометрии части структуры: длинные углеродные фрагменты подвижны, поэтому, видимо, при получении структур сигнал от них чересчур зашумлён, и точно определить их положение весьма трудно.
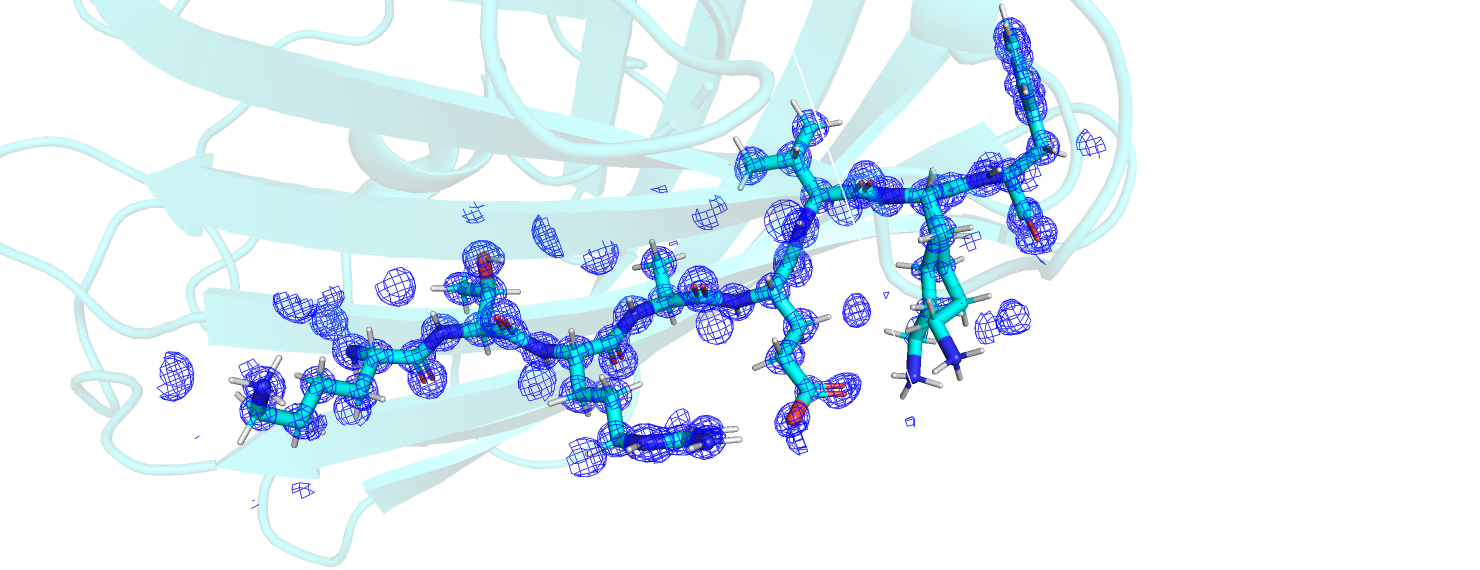
Снова рассмотрим PDB из задания 1. Выделяем остов белка и строим mesh на уровнях подрезки 1, 2, 3. Уровень подрезки отвечает одному и тому же значению нормированной электронной плотности. Используем команды:
isomesh mesh[1,2,3], 5REX_2fofc, [1,2,3], 5REX and chain A, carve=2



При переходе от уровня подрезки 1 к 2, в первую очередь, перестают покрываться неструктурированные области (это особенно хорошо заметно, если включить изображение cartoon): из приведённых иллюстраций видно, что на уровне 2 совсем не покрывается C-конец. Вероятно, это связано с тем, что такие структуры имеют неустойчивое положение в пространстве. Это похоже на то, что мы наблюдаем в задании 2. При переходе от уровня подрезки 2 к 3 электронная плотность распадается на множество небольших облаков электронной плотности, а кроме того имеется несколько областей, где электронная плотность всё ещё остаётся на достаточно протяжённых участках белка. Эти участки более густо окрашены на рисунках для более низких уровней подрезки. Это структурированные участки, которые, по-видимому, находятся в глубине белка.
Строим электронную плотность вокруг лиганда из задания 1, тоже на уровнях подрезки 1, 2, 3. Используем команды:
isomesh mesh_ligand_[1,2,3], 5REX_2fofc, [1,2,3], ligand, carve=2
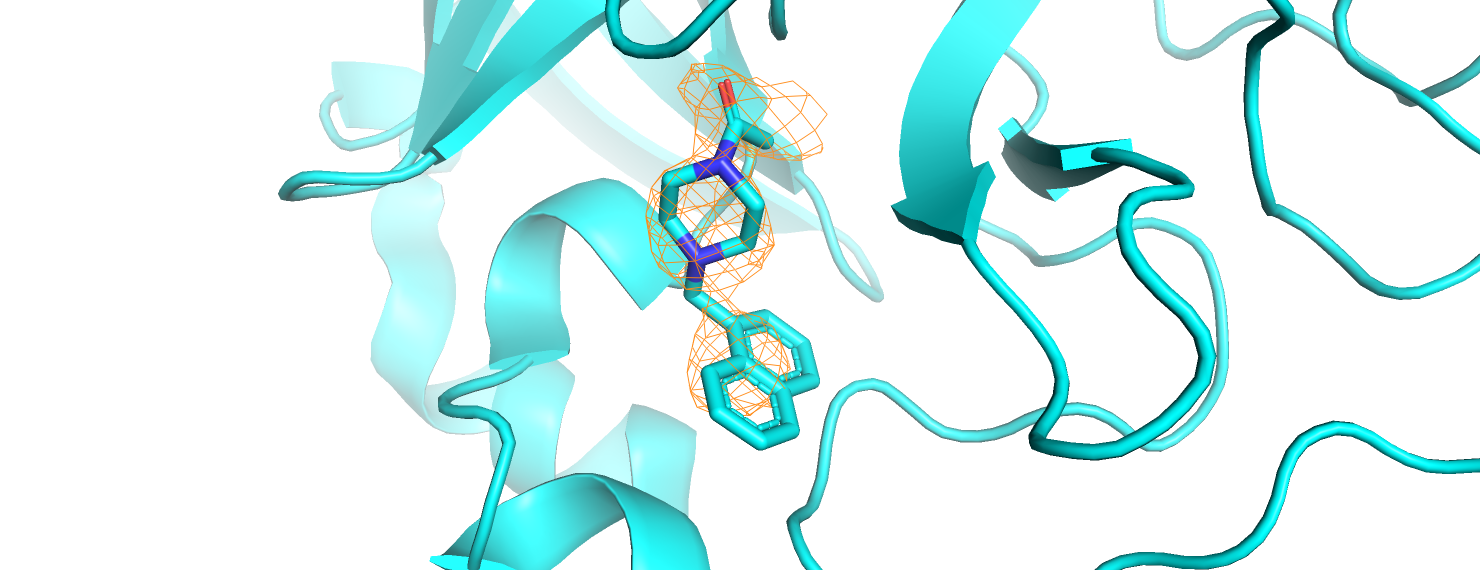
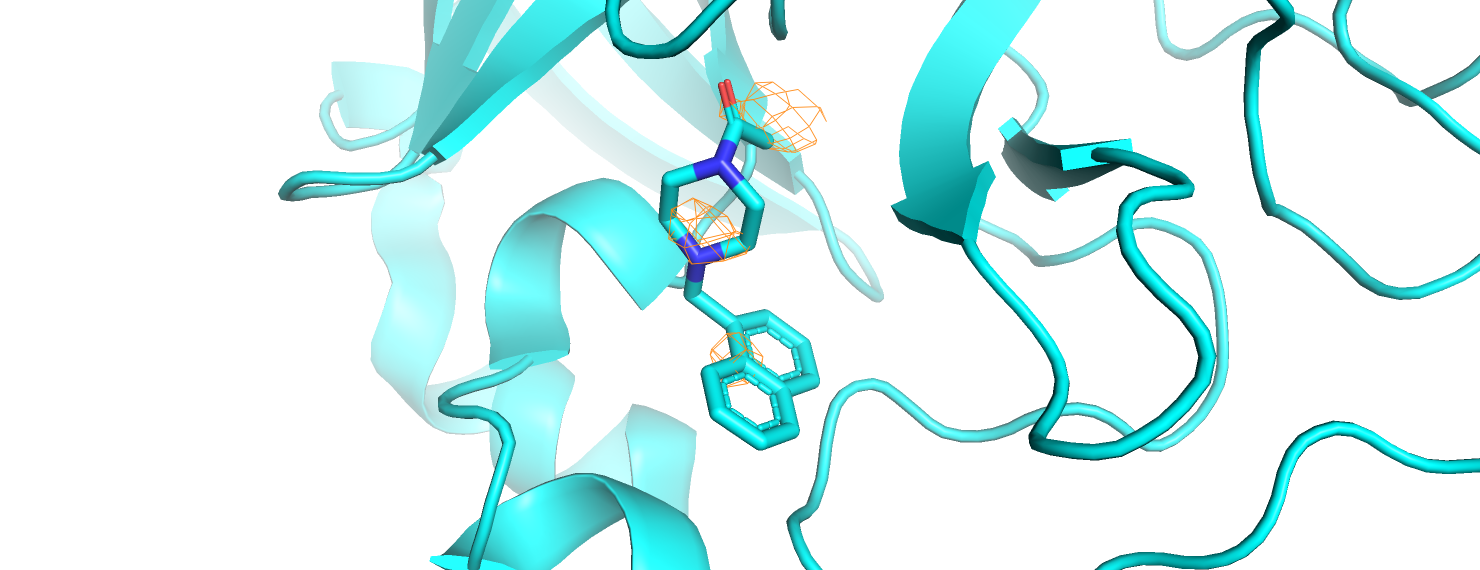
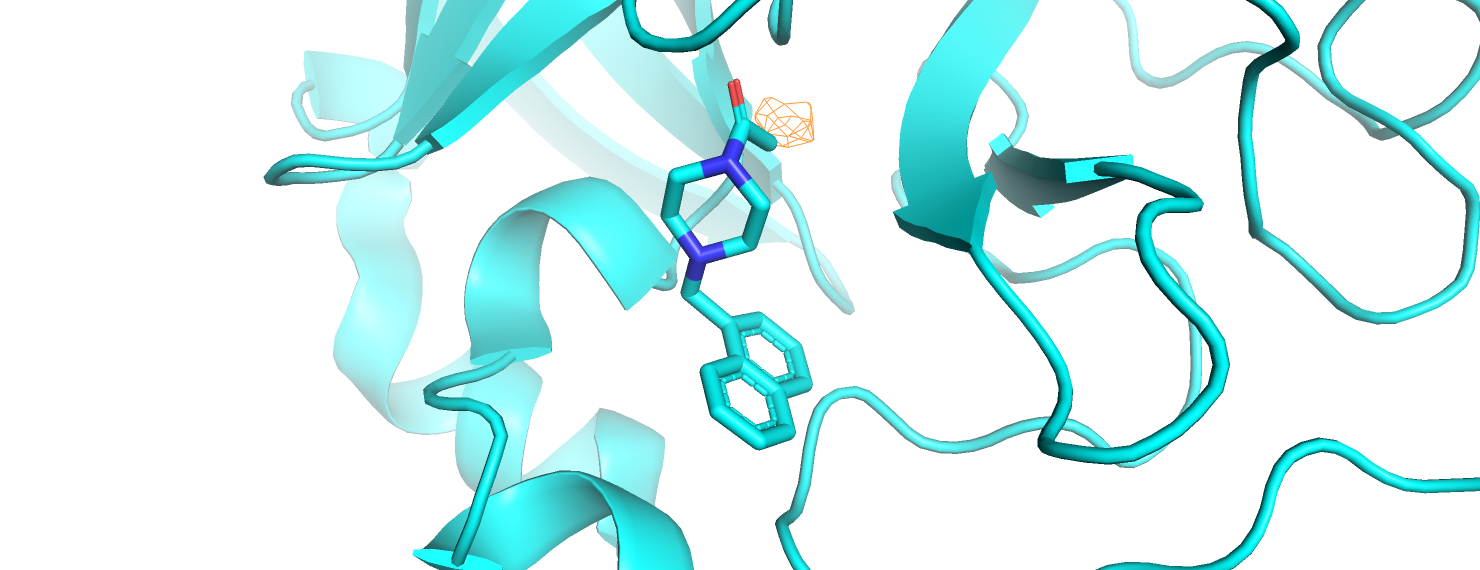
Сразу отметим, что на уровне подрезки 3 электронная плотность остаётся только в месте связывания с белком. Это снова можно объяснить меньшей подвижностью атомов, образующих данную связь.Тем более, связь образуется с большой малоподвижной серой цистеина. На уровне подрезки 2 видим электронную плотность вокруг азота, а также вокруг центрального углерода ароматической системы из двух колец (нафталин). Электронная плотность "нафталина" на уровне подрезки 1 смещена к азоту. Вероятно, это объясняется наличием положительного заряда, если азот протонирован. Таким образом, рисунок для уровня подрезки 1 объясняет таковой для уровня подрезки 2: мы видим те области, где сосредоточена электронная плотность.
© Быкова Даша, 2020