Задание 1. Альтернативные положения
В структуре PDB 3CZF рассмотрим остатки Arg75 и Glu19 в цепи A. Каждый из этих остатков имеет по две альтернативные конформации (это значит, что в одной части белковых молекул в кристалле они имели одно положение, в другой части - другое). Таким образом, теоретически возможны 4 сочетания положений Arg75 и Glu19. Рассмотрим каждое из них и попытаемся понять, какие из этих сочетаний возможны в реальности.
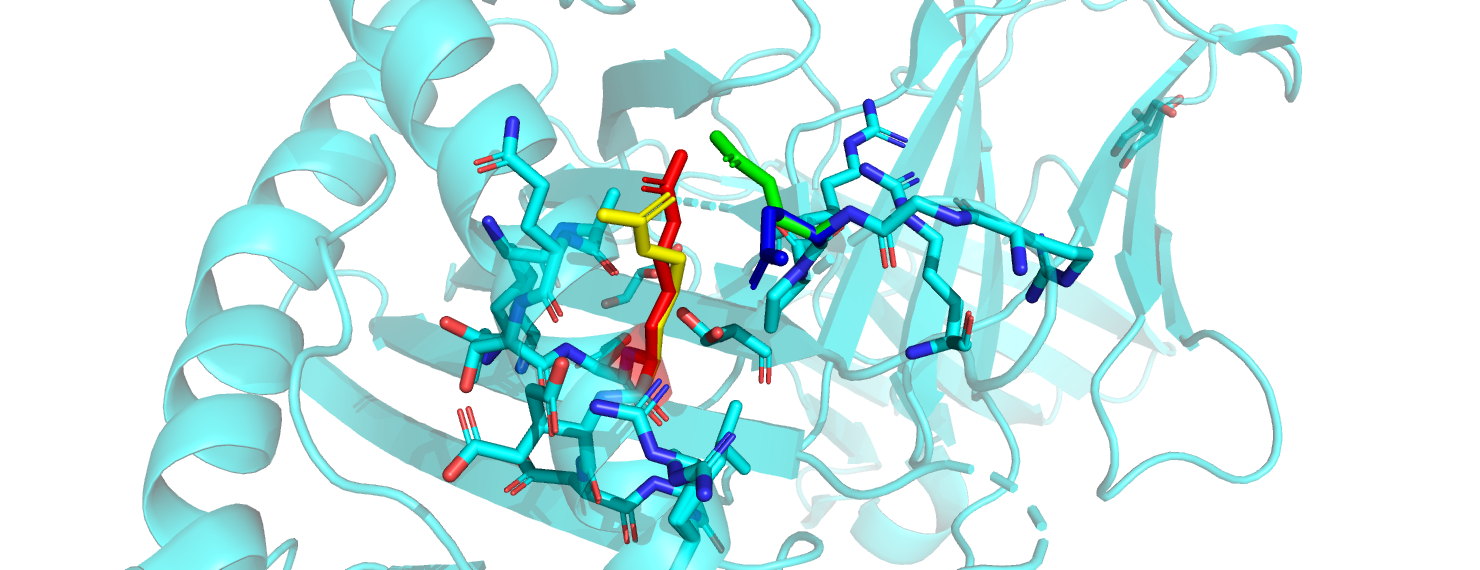
Arg и Glu образуют так называемые солевые мостики. Посмотрим, как устроена геометрия данного типа взаимодействий, и каким конформациям она соответствует. Из литературы (статья Salt bridges: Geometrically specific, designable interactions) узнаём, что для таких взаимодействий характерно расстояние не более 4 Å между N и О. Кроме того, существуют предпочтения по взаимной ориентации данных групп - так называемые "end-on" и "side-on" ориентации, согласно той же статье. В таких ориентациях происходит образование двух водородных связей между двумя азотами аргинина и двумя кислородами глутамата.
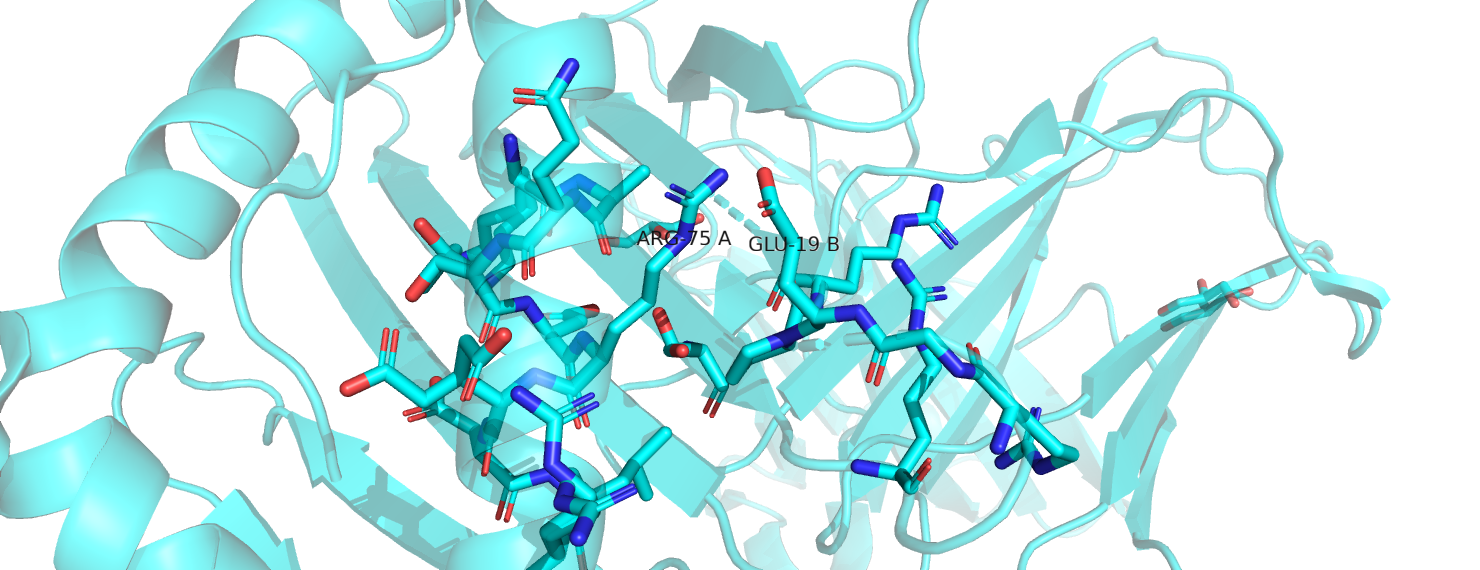
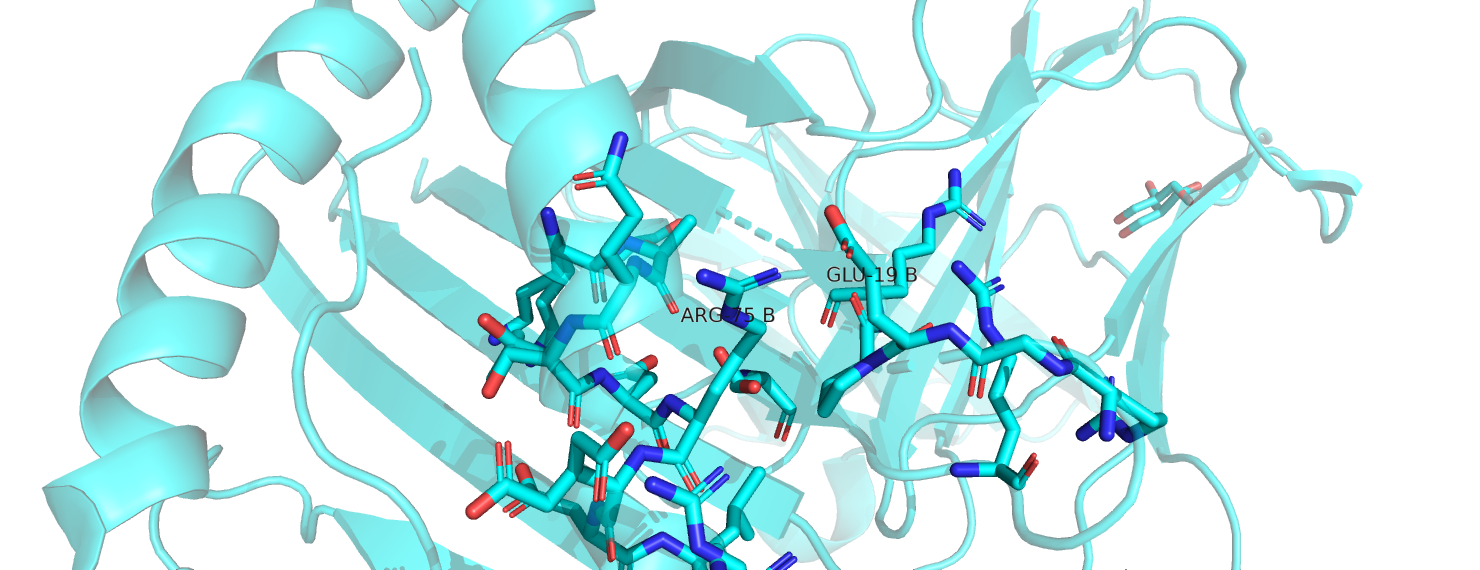
Вернёмся к нашим альтлокам. В сочетании Arg75A-Glu19B расстояния между концевыми азотами аргинина и кислородами глутамата составляют 1.4 и 3 Å. 1.4 Å - слишком маленькое расстояние, на нём наблюдается перекрывание Ван-дер-Ваальсовых радиусов, в таком положении атомы будут отталкиваться друг от друга. Таким образом, это сочетание невозможно. Сочетание Arg75B-Glu19B возможно: между N аргинина и O глутамата - 2,3 Å, гуанидиновая группа аргинина лежит почти перпендикулярно плоскости карбоксильной группы глутамата, образуется одна водородная связь. Сочетание Arg75B-Glu19A также представляется мне возможным, хотя и менее удачным, чем предыдущее: расстояние между концевым N аргинина и ближайшим O глутамата равно 4 Å. Наконец, в сочетании Arg75A-Glu19A расстояние N-O уже слишком велико для образования солевого мостика (4.3 Å), однако принципиально не является невозможным. Стоит отметить, что электростатические взаимодействия в моём рассуждении вынесены за скобки, хотя понятие солевого мостика предполагает их наличие. Кроме того, область в радиусе 5 Å от рассматриваемых остатков вообще обогащена аргининами и глутаматами, но солевых мостиков с ними наши остатки не образуют, а кулоновские взаимодействия, как мне видится, будут мало зависеть от альтлоков.
Задание 2. B-фактор
В файле PDB есть дополнительны параметр - B-фактор. Выберем только остов белка и покрасим атомы по B-фактору при помощи команды
spectrum b, blue_white_red, backbone
Атомы с низким B-фактором будут покрашены синим, атомы с высоким – красным. полученное изображение приведено на рис. 3.
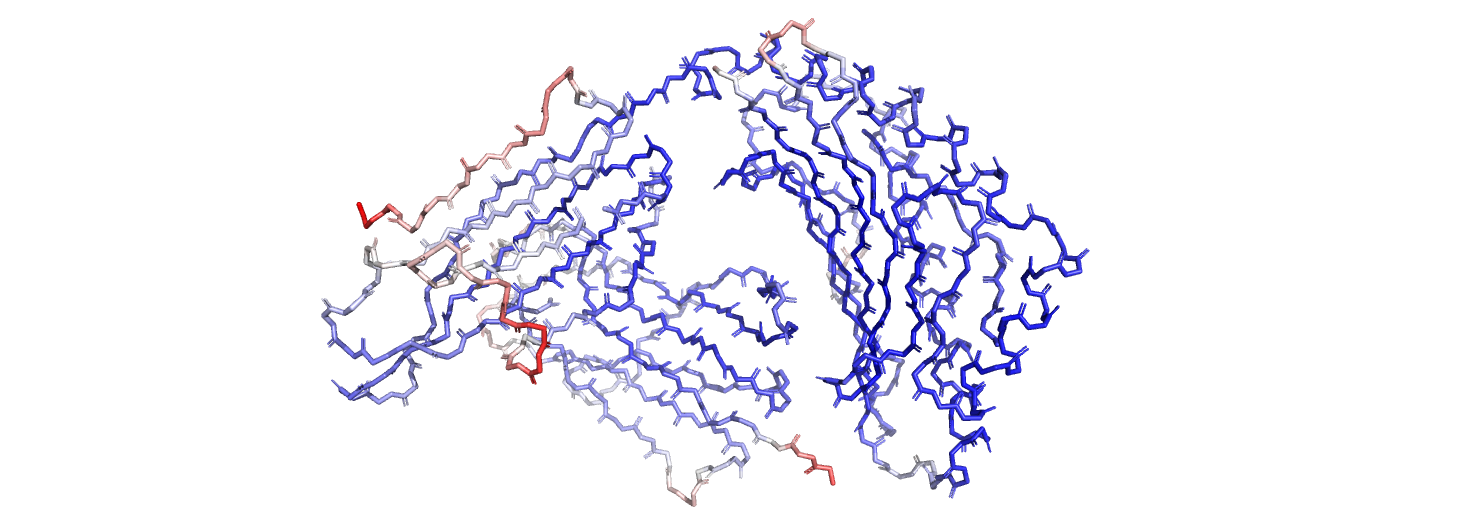
Величина B-фактора отражает подвижность участка. Как видно из рисунка, более высокий B фактор имеют N- и C-концы белка, а также петли, то есть неструктурированные, выступающие во внешнюю среду участки. Наблюдение вполне ожидаемое, так как очевидно, что такие петли будут более подвижны, чем внутренние участки белковой глобулы.
Для более детального рассмотрения выберем остаток GLN-226. Атомы бокового радикала данного остатка заметно краснеют к его окончанию, что говорит о том, что остаток торчит наружу относительно белковой глобулы.
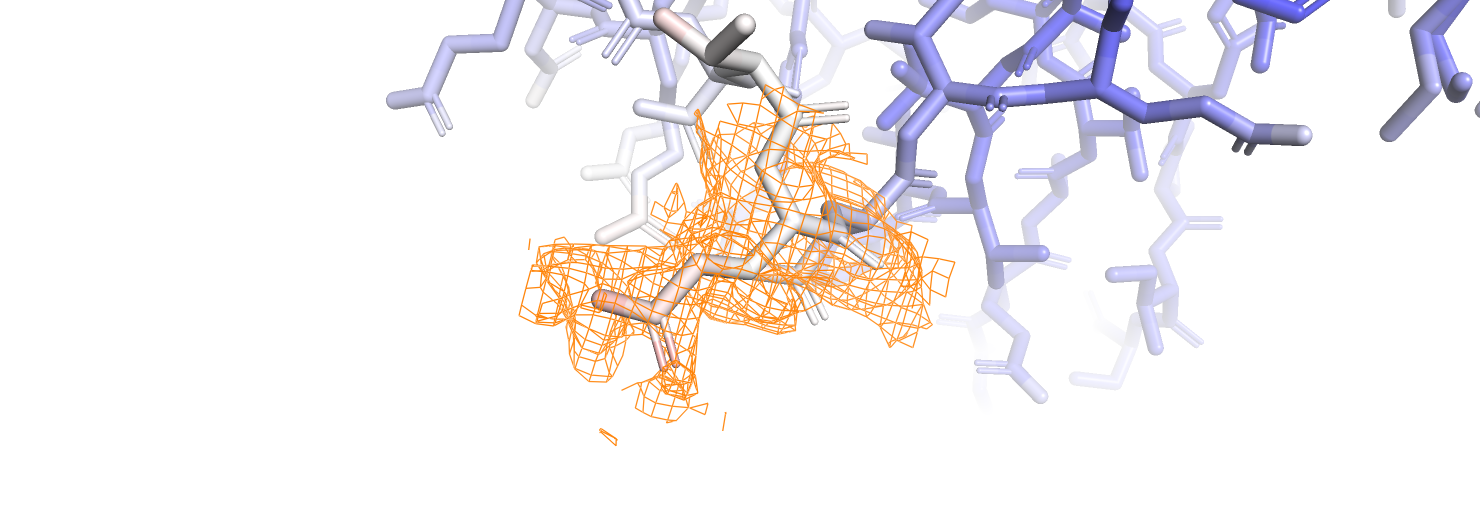
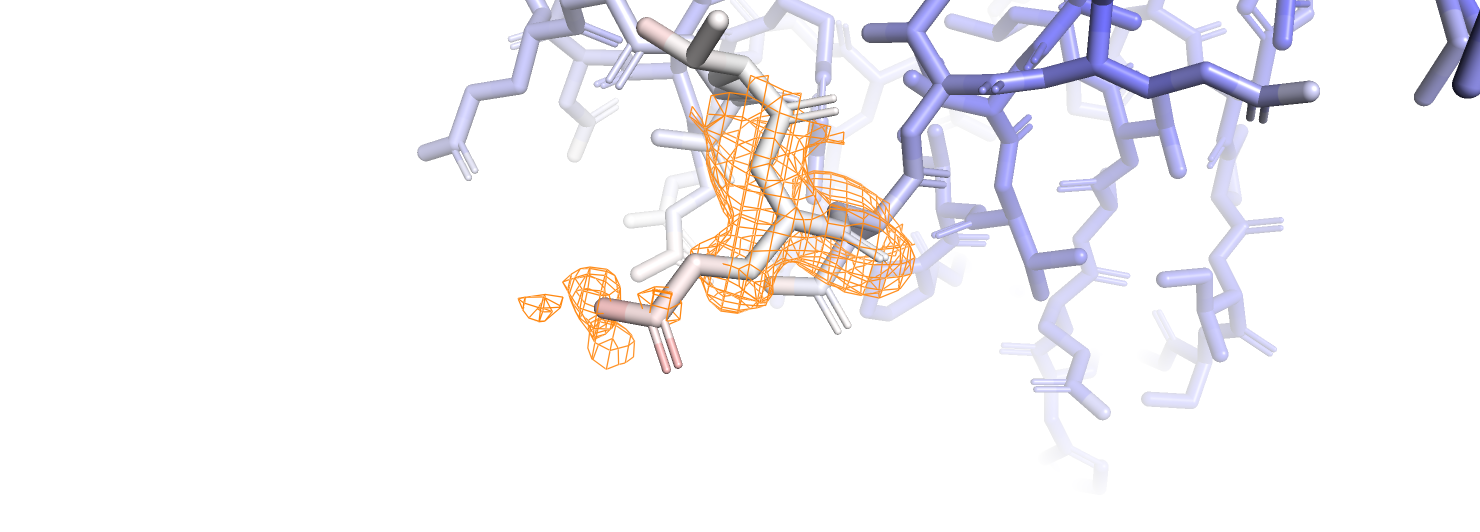
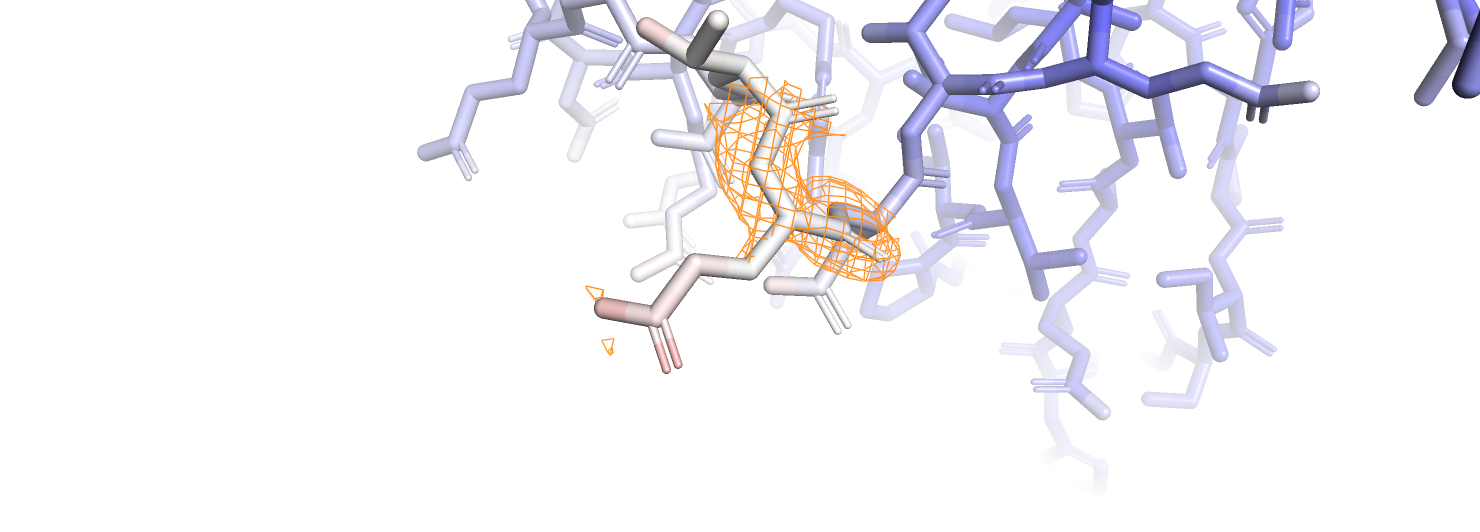
Как видно из рисунка, один из кислородов с высоким B-фактором покрывается электронной плотностью только при подрезке на уровне 0.1, что, конечно, слабо отличимо от шума. У азота радикала электронная плотность, хотя и немного смещённая, видна при уровне подрезки 0.5, в то время как у CG она не видна, хотя B-фактор, судя по окраске, у него меньше. Электронная плотность у атомов с более высоким B-фактором более размазанная, однако кроме высокого B-фактора, видимо, бывают и другие причины размазывания электронной плотности.
Задание 3. Соседи
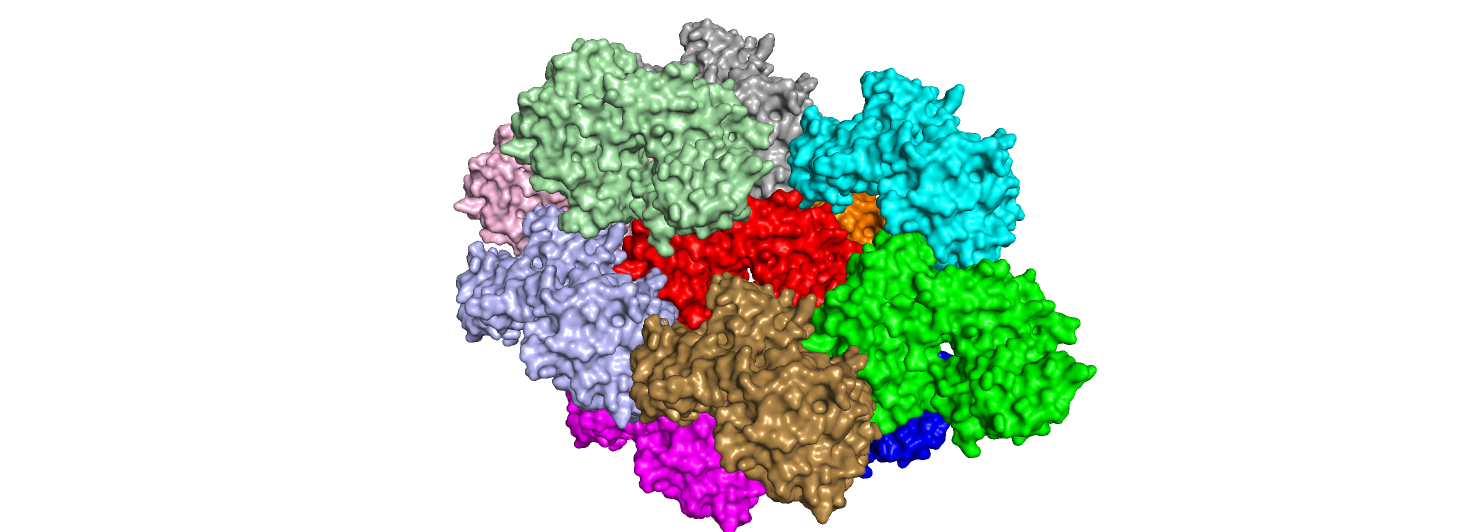
Белок, который мы видим, открывая запись PDB в Pymol, на самом деле является частью кристалла. Этот кристалл можно увидеть при помощи GUI
A > generate > symmetry mates > 20 Å,
где 20 Å - отсечка по расстоянию. На рис. 5 представлено полученное изображение.

Установив отсечку 5, выберем все молекулы, находящиеся на расстоянии не более 5 Å от исходной (имеющие хотя бы один атом на таком расстоянии от исходной). Считаем, что эти молекулы будут контактировать с исходной. Как видно из рис. 6, на котором молекулы белка отображаются в виде surface, контакт действительно наблюдается. Всего найдено 10 таких молекул.