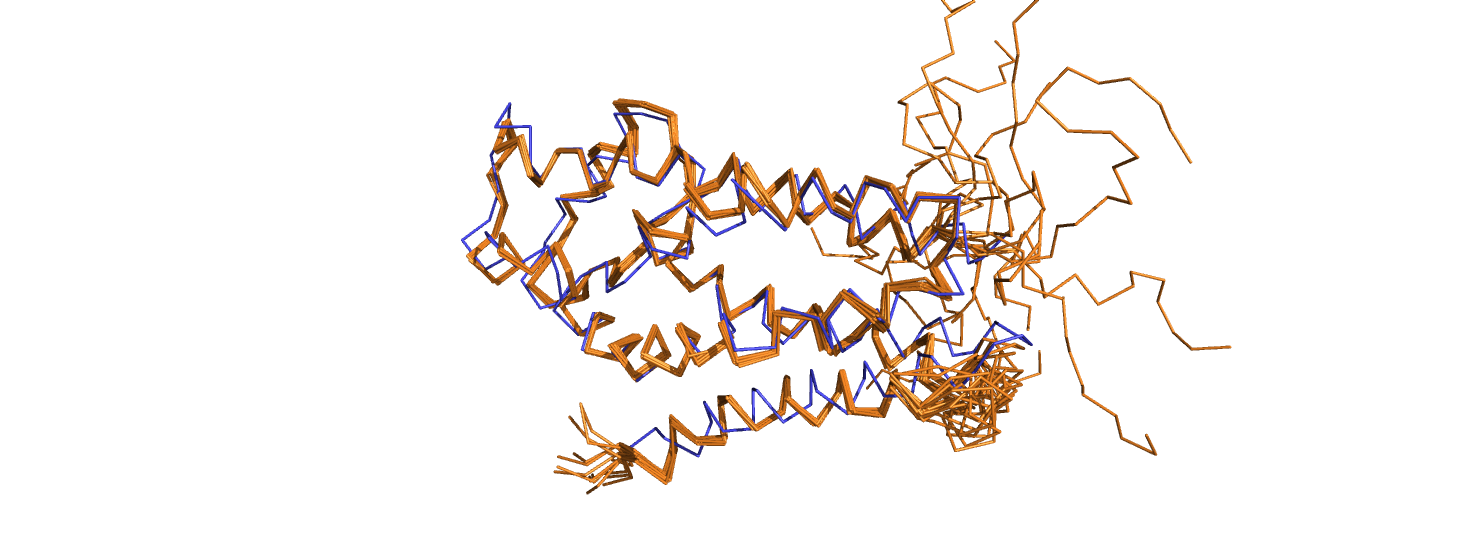
Белок, о котором пойдёт речь в этом практикуме, называется калирин (kalirin). Рассмотрим для него две структуры, полученные разными способами: 2KR9 (получена методом ЯМР) и 5O33 (РСА). Разрешение структуры РСА - 1.64 Å, число моделей ЯМР - 15. при помощи команды super 5O33, 2KR9 наложим структуру РСА на ЯМР и попытаемся их сравнить (рис. 1).

Модели ЯМР неплохо сходятся как между собой, так и с моделью РСА. Однако наблюдается несколько проблемных мест. Во-первых, это C- и N-концы белка, в особенности С-конец. В модели РСА 10 C-концевых остатков вообще не представлены. Модели ЯМР в этом месте настолько сильно расходятся между собой, что всё равно придётся исключить этот участок из рассмотрения. Далее, в восстановлении следующих альфа-спиралей различий практически нет. Но затем, перед последней альфа-спиралью наблюдается петля, и здесь мы наблюдаем плохую сходимость моделей ЯМР и их несоответствие РСА модели. Два варианта восстановления последней альфа-спирали идут как бы в противофазе: неопределённость в восстановлении петли в ЯМР повлекла этот небольшой сдвиг.
Итак, очевидно, ЯМР не справляется там, где есть подвижные, неструктурированные участки. Данный недостаток объяснятся тем, что результаты ЯМР-эксперимента получают для ансамбля молекул, находящихся в растворе. Кроме того, в неструктурированных участках меньше дополнительных геометрических ограничений, которые можно было бы использовать при восстановлении. Конечно, здесь стоит отметить, что метод РСА тоже может плохо восстанавливать подвижные участки, если они закристаллизуются в разных ячейках по-разному.
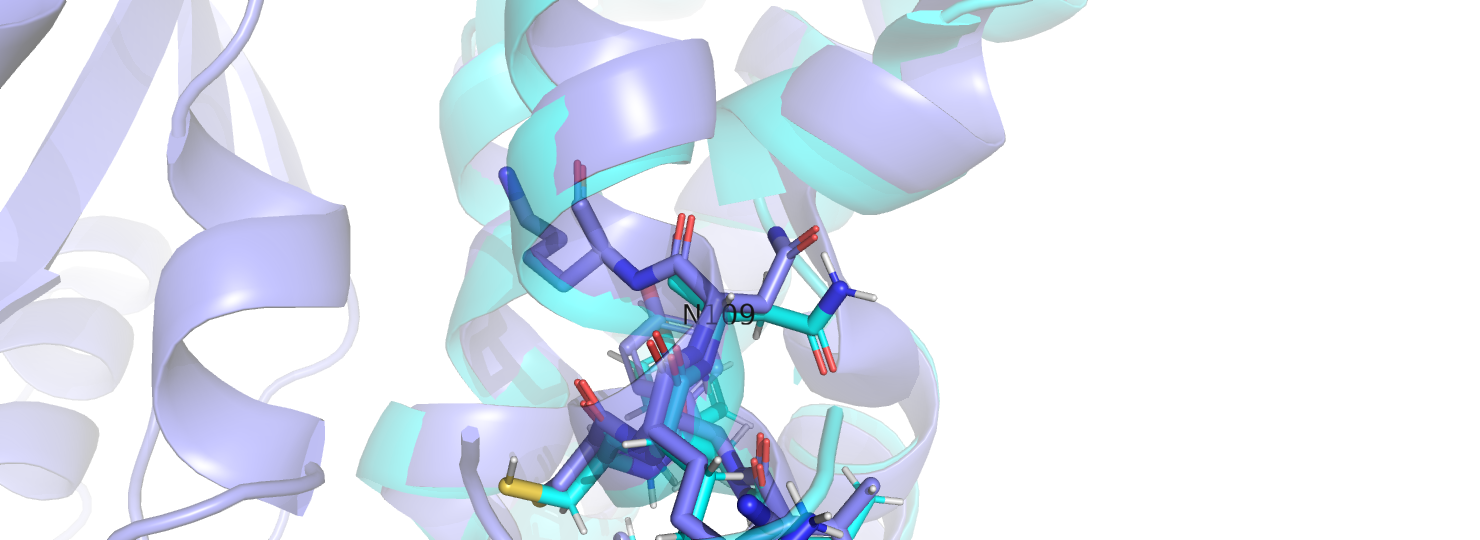
Что касается различий на микро-уровне, в ЯМР стуктуре отображаются водороды, так как сигнал в эксперименте дают именно они. Стоит ещё отметить, что хотя остовы в ЯМР моделях и модели РСА, по большей части, хорошо совпадают, положение боковых групп не совпадает практически никогда. В моделях ЯМР и моделях РСА боковые радикалы повёрнуты друг относительно друга (пример на рис. 2). При этом, в большинстве случаев это различие сохраняется для всех моделей ЯМР, а не является характерным для какой-то одной модели.
Root mean square fluctuation (RMSF) отражает подвижность участков белка. Если ансамбль моделей ЯМР в действительности представляет собой отражение эволюции системы во времени, по значениям RMSF атомов вычисляют значения B-факторов аналитически. Сравним B-факторы из структуры РСА и RMSF, и поймём, верно ли наше предположение о том, что неполнота данных ЯМР в данном случае объясняется именно подвижностью, а не шумом или ошибками эксперимента.
На рис. 3 приведён scatter-plot, где по оси Ox отложены величины RMSF остатков, а по оси Oy - средние B-факторы. Сразу можно отметить заметно бОльшие значения B-факторов по сравнению со структурой из предыдущего практикума (там максимальный средний B-фактор был 31.56). Кроме того, scatter-plot вообще выглядит достаточно странно, что заставило усомниться в полученных результатах, но проверка показала, что всё сделано правильно.
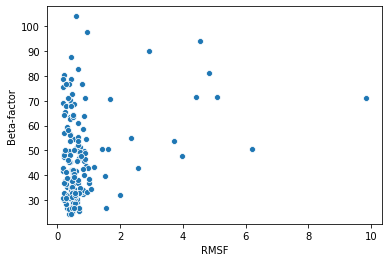
Заметно, что более высокие RMSF соответствуют более высоким B-факторам, однако у большинства остатков, вне зависимости от B-фактора, RMSF довольно низкий. При расчёте RMSF из структуры ЯМР были исключены первые 10 остатков, а в остальных частях молекулы, кроме одной петли, модели ЯМР хорошо сходятся между собой. Таким образом, относительно большие RMSF, по-видимому, как раз соответствуют остаткам из этой петли, а для остальных остатков отклонения незначительны.
Не очень понятно, почему остатки в модели РСА всюду имеют такие высокие средние B-факторы. Возможно, по каким-то экспериментальным причинам, авторы получили достаточно широкие облака электронной плотности и пытались таким образом подогнать модель под данные.
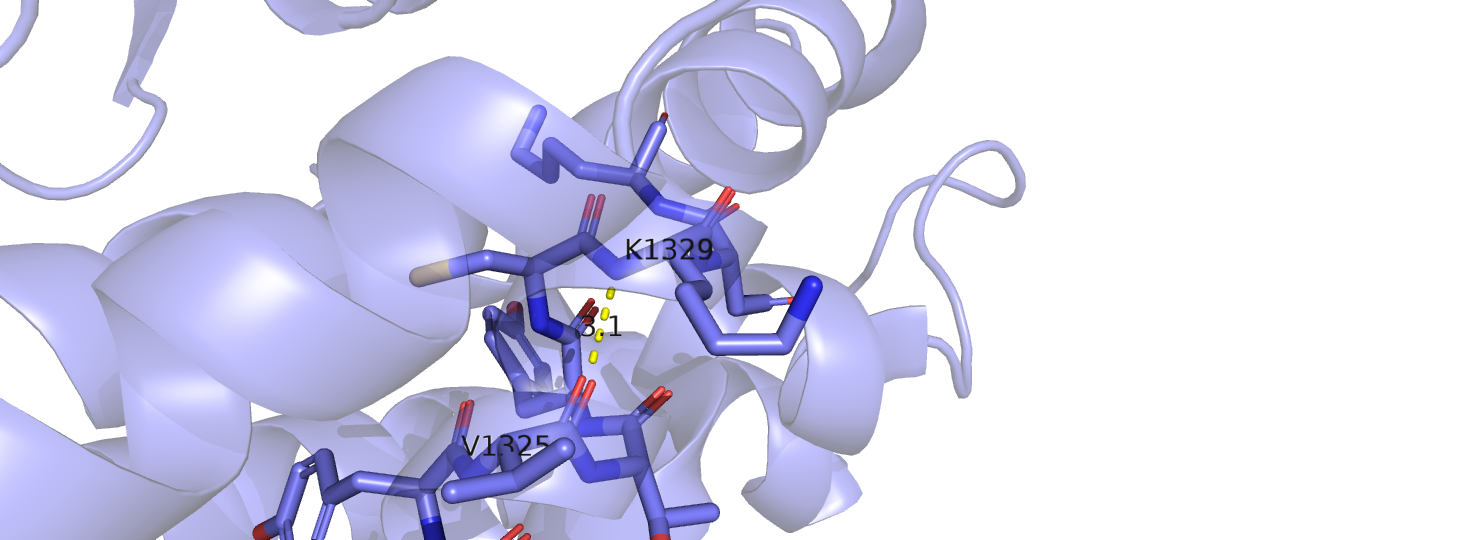
По структуре, полученной в РСА, я выбрала три водородные связи. В следующей таблице приведены остатки и атомы, участвующие в образовании связей. Нумерация соответствует порядковому номеру аминокислоты в белке (а также в структуре ЯМР), в скобках даны номера остатков в структуре РСА. Первая водородная связь образована атомами остова в одной из альфа-спиралей, вторая - атомами боковых цепей остатков из соседних альфа-спиралей, третья - атомами остова в одной из петель, торчащей на поверхность.
| Донор | Акцептор | Расстояние в РСА | Число моделей ЯМР, где есть водородная связь | Процент моделей ЯМР, где есть водородня связь | Минимальное расстояние в ЯМР | Максимальное расстояние в ЯМР | Медианнное расстояние в ЯМР | |
| LYS 108 (1329) N остова | VAL 104 (1325) O остова | 3.1 | 15 | 100 | 3.2 | 3.6 | 3.4 | |
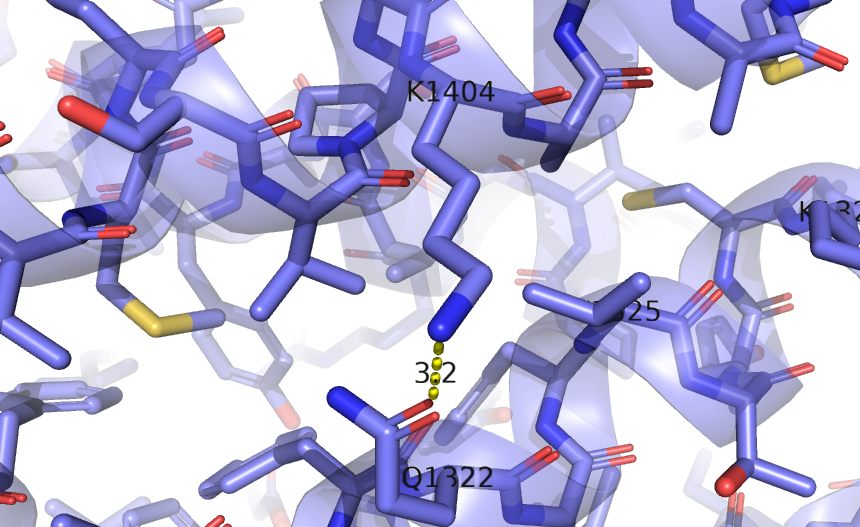
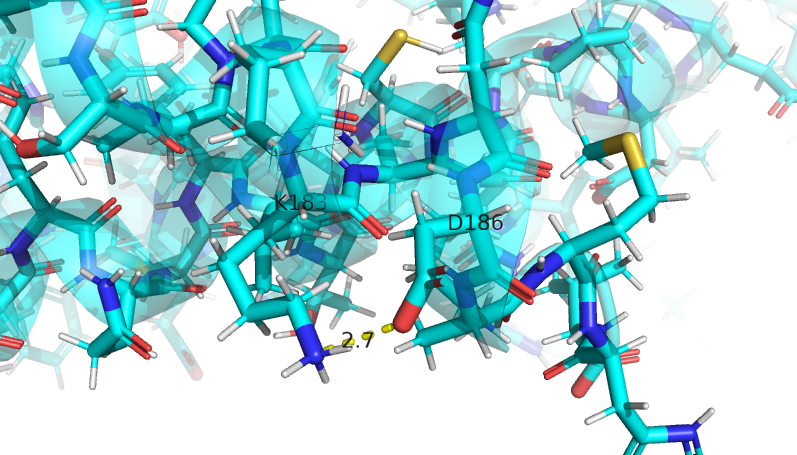
| LYS 183 (1404) N радикала | GLN 101 (1322) O радикала | 3.2 | 0 | 0 | 5.1 | 9.5 | 7.3 | |
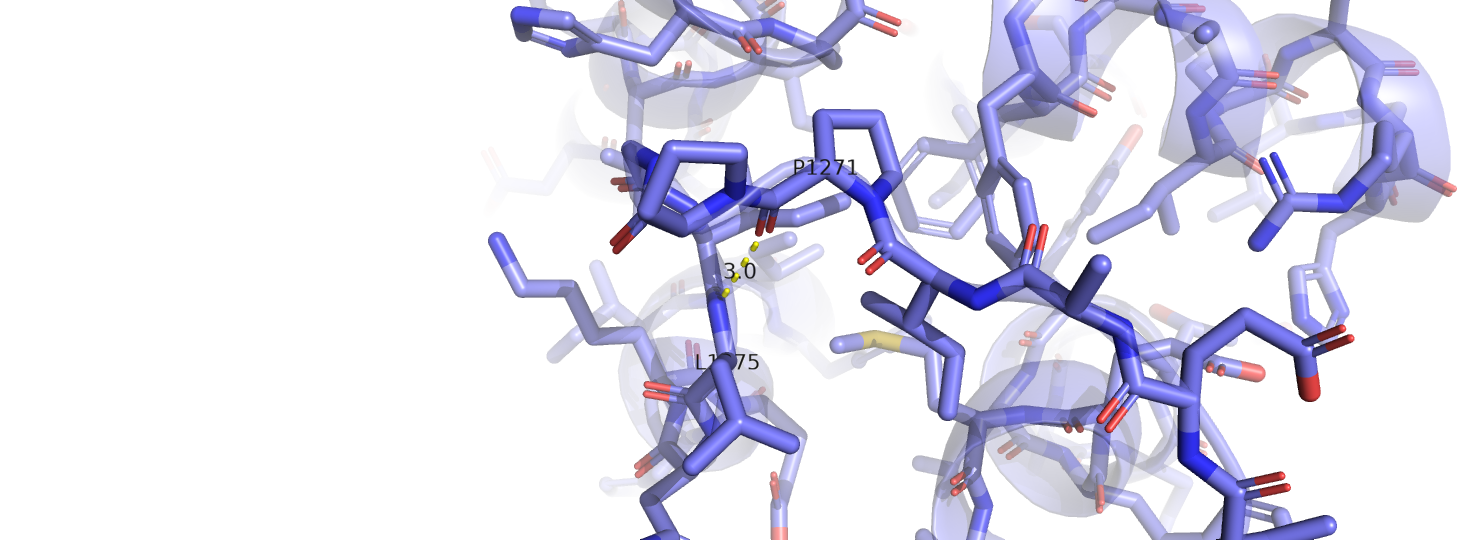
| LEU 54 (1275) N остова | PRO 50 (1271) O остова | 3 | 15 | 100 | 3.3 | 3.4 | 3.4 |
Несмотря на то, что в первом случае расстояние в моделях ЯМР между атомами, образующими водородную связь, больше, чем в модели РСА, мне кажется, что взаимное расположение атомов (угол N-H-O) во всех моделях позволяет образовать водородную связь. Во втором случае, как можно заметить, в моделях ЯМР водородная связь между рассмотренными атомами не найдена вовсе. В большинстве моделей ЯМР глутамин имеет другую ориентацию (концевые азот и кислород инвертированы относительно структуры РСА), а лизин образует водородную связь с другим остатком (аспартат 186). В третьем случае модели согласуются, хотя снова в моделях ЯМР расстояние между донором и акцептором чуть больше. Видимо, рассмотренная петля почему-то не очень подвижна, несмотря на то, что находится на поверхности.
© Быкова Даша, 2020