В этом задании используем структуру с pdb id из первого практикума (5REX), содержащую протеазу коронавируса с лигандом T4V. При помощи Poseview попытаемся сгенерировать для данной структуры 2D диаграмму взаимодействий с лигандом.
Poseview выдаёт "No interactions found by the PoseView interaction model. Try different options". Такое поведение согласуется с тем, что я (не) получила в практикуме 1. Данный лиганд связан с белком ковалентно, и это основной тип взаимодействия.
Рассмотрим два pdb файла. Каждая структура представляет комплекс антитела с пептидным антигеном. Одна из позиций антигена была заменена на глицин. Задание состоит в том, чтобы выяснить, какой остаток исходно был в этой позиции.
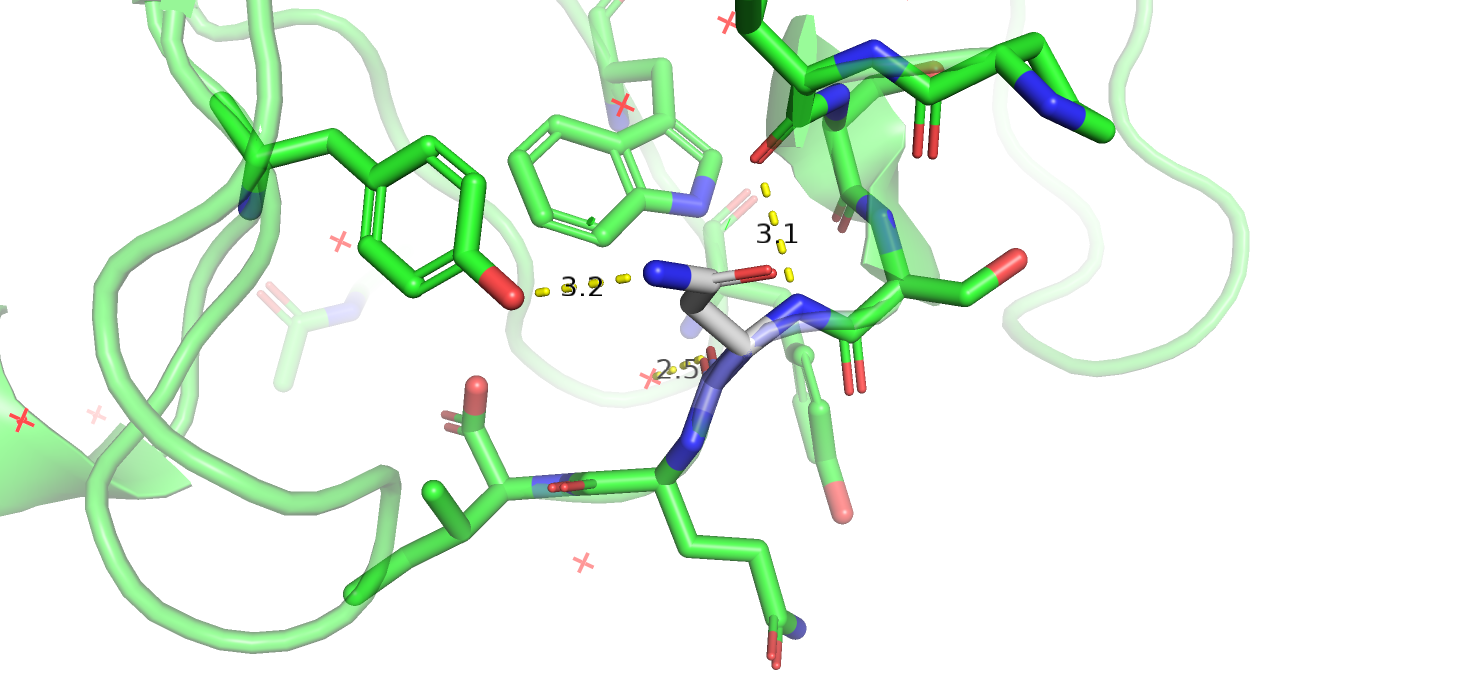
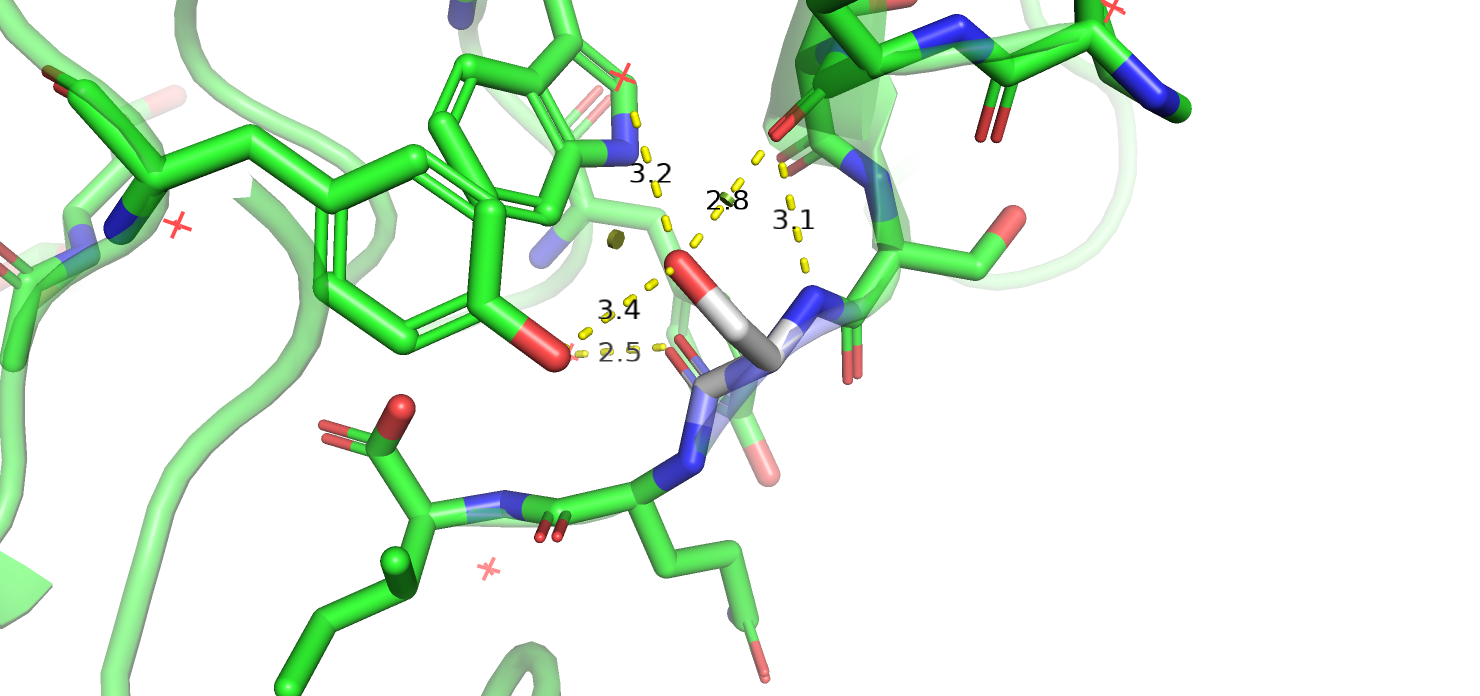
В первой структуре заменён остаток 605 в цепи L. Неизвестный остаток образует две водородные связи за счёт остова - с соседним треонином за счёт аминогруппы и с водой за счёт кислорода. Соседние остатки, с которыми наиболее вероятно взаимодействие, - тирозин и пролин. Остаток расположен в петле, вокруг, в основном, полярные группы, так что, скорее всего, он тоже полярный. Аспарагин, будь он в данной позиции, мог бы образовать водородную связь с тирозином, кислород тирозина должен при этом быть акцептором водородной связи. Глутамин оказывается слишком длинным, чтобы вступать в подобное взаимодействие. Серин и треонин, похоже способны образовать по целых три водородные связи в данном контексте: с водой, тирозином и кислородом остова. Серин в данном случае выглядит чуть более оптимальным при переборе множеств ротамеров. Для кислорода остова -OH группа серина может служить донором водорода, для тирозина и воды - акцептором, удовлетворяя таким образом все возможные потребности в образовании водородных связей. Итак, я считаю, что вместо глицина в данном месте должен быть серин.


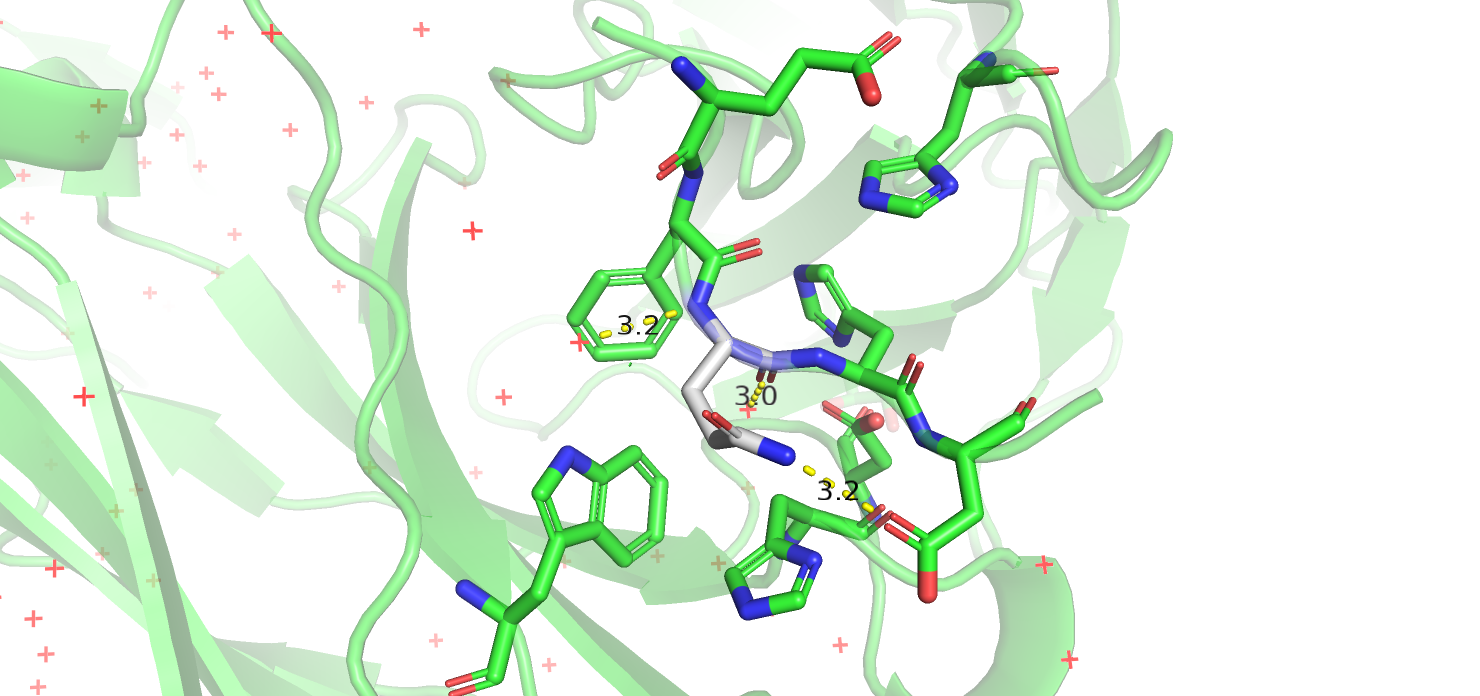
Во второй структуре заменён остаток 5 в цепи P. Рассмотрев положение и окружение данного остатка, я сразу отмела варианты с гидрофобными аминокислотами. Остаток расположен в неструктурированной периферийной части белка. По соседству вообще нет алифатических остатков, и соседи, с которыми неизвестный остаток потенциально мог бы вступить во взаимодействие - аспартат, гистидин и триптофан. Ароматические остатки на роль X не годятся, потому что они слишком большие и их не выходит разместить так, чтобы они не мешали окружению, то же относится и к лизину. Кажется, что маленьким серину, треонену и цистеину ничто не мешает быть на месте X, но ничто и не указывает на какие-то выгодные взаимодействия с ними. Остаются глутамат, аспартат, соответствующие амиды и аргинин. Аргинин мог бы образовать с соседним аспартатом солевой мостик, но рядом есть также положительно заряженный гистидин. Глутамин кажется более удачным кандидатом, так как может образовать с аспартатом водородую связь. От кислых остатков можно было бы ожидать взаимодействие с триптофаном и/или гистидином. Кроме того, теоретичски возможно взаимодействие их протонированных форм с аспартатом (или наоборот), но на деле, как мне кажется, такой ситуации не наблюдается. В случае аспартата возможна водородная связь с триптофаном (азот в кольце), для глутамата образование водородной связи ни в одном из положений не представляется возможным. Я склонна считать, что в данном случае на месте глицина должен быть глутамин, хотя, возможно, если учитывать изменение ориентации остова, можно получить более оптимальное решение.
© Быкова Даша, 2020