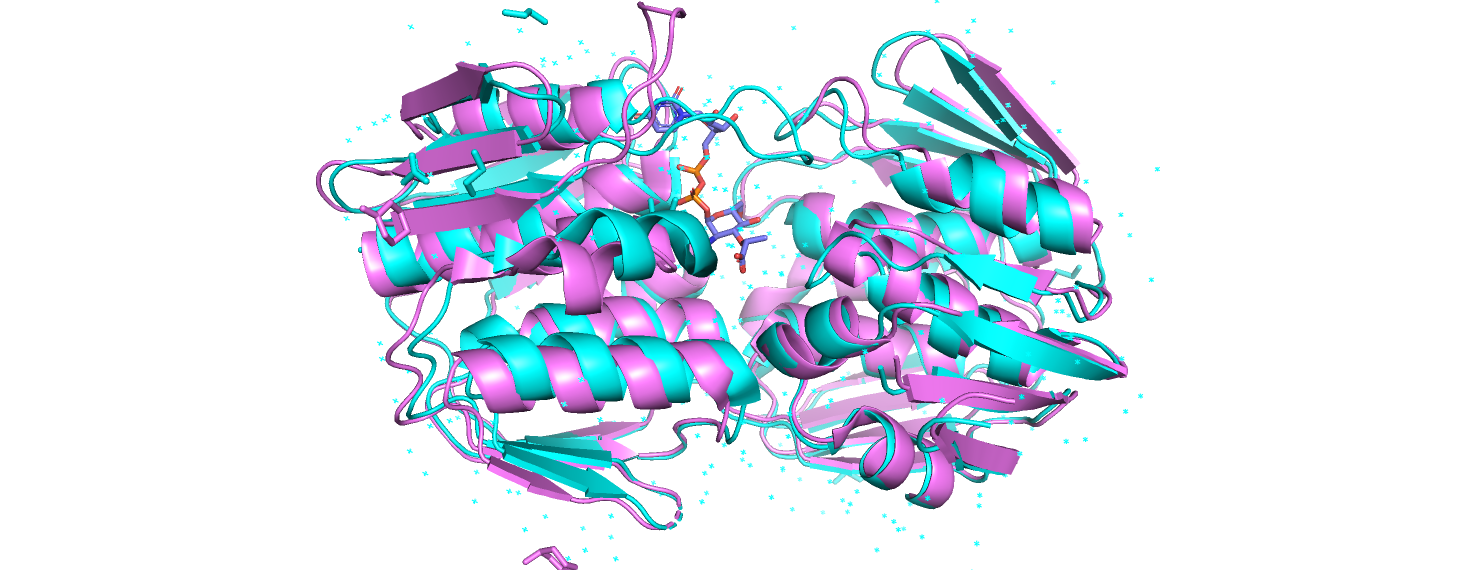
Рассмотрим пару структур с pdb id 3su9 и 1ejd. 1ejd соответствует открытой форме белка (несвязанный фермент murA), 3su9 - закрытой (murA в комплексе с UDP-N-ацетилмурамовой кислотой). При наложении структур друг на друга отчётливо видна разница в положении одной из петель (сверху слева на рис. 1), а также некотрое несоответствие в положениях альфа-спиралей (слева на рис. 1).

Вычислим для обеих форм площадь молекулярной поверхности (MS) и площадь поверхности, доступной растворителю (SAS) при помощи команды PyMol get_area. Все площади посчитаны именно для самих белковых молекул, без учёта лигандов.
MSA(1ejd) = 41436.879 Angstroms^2; SASA(1ejd) = 17538.910 Angstroms^2
MSA(3su9) = 41593.711 Angstroms^2; SASA(3su9) = 16989.127 Angstroms^2
Интересно, что различие между SASA и MSA для двух конформаций в разные стороны: MSA закрытой формы немного больше, а SASA сильно меньше, чем соответствующие площади для открытой формы. Однако различием в MSA можно пренебречь - оно составляет около 0.4%, в то время как SASA различаются на 3.2%, то есть на порядок сильнее. Возможно, петля, так сильно изменяющая своё положение, служит крышкой для кармана, в который залезает лиганд. Таким образом, в закрытой форме карман закрывается, что уменьшает площадь поверхности, доступной растворителю.
SASA и MSA в обоих случаях отличаются между собой больше, чем в два раза: площадь молекулярной поверхности значительно больше, чем площадь поверхности, доступной растворителю. Это ожидаемо, так как понятно, что молекулярная поверхность гораздо более холмистая и неровная.
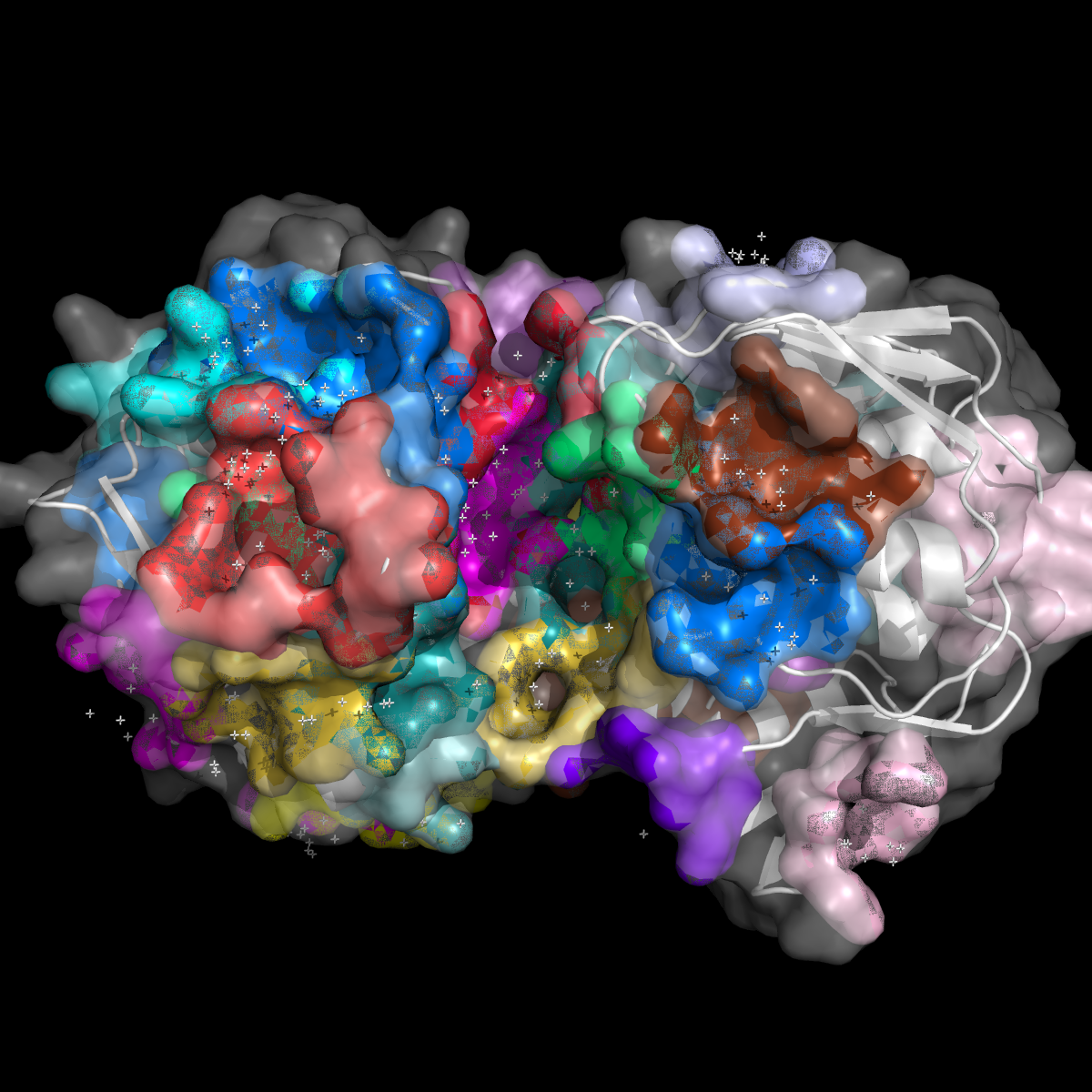
Попытаемся визуально определить положение основного кармана связывания. Это нетрудно, поскольку белок у нас есть в обеих формах, и мы точно знаем, где связывается лиганд. При помощи веб-сервера fpocket предскажем положение и параметры карманов на поверхности молекул. Найденный глазами карман программа идентифицирует как несколько отдельных карманов, я насчитала 7. Их суммарный объём - где-то между 11423 и 14950, в зависимости от того, учитывать ли нулевой карман, который примерно наполовину перекрывается с найденным визуально. Для закрытой формы я бы включила 4 кармана из выдачи fpocket в карман, найденный визуально. Их суммарный объём - 6694, что примерно в два раза меньше, чем объём кармана в открытой форме. В статье, где опубликована структура 3su9 (DOI: 10.1074/jbc.M112.342725), подробно разбирается механизм катализируемой реакции и роль каждого из остатков в кармане. Подробный разбор механизма выходит за рамки данного практикума, поэтому попытаемся оценить из общих соображений, что даёт описанное изменение конформации для процессирования субстрата. Во-первых, это создание подходящего окружения для каталитического центра (более подробное устройство кармана см. в следующем задании): некоторые остатки могут менять свои свойства в зависимости от того, находятся ли они в растворе или в гидрофобном окружении, и это может иметь значение при катализе. Во-вторых, катализируемая реакция (присоединение фосфоенолпирувата к UNAG) требует сближения и фиксации субстратов. Фосфоенолпируват присоединяется ковалентно к цистеину 115, который входит в состав подвижной петли - хлопающей крышки нашего кармана. Очевидно, при катализе, он должен подойти к UNAG максимально близко, что выражается в локальной компактизации белка, то есть уменьшении объёма кармана.
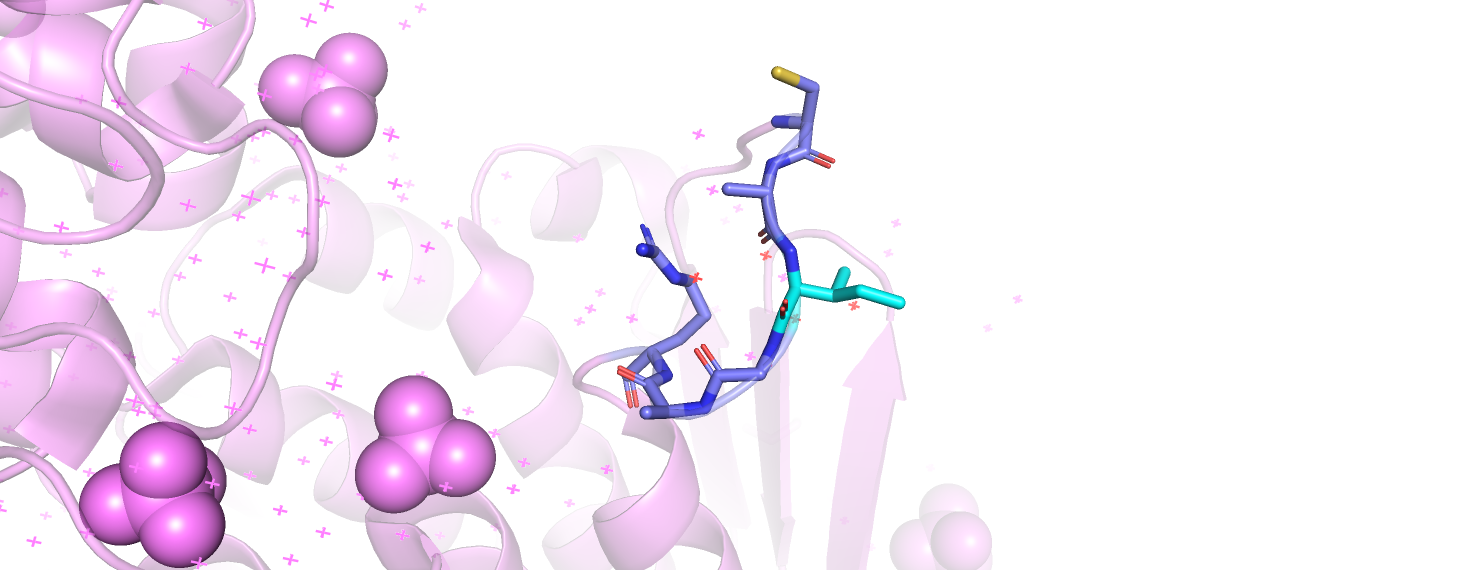
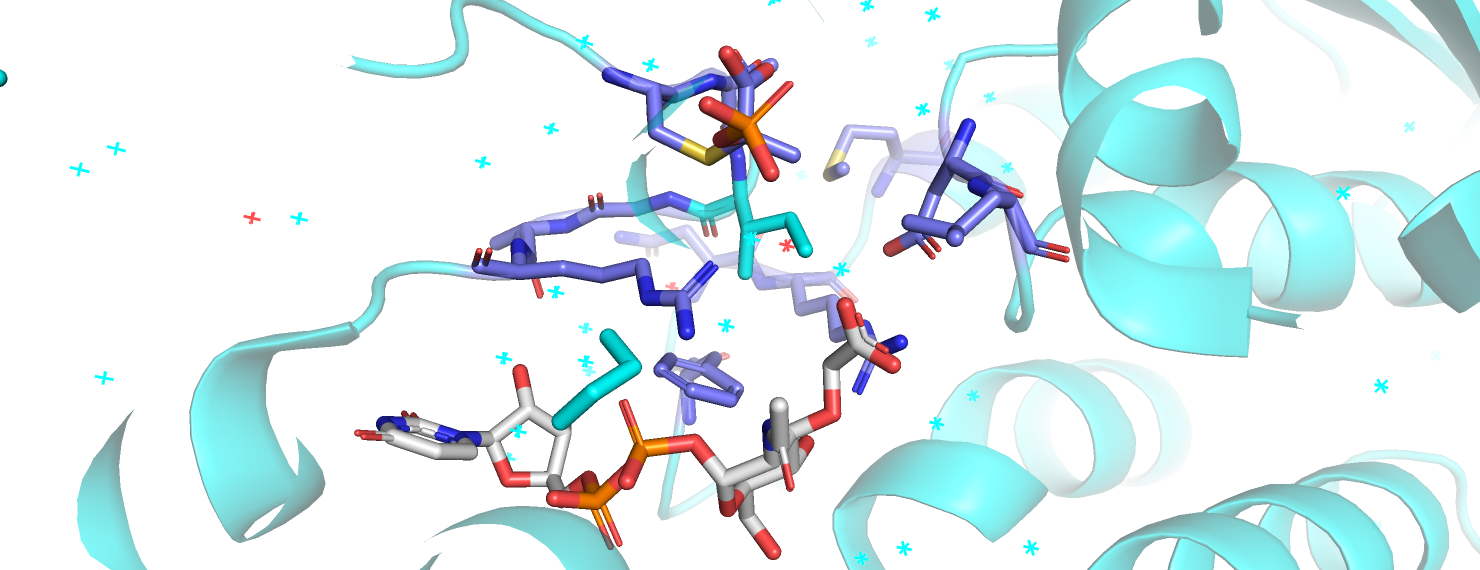
При помощи программы mkdssp вычислим экспонированность для каждого остатка. DSSP вычисляет экспонированность как SASA(остатка)/10. При помощи prody я распарсила файлы с выдачей DSSP и извлекла из них информацию об экспонированности в обеих формах. Как правильнее сравнить эти экспонированности: взяв их разность или отношение? Из общих соображений кажется, что в случае абсолютной экспонированности (её выдаёт DSSP) для сравнения более показательно будет отношение, так как мы сделаем поправку на свойства остатка: иначе для разных остатков эти разницы будут несравнимы. Впрочем, в данном случае, для поиска остатка с наибольшей разницей в экспонированности годится и определение разницы через разность, и через отношение (с псевдокаунтом в знаменателе): наиболее меняющим экспонированность остатком является ILE 117 (в открытой форме 155, в закрытой - 4). ILE 117 находится в петле, которая привлекла наше внимание с самого начала. В открытой форме он, неожиданно для изолейцина, находится на самой поверхности глобулы и обращён в раствор, тогда как в закрытой обращён внутрь, к лиганду. На рис. 3 можно рассмотреть его окружение 5 Å в обеих формах. В открытой форме всё окружение остатка - его соседи по петле, в закрытой окружение остатка куда более разнообразно. Окружение ILE117, а, по сути, карман с лигандом, в закрытой форме, примерно напополам состоит из гидрофобных остатков (фенилаланин, лейцин, сам изолейцин, цистеин) и заряженных (два аргинина, аспартат и сюда же можно отнести модифицированный цистеин 115 - с ним ковалентно связан фосфоенолпируват). Таким образом, рассматриваемый остаток участвует в гидрофобном взаимодействии, которое, вероятно, формирует подходящие условия для заряженных каталитических остатков.
© Быкова Даша, 2020