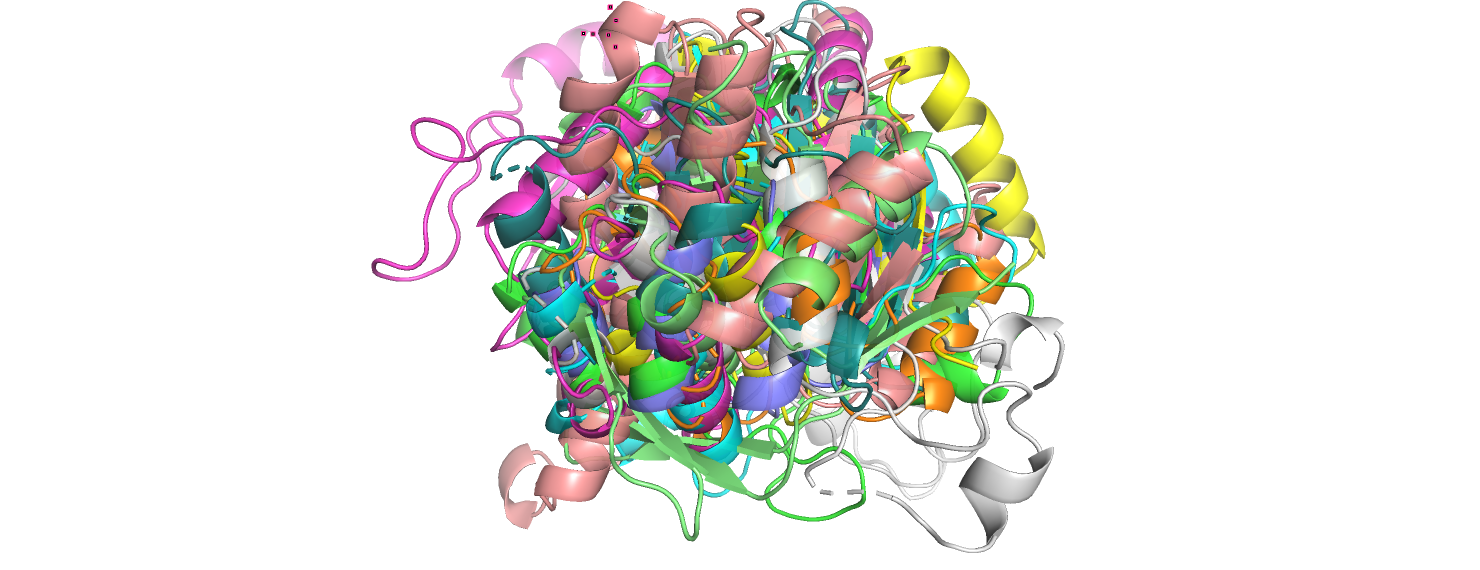
Дано 10 записей PDB. Соответствующие этим структурам последовательности демонстрируют не более 40% попарного сходства. Выберем первую из этих структур (2o4cA02) как опорную и выравним все остальные по ней (super pdb2, pdb1). Результат выравнивания можно увидеть на рис.1.

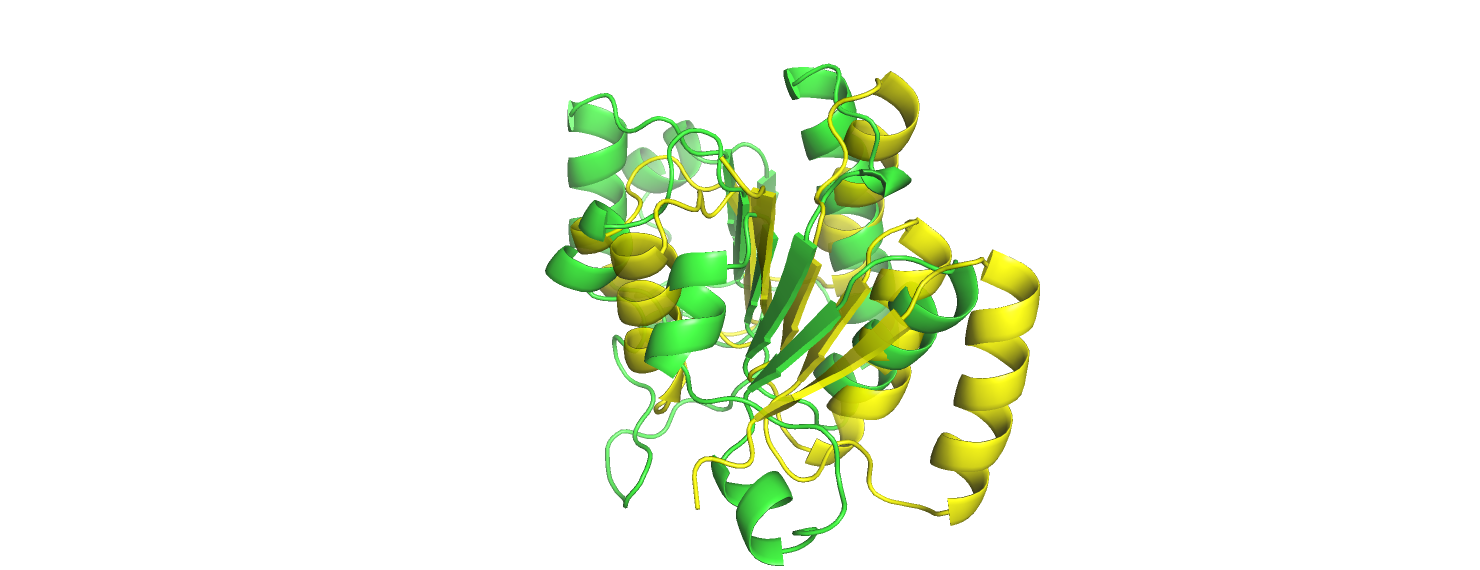
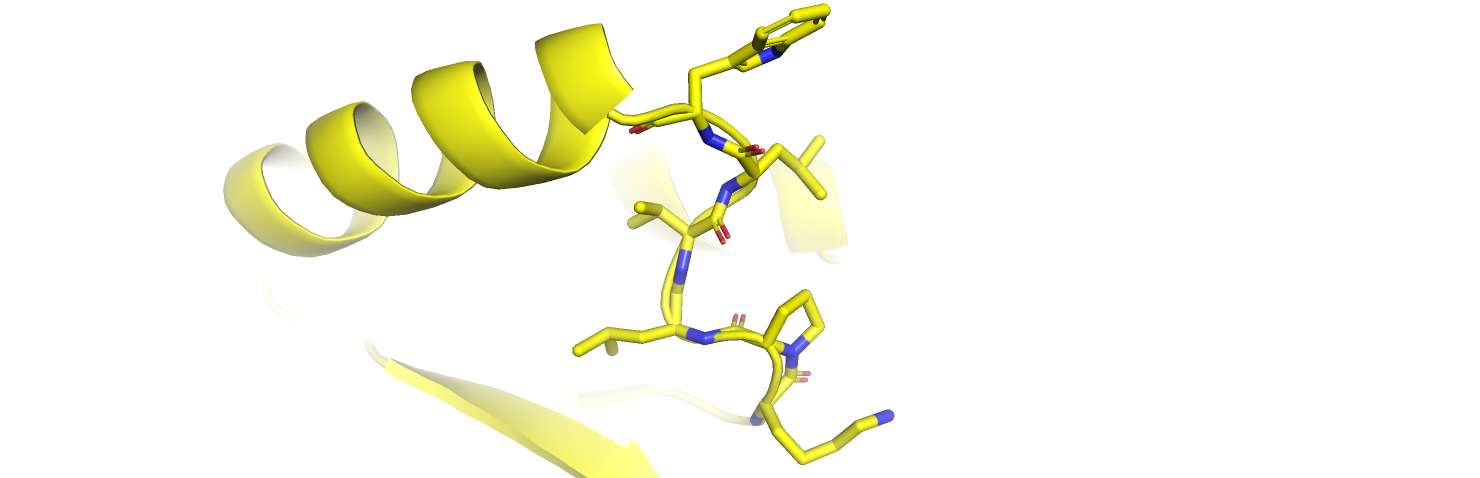
Глядя на полученную картину, нельзя сказать, что белки имеют одинаковую третичную структуру. Но если рассматривать структуры по отдельности или попарно, то окажется, что укладка у них очень похожа: везде есть β-α-β мотив, то есть все эти белки состоят из чередующихся β-тяжей и α-спиралей, однако их количество и положение в пространстве относительно друг друга может быть различным. В качестве иллюстративного примера приведу одно из выравниваний на рис. 2: как можно видеть, выравнивание не очень хорошее, хотя паттерн вторичных структур прослеживается один и тот же. Белок, изображённый зелёным на рис. 2, начинается с крайней α-спирали, в то время как белок, изображённый жёлтым, - с центрального β-тяжа. В выравнивании третичных структур β-листы и α-спирали оказываются сдвинутыми относительно друг друга. Думаю, что данная группа белков - какое-то подмножество некоторой топологической группы в CATH.
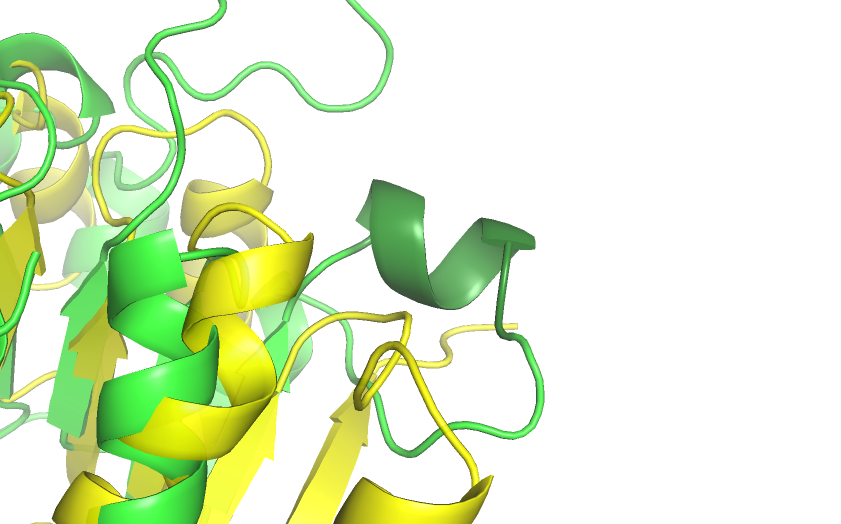
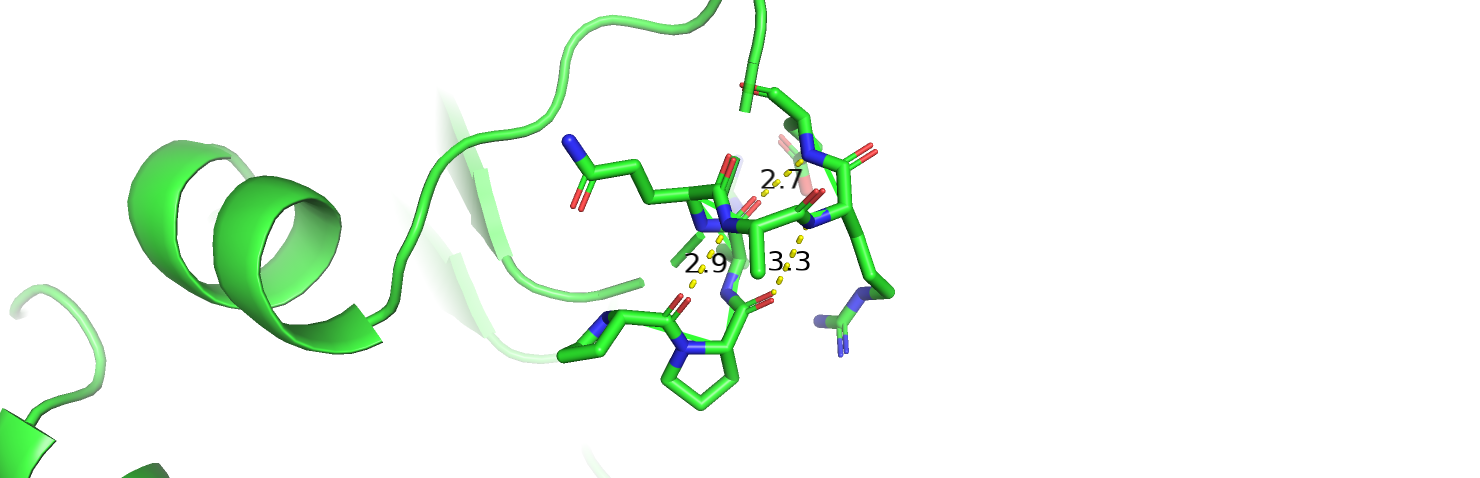
Pymol делает разметку вторичной структуры по умолчанию, используя алгоритм dssp. Воспользуемся примером из предыдущего задания и рассмотрим аналогичные участки белков, где Pymol немного по-разному размечает вторичную структру (рис. 3). В одной из структур Pymol отмечает небольшую α-спираль, в другой структуре на этом месте просто петля. "Альфа-спираль" начинается с двух пролинов, что порождает некоторые сомнения. Однако внутри предполагаемой вторичной структуры я обнаружила три водородные связи между атомами остова: все они образованы с шагом 4 остатка и в каждом образованном цикле 13 атомов, что свидетельствует в пользу того, что перед нами действительно альфа-спираль. В то же время, на аналогичном участке другой структуры водородных связей между атомами остова не найдено и спирали там действительно нет.
Для каждого из 10 pdb сгенерируем разметку вторичной структуры с помощью dssp. Используя python, расчитаем склонности каждого типа аминокислоты образовывать тот или иной тип вторичной структуры (amino acid secondary structure propensity): P_ik = (n_ik/n_i) / (N_k/N), где P_ik - это propensity аминокислотного остатка i образовывать тип вторичной структуры k, n_ik - это количество остатков i в датасете, образующих тип вторичной структуры k, n_i - это общее количество остатков i в датасете, N_k - это общее количество остатков, образующих тип вторичной структуры k во всем датасете, N - это общее количество остатков в датасете. Отметим, что в этом задании для простоты мы рассматриваем только три типа вторичных структур: альфа-спираль ('H'), бета-лист ('E') и петля ('C') (петля = всё, что не является бета-листом или альфа-спиралью). Кроме того, необходимо добавить в формулу для расчёта псевдокаунты (или "псевдоотсчёты"): ведь если в нашем небольшом датасете из 10 структур какой-то тип остатка никогда не встретится в одном из типов вторичных структур, это не значит, что он там вообще никогда не встречается. Псевдокаунты можно выбирать по-разному, в данном случае я просто прибавила 1 к каждому числу в формуле, искусственно добавив таким образом 1 остаток данного типа в данную вторичную структуру. Таблицу, которая получилась в результате, можно увидеть здесь:
Ссылка на таблицу с результатами
Выяснилось, что в бета-листах больше всего любит появляться валин (встречается примерно в 2.5 раза чаще, чем ожидается), в альфа-спиралях - метионин (propensity = 1.78), а на втором месте после него с небольшим отрывом - глутамин (1.71), в петлях - глицин (propensity = 1.5). Бета-листы вообще предпочитают алифатические и ароматические остатки: кроме валина, лейцин и изолейцин, фенилаланин и триптофан. Бета-листы, видимо, удобны для образования гидрофобных ядер, радикалы остатков могут торчать внутрь белка и не взаимодействовать ни с чем полярным. Альфа-спирали, в среднем, более гидрофильны. Мне не вполне понятно, почему метионин отдаёт предпочтение им и совсем не вcтречается в бета-листах (в датасете не встретился ни разу). Поскольку в данном случае мы рассматриваем не случайное множество белков, а белки, по-видимому, относящиеся к одному структурному семейству (см. 1 задание), функционально они тоже могут быть схожи. Могу предположить, что метионин может входить в активный центр данной группы белков и, например, участвовать в связывании лигандов, и данную функцию, скорее всего, удобнее осуществлять, находясь в альфа-спирали или петле, а не в жёстком гидрофобном бета-листе. Что касается предпочтения глицином петель, то это легко объяснимо: глицин может принимать множество различных конформаций, и, следовательно, мы ожидаем его увидеть в более гибких, неструктурированных участках белка.
© Быкова Даша, 2020