Восстановление кристалла из PDB файла
1. Взаимодействия в структуре 3ВМХ, определяющие стабильность кристалла из белков
Продолжаем работу соструктурой бета-N-гексаминидазы Bacillus subtilis 3ВМХ. В поле CRYST1 pdb-файла указана следующая информация:
CRYST1 58.385 73.085 83.567 79.79 69.61 88.25 P 1 2
Отсюда получаем кристаллографические характеристики:
Длины направляющих векторов кристалла:
a = 58.385 Å
b = 73.085 Å
c = 83.567 Å
Углы между направляющими векторами кристалла:
α = 79.79°
β = 69.61°
γ = 88.25°
Кристаллографическая группа: P 1, то есть ячейка триклинная.
Рис.1. Триклинная кристаллографическая симметрия.
Число молекул в ячейке: 2
Построение соседних асимметрических ячеек было выполнено в PyMol при помощи команды:
symexp sym, 3bmx, all, 50

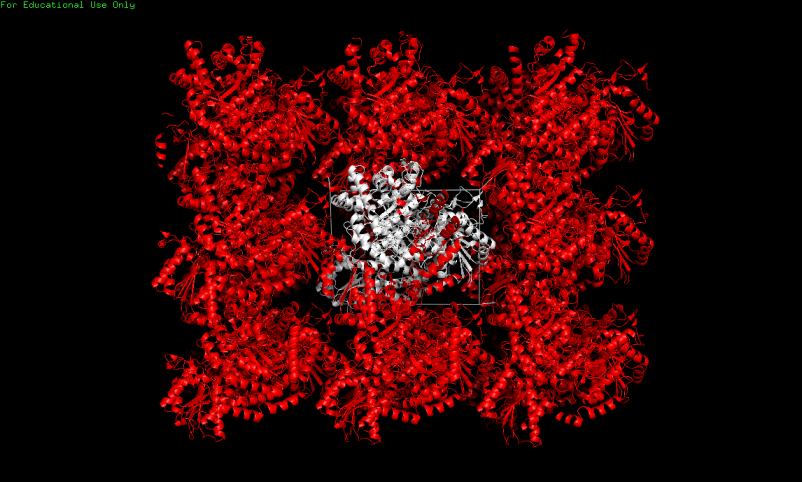

Рис.1. Фрагмент кристалла белков 3ВМХ. Исходная структура выделена белым. Затем средствами PyMol были визуализированы остатки, принимающие участие во взаимодействии с соседними асимметрическими ячейками. Взаимодействующими считались остатки, атомы боковых цепей которых расположены на расстоянии не более 3,5 ангстрем.
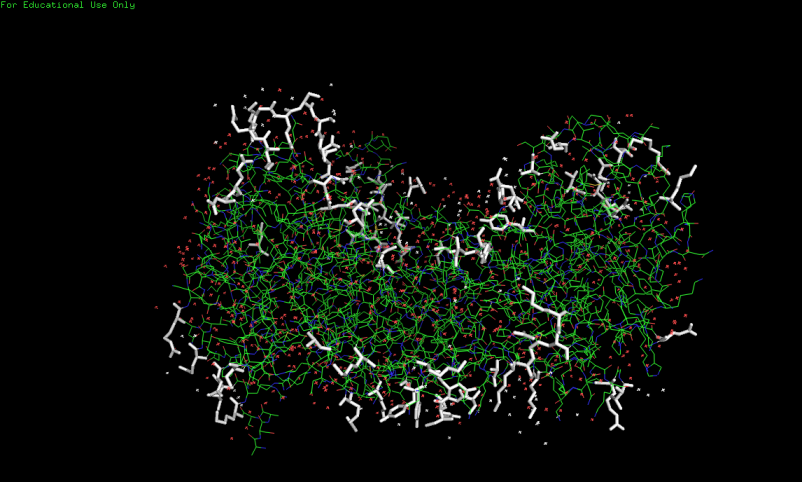
Рис.2. Взаимодействия с соседними ячейками. Остатки, участвующие во взаимодействии выделены белыми палочками. Остатки, участвующие во взаимодействии можно объединить в области. Таких областей около шести на одну ячейку. Одна из таких областей была изучена более подробно. Результаты представлены на рисунке ниже.
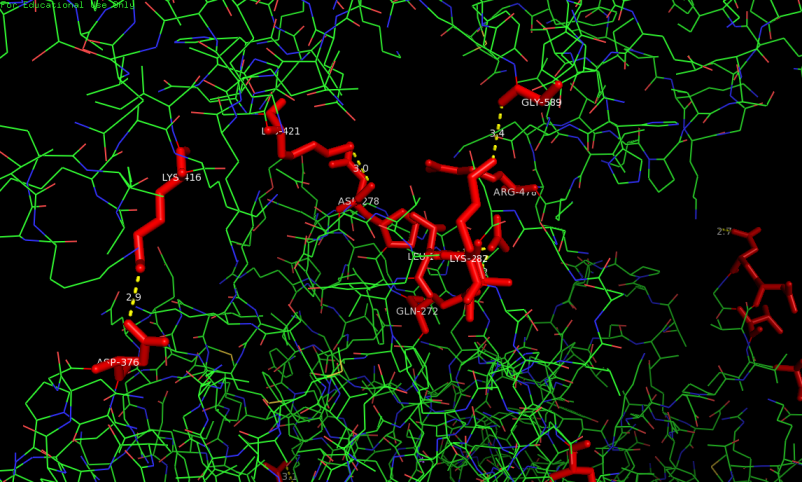
Рис.3. Зона контакта белков из соседних ячеек. Красными палочками выделены остатки, принимающие участие во взаимодействии. Обозначены водородные связи. Остатки, образующие их подписаны.
Рассмотренные взаимодействия, по всей видимости, не играют физиологической роли, поскольку известно, что изучаемый фермент функционирует в форме мономера. Однако рассмотренные взаимодействия, включая обозначенные на рисунке выше водородные связи, скорее всего, сделали возможной получение кристалла данного белка.
2. Странное расположение белковых цепей в структуре ДНК-белкового комплекса 3HDD
PDB-запись 3hdd содержит 3D-структуру гомеодомена engrailed из Drosophila в комплексе с молекулой ДНК, с разрешением 2,2 ангстрема. Ниже на рисунке показано, что одна цепь расположена на краю молекулы ДНК, что не совсем естественно, теряется часть связей, которые белковая цепь образует с ДНК. Для того, чтобы разрешить эту странность, с помощью команды symexp были восстановлены соседние ячейки. После восстановления видно, что белковая цепь, находящаяся на краю одной молекулы ДНК, на самом деле контактирует с молекулой ДНК из соседней ячейки. При этом видно, что происходят те же взаимодействия, что и в случае белка, расположенного в середине ДНК. Вероятнее всего, при кристаллизации цепь ДНК была целой. Понимание этого нюанса строения кристалла ДНК-белкового комплекса рассеивает странность. В пользу такой догадки говорит ещё и тот факт, что концы ДНК соседних ячеек липкие и подходят друг другу. Если их соединить, как раз получится сайт связывания 3HDD.
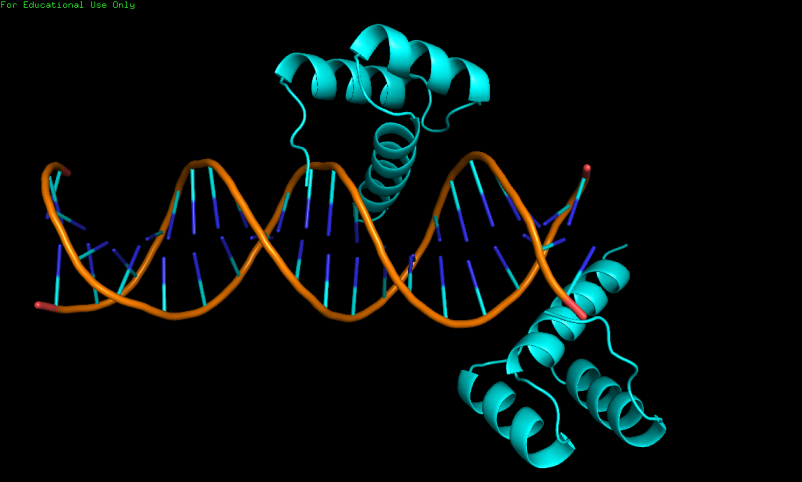
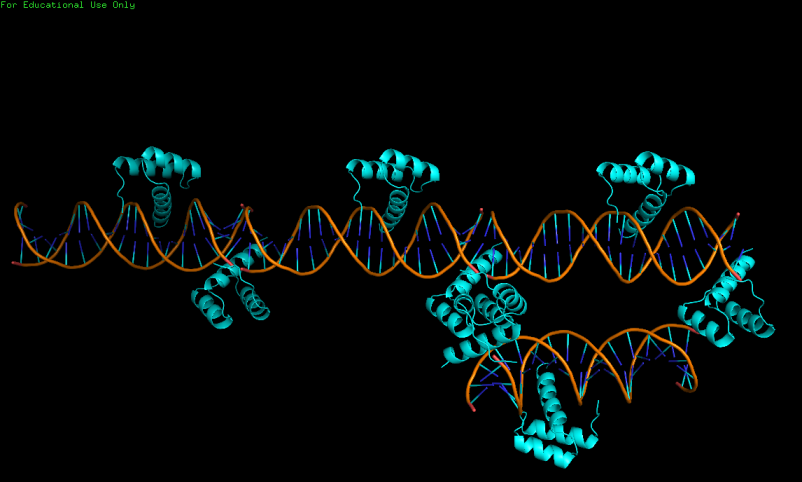
Рис.4. Структура 3HDD.Слева-одна ячейка, справа-несколько соседних.